您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-15 09:56
为确保产品安全性和功效,蛋白质治疗制剂必须在制造之后以及指定的保质期结束时,还能够达到所规定的质量特征。许多物理和化学因素会影响生物制药产品的质量和稳定性,尤其是生物制剂长期保存在密闭的容器系统中之后,温度,光线以及运输和处理过程中的搅动可能会使得生物制剂发生变化。与传统化学药物相比,蛋白质是具有比较复杂的物理化学特征和较大的分子实体,从其一级氨基酸序列到高级的二级和三级结构,在某些情况下还包括诸如亚基缔合等四级元素。
许多蛋白质被糖基化,一些蛋白质具有其他形式的翻译后修饰,例如磷酸化,这也是影响其潜在的降解途径以及其降解动力学的相关因素。蛋白质通常对溶液化学性质的微小变化比较敏感。它们仅在相对较窄的pH和渗透压范围内保持成分和构象的稳定,而且许多溶液还需要额外的支持性制剂成分才能使蛋白质稳定的保留在溶液中,特别是随着时间的流逝,即使是冻干蛋白质产品也会发生降解。
分析化学的进步已经确定了随着时间的流逝,重组蛋白治疗产品中可能发生许多降解途径。这些途径产生化学或物理不稳定性。化学不稳定性是指多肽或蛋白质结构内共价键的形成或破坏。蛋白质的化学修饰包括氧化、脱酰胺、还原和水解。
而蛋白质的展开、解离、变性、聚集和沉淀被称为构象或物理不稳定性。在某些情况下,蛋白质降解途径具有协同作用:化学事件可能触发物理事件,例如在氧化之后发生聚集。
在这里,我们介绍了几种蛋白质降解途径:氧化、光降解、二硫键变化、脱酰胺、聚集、沉淀、解离和断裂。我们举例说明了每种的生物化学特征,显示了诱导变化的潜在手段并提出了预防方面的制剂注意事项。并且以检测方法和验证稳定性指示方法的策略作为结尾。我们的目标是为蛋白质产品的主要降解途径提供简介(或复习),并为每种途径提供参考。我们鼓励各位“药时空”读者查阅这些参考文献,以获取每种途径的基本生物化学的扩展详细信息,描述特定蛋白质实验的案例研究以及有关制剂开发策略的更多信息。
氧化、光降解和二硫化物变化
某些氨基酸与环境中存在的氧自由基的反应,蛋白质和多肽容易受到氧化损伤。蛋氨酸、半胱氨酸、组氨酸、色氨酸和酪氨酸最易被氧化:Met和Cys因其具有硫原子而His、Trp和Tyr因其芳环而受到氧化。氧化可改变蛋白质的物理化学特性(例如折叠和亚基缔合)并导致聚集或断裂。根据蛋白质中氧化氨基酸相对于其功能性或表位样结构域的位置,它也可能对效价和免疫原性产生潜在的负面影响。
例如,甲状旁腺激素生物活性差异影响通过任一的Met-8或Met-18和双氧化的单氧化(MET-8为Met-18)当每个物种中分离,并使用在检测体外生物测定法。同样,源自大肠杆菌的人干细胞因子(huSCF)中Met-36和Met-48的氧化分别将其效价降低40%和60%,同时将SCF二聚体的解离速率常数提高了2到3倍,表明对亚基结合和三级结构有影响。在其他情况下,即使看到实质性的结构变化,氧化对蛋白质效能也没有可测量的影响。例如,干扰素α-2b中的氧化Met-111影响了分子的一级,二级和三级结构,并通过单克隆抗体(MAb)阻止了位点特异性表位的识别,而没有改变体外生物学活性。
涉及的机理和因素:下图1显示了蛋氨酸和半胱氨酸残基氧化的生化途径。蛋氨酸在溶液中被大气中的氧气和氧自由基氧化,形成蛋氨酸亚砜和蛋氨酸砜。这两种都比未氧化的蛋氨酸更大且极性更大,这可以改变蛋白质的折叠和结构稳定性。在碱性pH下,过氧化氢可提高重组人甲状旁腺激素(rHu-PTH)中蛋氨酸的氧化率。
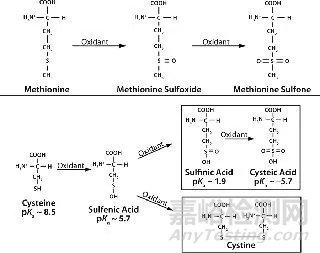
图1 蛋氨酸和半胱氨酸残基氧化的生化途径
半胱氨酸的氧化在碱性pH值上也更为普遍,使巯基去质子化。半胱氨酸的氧化在还原性环境中诱导二硫键断裂(图1,下图)。在这样的环境中,半胱氨酸氧化涉及硫醇盐离子对二硫键的亲核攻击,产生新的二硫键和不同的硫醇盐离子。然后,新的硫醇盐可以与另一个二硫键反应形成半胱氨酸。
这种由蛋白质降解形成的分子间二硫键会累积错配的二硫键和混乱的二硫键,从而改变蛋白质构象和亚基缔合。
在金属离子或附近的巯基存在下,半胱氨酸残基也可能自发氧化形成分子副产物亚磺酸和半胱氨酸。例如,人类成纤维细胞生长因子(FGF-1)表现出铜催化的氧化作用,可产生同型二聚体。
蛋白质中巯基的空间取向在半胱氨酸氧化中起重要作用。氧化速率与那些硫醇基团之间的距离成反比。与碱性成纤维细胞生长因子(bFGF)一样,这最终可能导致形成大的低聚物或非功能性单体,而碱性成纤维细胞生长因子(bFGF)包含三个易被氧化并形成分子间或分子内二硫键的半胱氨酸。
这种氧化作用通常会诱导蛋白质的构象修饰,因为半胱氨酸二硫键增加了蛋白质内部的侧链体积,并导致不利的范德华相互作用,从而维持了原始结构。
组氨酸残基通过与咪唑环的反应对氧化高度敏感,随后可生成其他羟基。氧化组氨酸可以在光源和/或金属氧化(产生天冬酰胺/天冬氨酸和2-氧代-组氨酸(2-O-His)的作为降解产物。它可能是一个短暂的部分,因为它可以触发蛋白质聚集和沉淀,从而使2-O-His的分离(作为单独的降解物)变得难以理解。酪氨酸的氧化可通过形成酪氨酸而导致共价聚集。空间因素也可能影响酪氨酸和组氨酸的氧化。相邻的带负电荷的氨基酸加速酪氨酸氧化,因为它们具有对金属离子的高亲和力,而带正电荷的氨基酸残基不利于反应。如果相邻氨基酸很大,则可能会掩盖相邻氨基酸的氧化并阻止其被氧化。已经观察到,以序列存在的组氨酸显着增加了肽的氧化速率和甲硫氨酸亚砜的产生。咪唑环在组氨酸侧链上的强金属结合亲和力使氧化物质靠近底物蛋氨酸。
光降解:光氧化会改变蛋白质的一级,二级和三级结构,并导致长期稳定性,生物活性或免疫原性方面的差异。暴露于光线下会触发一系列生化事件,即使关闭光源后,这些生化变化也会继续影响蛋白质。这些作用取决于赋予蛋白质的能量和环境氧气的存在。当化合物吸收一定波长的光时,就会引发光氧化作用,从而提供能量将分子提升到激发态。被激发的分子然后可以将该能量转移到分子氧,将其转换为反应性单线态氧原子。这就是在存在O的情况下可以在光下修饰色氨酸,组氨酸和酪氨酸的方法。酪氨酸光氧化可产生单,二,三和四羟基酪氨酸作为副产物。由于氧化的酪氨酸残基之间的交联,在某些蛋白质中观察到聚集。光氧化反应主要是位点特异性的。例如,在用强光处理的人类生长激素中,氧化主要在组氨酸处进行。另外,肽主链也是光降解的靶标。或者,通电的蛋白质本身可以以光敏方式直接与另一个蛋白质分子反应,通常是在低pH值下通过蛋氨酸和色氨酸残基。
赋形剂和可浸出物可以协同影响蛋白质的氧化(并因此降解)。
在某些情况下,配方成分会影响光氧化速率:例如,磷酸盐缓冲液比其他缓冲液系统更能促进蛋氨酸的降解速率。金属离子催化的氧化取决于环境中金属离子的浓度。Fe3+,Ca2+,Cu2+,Mg2+或Zn2+的0.15-ppm氯化物盐的存在不会影响人胰岛素样生长因子的氧化速率,但是当金属浓度增加到1ppm,观察到氧化显着增加。在还原剂(例如抗坏血酸盐)的存在下,氧化作用可能会加剧。抗坏血酸增加了人睫状神经营养因子的氧化。同样,溶液中变性/解折叠试剂的存在会增加蛋白质氧化的程度。稳定蛋白质结构所涉及的赋形剂(例如多元醇和糖)可以降低氧化速率。
氧化修饰取决于内在的结构特征,例如被掩埋和暴露的氨基酸。在人类生长激素的情况下,Met-14和Met-125容易被H2O2氧化,因为它们暴露于蛋白质表面,而处于隐蔽位置的Met-170只有在分子被氧化时才能被氧化。展开。同样,大气中的氧气会随着时间的流逝引起蛋白质氧化。顶空氧在结核菌素纯化蛋白(TPP)的多剂量小瓶中导致四个月内50%的效力丧失。
在蛋白质加工和存储过程中,通常由用作药用赋形剂的聚山梨酯和聚乙二醇(PEG)引起的过氧化物污染可导致氧化。已经观察到Tween-80中过氧化物的含量与rhG-CSF中的氧化程度之间存在相关性,并且过氧化物诱导的氧化似乎比来自大气氧的氧化更严重。过氧化物也可以从在初级包装容器封闭系统中使用的塑料或弹性体材料,包括预充式注射器。
预防措施:尽量减少氧化降解的一种分子工程策略是,如果蛋白质的性质允许,用耐氧氨基酸代替对氧不稳定的氨基酸。在治疗性干扰素β(IFN-β)中,第17位的半胱氨酸被丝氨酸取代,因为前者在储存过程中失去了抗病毒活性,导致氧化和二硫键争夺。用非天然存在的正亮氨酸替代表皮生长因子(EGF)的蛋氨酸也可以防止氧化降解。
在某些情况下,通过脱气去除顶空氧气可能对防止氧化有效。填充步骤在氮气压力下进行,并且小瓶顶部空间氧气置换成惰性气体,如氮气,以防止氧化。对于某些对氧化敏感的蛋白质,在惰性气体(例如氮气或氩气)的存在下进行处理。对于多剂量药物制剂,使用顶空量可忽略不计的药筒可克服氧化作用和相关后果。
在考虑更改容器密闭性时,必须格外小心。蛋白质治疗剂的许多此类更改(例如,从药瓶到预装注射器或从预装注射器到笔式设备)被认为可以提高患者的便利性和易用性。但是,当相同的材料与蛋白质基产品一起使用时,应重新评估仅基于化学药品的容器密闭系统的历史经验,因为这可能会对蛋白质降解产生意想不到的独特影响。
控制或增强诸如pH,温度,曝光量和缓冲液成分之类的因素,也可以通过影响蛋白质的环境来减轻氧化作用。半胱氨酸的氧化通常可以通过维持蛋白质制剂的正确氧化还原电位来控制,例如添加硫氧还蛋白和谷胱甘肽。抗氧化剂和金属螯合剂也可用于防止蛋白质制剂中的氧化。抗氧化剂是化学“牺牲目标”,具有强烈的氧化趋势,会消耗促进氧化的化学物质。为此,在生物治疗制剂中使用了诸如L-蛋氨酸和抗坏血酸等清除剂。在没有金属离子的情况下,半胱氨酸作为一种游离氨基酸可以作为有效的抗氧化剂。作为螯合剂,EDTA和柠檬酸盐可能与过渡金属离子形成络合物,并抑制金属催化的位点特异性氧化。由于糖和多元醇与金属离子的络合,因此添加糖和多元醇还可以防止金属催化的氧化。用人松弛素观察到了葡萄糖,甘露醇,甘油和乙二醇对金属催化氧化的保护作用。使用初级或次级包装系统进行物理防护以免受紫外线/白光照射,可能需要保护光不稳定的蛋白质免受光氧化。
脱酰胺
对于许多重组蛋白,可通过谷氨酰胺和天冬酰胺残基的非酶脱酰胺作用观察到肽和蛋白结构的变化。这可能对他们的生理化学和功能稳定性。已经观察到hGH的脱酰胺改变了人类生长激素的蛋白水解裂解。据报道,IFN-β的脱酰胺作用增加了其生物活性。已确定,与天然肽相比,导致天冬氨酰和异天冬氨酰形式的肽生长激素释放因子的脱酰胺作用分别降低了25倍和500倍的生物活性。血红蛋白中Asn-Gly位点的脱酰胺作用改变了其对氧气的亲和力。天冬酰胺的去酰胺化干扰了II类主要组织相容性复合物分子上的抗原呈递。据报道,人表皮生长因子中Asp 11的异构化导致其促有丝分裂活性降低了五倍。磷酸三糖磷酸异构酶中两个Asn-Gly序列的脱酰胺作用导致亚基解离。
涉及的机理和因素:脱酰胺作用是一种化学反应,其中酰胺官能团从氨基酸上去除。后果包括蛋白质的异构化,外消旋化和截短化。下图2显示了脱酰胺降解天冬酰胺的机理。
图2 显示了脱酰胺降解天冬酰胺的机理。
异构化:天冬氨酸到异天冬氨酸残基的异构化中的蛋白质溶液是非酶脱酰胺(最通常观察到的结果。
外消旋化:天冬酰胺脱酰胺过程中形成的琥珀酰亚胺的中间体是非常容易产生外消旋化,并转换为d-天冬酰胺残基。在碱性pH下观察到除甘氨酸以外的其他氨基酸的外消旋化作用。
截短:在低pH值下,肽和蛋白质的天冬酰胺侧链上的酰胺基团发生去质子化反应,然后酰胺酶的氮原子对天冬酰胺残基的肽羰基碳进行亲核攻击。这通过形成琥珀酰亚胺肽片段而产生肽链切割。琥珀酰亚胺环的随后水解可产生天冬酰胺基和β-天冬酰胺基肽。
天冬氨酸-异天冬氨酸脱酰胺和异构化反应的机理相似,因为它们都通过分子内环状酰亚胺中间体进行。各个酰胺残基的脱酰胺速率取决于其一级序列和三维(3D)结构以及溶液性质,例如pH,温度,离子强度和缓冲离子(45)。谷氨酰胺残基脱酰胺率通常比天冬酰胺残基少。
如果pH> 5.0,则通过非常不稳定的环状酰亚胺中间体形成而发生脱酰胺作用,该中间体会自发进行水解。在强酸性条件下(pH 1-2),酰胺侧链的直接水解比形成环酰亚胺更有利。肽键裂解在酰胺直接水解中更大程度地发生。在中性pH下,脱酰胺作用可导致结构异构化。
脱酰胺作用的速率也受蛋白质二级结构的影响。螺旋结构的增加会降低某些蛋白质的脱酰胺速率。考察了几种生长激素释放因子类似物中的脱酰胺速率与甲醇诱导的α-螺旋结构的关系。甲醇的添加增加了α-螺旋的水平,降低了脱酰胺的速率。在其天然结构中,RNAase可以抵抗脱酰胺作用,这可能是因为环中相对刚性的骨架被Cys-8和Cys-12之间的二硫键以及残基66-68处的β-转角稳定,这可能会阻止环状结构的形成。但是,如果将其还原和变性,则会重新折叠,生成天冬氨酸和异天冬氨酸形式,表明具有不同的酶促活性。用Iso-Asp-67替代Asp-67表明,异天冬氨酸形式的重折叠速度是完全酰胺化形式的一半。
在某些生物缓冲液存在下,储存温度会影响蛋白质的脱酰胺速度。因为胺缓冲剂(例如Tris和组氨酸)具有较高的温度系数,所以在与制备温度不同的温度下储存可能会改变制剂的pH值。脱酰胺和异构化反应是pH敏感的过程,因此配方pH的那些变化可能会改变脱酰胺的速率。温度的另一个间接影响是水的解离常数:水的氢氧根离子浓度可以随温度变化而变化,从而影响脱酰胺速率。
预防措施:溶液的pH值会严重影响脱酰胺作用。pH值为3-5的制剂可最大程度地减少肽脱酰胺作用。胰岛素的AsnA-21和AsnB-3根据溶液的pH值形成异天冬氨酸或天冬氨酸。胰岛素在Asn A-21的低pH溶液中迅速脱氨基。立体位阻也会影响脱酰胺反应的速度:天冬酰胺后的大量残基可能会抑制脱酰胺反应中琥珀酰亚胺中间体的形成。用更庞大的亮氨酸或脯氨酸残基代替甘氨酸残基会导致该比率降低30到50倍。在冻干的制剂中,脱酰胺率通常降低,这可能是由于可以在其中发生反应的游离水的可用性有限所致。
包含有机助溶剂的制剂可以降低其脱酰胺速率,因为添加有机溶剂会降低溶液的介电常数。减少溶剂的介电强度-通过加入cosolutes例如甘油,蔗糖和乙醇的蛋白质溶液的-导致异构化和脱酰胺化的显著较低速率。将介质的介电强度从80(水)降低到35(PVP /甘油/水配方),导致肽脱酰胺速率降低了约六倍。较低的脱酰胺速率归因于天冬酰胺脱酰胺途径中环化过程中形成的稳定性较差的离子中间体。在含有苯酚的中性溶液中制备的胰岛素显示出减少的脱酰胺作用,这可能是因为其对脱酰胺残基周围的三级结构(α-螺旋形成)具有稳定作用,从而降低了形成中间体酰亚胺的可能性。
聚集与沉淀
聚集蛋白是生物制药产品的重要关注点,因为它们可能与生物活性降低和免疫原性增加有关。大分子蛋白质复合物可以触发患者的免疫系统将蛋白质识别为“非自身”并引发抗原反应。大型高分子聚集体也会影响器官系统(例如眼睛)中的流体动力学。
聚集是蛋白质生产和储存过程中遇到的常见问题。蛋白质暴露于液-气,液-固乃至液-液界面通常会增强聚集形式的潜力。搅动的机械应力(摇动,搅拌,移液或通过试管泵吸)会导致蛋白质聚集。冻结和解冻也可以促进它。溶液条件(例如温度,蛋白质浓度,pH和离子强度)会影响所观察到的聚集体的速率和数量。蔗糖水解时,由于蛋白质糖基化,蔗糖中的制剂会随着时间的推移而增加聚集。某些配体(包括某些配体)的存在可能会增强聚集。与金属表面的相互作用会导致外延变性,从而触发聚集体形成。从环境中的杂质粒子,制造过程中,或容器封闭系统(例如,硅油)也能诱导聚合。甚至在复合药房中处理蛋白质产品,也可以诱导聚集,其聚集量比最初观察到的量高10倍。
聚集对产物效力的影响根据每种蛋白质相对于其功能域的生理化学特性和所测活性的性质而变化。摇动后,诸如脲酶和过氧化氢酶之类的酶可能会损失多达50%的效力,剪切应力后纤维蛋白原的凝结活性会降低,并且摇动和剪切产生的聚集会严重影响重组IL-2和重组干扰素的活性。聚集也影响蛋白质溶液的质量平衡,降低了目标蛋白质的浓度。在存储过程中,随着时间的推移,在制造过程中任何地方产生的微聚集的亚可见颗粒都可能随着时间的推移而发展成更大的颗粒。在药房操作后,贝伐单抗药物产品损失了50%的活性IgG,从而导致重新包装的溶液中微米级颗粒的显着生长。
聚集体可以是可溶或不可溶,可逆或不可逆,共价或非共价。可溶性聚集体通常是可逆的:例如,通过改变溶液条件(例如改变温度或渗透强度)或通过轻微的物理破坏(例如涡旋或过滤)。不溶性聚集体通常是不可逆的。在剧烈的物理干扰(例如,搅动或冷冻和解冻)下或在存储过程中,随着时间的流逝,它们可能长成最终可能沉淀的颗粒。当单体蛋白质发生化学交联时,例如通过二硫键,就会形成共价聚集体。尽管共价键对于稳定大多数多肽蛋白的天然三级结构是必需的,但是通过降解形成的那些可以在蛋白部分之间产生不希望的交联,从而导致不可逆的聚集。当蛋白质基于电荷或极性的结构区域结合并结合时,会形成非共价聚集体。由于此类关联较弱(相对于共价键),因此它们对溶液条件敏感,通常是可逆的。
涉及的机理和因素:由于在上游生产和下游加工中需要进行许多物理和化学操作,然后进行配制和填充操作,因此在该过程的几乎每个步骤(包括固定点,运输和运输)中都可以诱导蛋白质生物药物的聚集。长期储存,搅动(例如,摇动,搅拌和剪切)蛋白质溶液可以促进气液界面处的聚集,在该处,蛋白质分子可能会排列并展开,从而使它们的疏水区域暴露于基于电荷的缔合中。在许多蛋白质产品中都发现了激荡诱导的聚集,包括重组因子XIII,人类生长激素,血红蛋白和胰岛素。在制造过程中(以及在产品使用过程中),由搅动引起的泡沫最小化对于防止蛋白质活性显着损失或可见颗粒物质的产生至关重要。
蛋白质浓度还可以促进聚集,无论是否发生搅动事件。从两种PEG化蛋白和一种Fc融合蛋白获得的结果表明,在非搅动(静止)条件下蛋白质浓度与聚集之间存在直接相关性,但研究人员发现在摇动,涡旋和模拟运输条件下蛋白质浓度与聚集之间存在反相关性。
多剂量制剂中使用的抗菌防腐剂也可以诱导蛋白质聚集。例如,苯甲醇会促进rhGCSF的聚集,因为它有利于蛋白质的部分未折叠构象。抗菌防腐剂含量的增加可能会增加制剂的疏水性,并可能影响蛋白质的水溶性。
苯酚和米甲酚可以显着破坏蛋白质:苯酚促进形成可溶性和不溶性聚集体的,而米甲酚可以沉淀蛋白质。
冷冻和解冻-在蛋白质治疗剂的生产和使用过程中可能多次发生-会极大地影响蛋白质的聚集。在容器的外围(传热最大的地方)产生的水冰晶体会产生“盐析”效应,从而使蛋白质和赋形剂越来越集中在容器的较慢冷冻中心。高盐和/或高蛋白浓度可导致冷冻过程中沉淀和聚集,解冻时不能完全逆转。可以通过刺激甲状腺的激素看到效果:当在−80°C,4°C或24°C下存储长达90天时,它保持稳定,但是在冷冻至−20°C时它损失> 40%在那个时期的效力,归因于亚基的解离。多次冷冻和解冻循环会加剧这种影响,并导致对亚可见颗粒和可见颗粒的产生和生长的累积影响。pH值的变化可能来自冷冻过程中缓冲液成分的结晶。在一项研究中,磷酸钾缓冲液在冷冻时的pH变化比磷酸钠缓冲液小得多。
概略目前限制的颗粒≥10微米的数量和≥25微米大小可存在于可注射的药物制剂。但是,什么级别的亚可见粒子。同样,对于蛋白质药物中的可见颗粒,也没有标准的法规。一些生物技术产品具有药物溶液的视觉外观规格,其中包括诸如“基本上不含可见颗粒”或“可能存在一些半透明颗粒”之类的注释)。
预防措施:通过优化溶液的pH值和离子强度,通常可以稳定蛋白质溶液的聚集和沉淀。添加糖,氨基酸和/或多元醇;并使用表面活性剂。最佳pH和渗透条件的综合评估是防止蛋白质聚集或沉淀的制剂开发的关键要素)。用表面活性剂,多元醇或糖类可以防止由于变性引起的不可逆的聚集。
在许多情况下,添加非离子型去污剂(表面活性剂)可提高稳定性并防止聚集。蛋白质-表面活性剂之间的相互作用是疏水的,因此这些化合物通过降低溶液的表面张力并结合其表面上的疏水位点来稳定蛋白质,从而降低了蛋白质-蛋白质相互作用可能导致聚集体形成的可能性。非离子型洗涤剂Tween 20和Tween 80可以防止表面活性剂浓度低于临界胶束浓度(CMC)的可溶性蛋白质聚集体的形成。添加到IgG溶液中的聚山梨酯(Tween)80可以稳定小聚集体,并防止它们长成更大的颗粒。螯合剂也可用于防止金属诱导蛋白质聚集。
碎片化
具有两个或多个亚基的多聚体蛋白可以解离为单体,而单体(或单个肽链蛋白)则可以降解为肽片段。非酶片段化通常是通过氨基酸之间的肽键水解而进行的,从而释放出分子量低于完整亲本蛋白的多肽。天冬氨酸-甘氨酸的肽键和Asp-Pro的是最容易受到水解蛋白切割。抗体水解通常发生在铰链区,这是抗体最灵活的结构域。
但是,将pH从9降低到5可以改变重组单克隆抗体的肽水解位点,显示该区域之外的裂解增加。
寡糖的存在和位置也会影响低pH值下肽水解的速率。根据位置,尽管CH 2结构域中的片段减少,但铰链区的裂解并未受到影响。酸性和碱性水解作用对肽键的水解裂解不一定具有相同的作用。重组人巨噬细胞集落刺激因子在酸性和碱性pH值的溶液中产生不同的肽片段。残留或污染性蛋白酶的蛋白水解活性可能会导致酶蛋白断裂,或者在某些情况下会导致酶蛋白的自身蛋白水解。
预防措施:对于每种蛋白质类型,适当缓冲制剂以使其溶液的pH值保持在合适的范围内,是最大限度地减少水解片段化的关键。例如,降钙素在碱性pH下进行水解,但是即使在室温下,在pH 7下也未观察到这种降解。缓冲液的组成也可能影响水解。在相同的pH和离子强度下,在磷酸盐缓冲液中观察到重组人巨噬细胞集落刺激因子片段化,而在组氨酸缓冲液中则未观察到。从生产过程的内在来源(例如宿主细胞蛋白)或外源性污染源(例如不定微生物)中最小化蛋白酶在蛋白质纯化中的潜在存在也很重要。
蛋白质分子的天然结构是平衡效应的结果,例如共价键,疏水相互作用,静电相互作用,氢键和范德华力。蛋白质稳定性受无数内在和外在因素控制,但主要因素是一级序列,3D结构,亚基缔合和翻译后修饰。外在影响因素包括pH,摩尔渗透压浓度,蛋白质浓度,制剂赋形剂,以及产品在温度,光照和/或搅拌下受到的物理压力。容器密闭系统中的可浸出物和环境污染(例如,金属和蛋白酶)也加剧了产品降解。综上所述,所有这些特征使蛋白质降解成为非常复杂的物理化学现象,因此优化配方是生物技术产品开发的关键方面。
文章来源:
1.) Lins, L, and R. Brasseur. 1995. The Hydrophobic Effect in Protein Folding. FASEB J. 9:535-540.
2.) Wang, W. 1999. Instability, Stabilization, and Formulation of Liquid Protein Pharmaceuticals. Int. J. Pharmaceut. 185:129-188.
3.) Chang, LL, and MJ. Pikal. 2009. Mechanisms of Protein Stabilization in the Solid State. J. Pharm. Sci. 98:2886-2908.
4.) Jacob, S. 2006. Stablity of Proteins in Aqueous Solution and Solid State. Indian. J. Pharmaceut. Sci:154-163.
5.) Manning, MC, K Patel, and RT. Borchardt. 1989. Stability of Protein Pharmaceuticals. Pharmaceut. Res. 6:903-918.
6.) Li, S, C Schoneich, and RT. Borchardt. 1995. Chemical Instability of Protein Pharmaceuticals: Mechanisms of Oxidation and Strategies for Stabilization. Biotechnol. Bioeng. 48:490-500.
7.) Frelinger, AL, and AE. Zull. 1984. Oxidized Forms of Parathyroid Hormone with Biological Activity: Separation and Characterization of Hormone Forms Oxidized at Methionine 8 and Methionine 18. J. Biol. Chem. 259:5507-5513.
8.) Nabuchi, Y. 1995. Oxidation of Recombinant Human Parathyroid Hormone: Effect of Oxidized Position on the Biological Activity. Pharmaceut. Res. 12:2049-2052.
9.) Hsu, Y-R. 1996. In Vitro Methionine Oxidation of Escherichia coli–Derived Human Stem Cell Factor: Effects on the Molecular Structure, Biological Activity and Dimerization. Prot. Sci. 5:1165-1173.
10.) Gitlin, G. 1996. Isolation and Characterization of a Monomethioninesulfoxide Variant of Interferon Alpha-2b. Pharmaceut. Res. 13:762-769.
11.) Torchinskii, M. Metzler, DE 1981.Sulfur in Proteins, Pergamon, New York.
12.) Engleka, KA, and T. Maciag. 1992. Inactivation of Human Fibroblast Growth Factor-1 (FGF-1) Activity By Interaction with Copper Ions Involves FGF-1 Dimer Formation Induced By Copper-Catalyzed Oxidation. J. Biol. Chem. 267:11307-11315.
13.) Astafieva,, GA Eberlein, and YJ. Wang. 1996. Absolute On-Line Molecular Mass Analysis of Basic Fibroblast Growth Factor and Its Multimers By Reversed-Phase Liquid Chromatography with Multi-Angle Laser Light Scattering Detection. J. Chromatogr. A 740:215-229.
14.) Uchida, K, and S. Kawakishi. 1994. Identification of Oxidized Histidine Generated at the Active Site of Cu,Zn Superoxide Dismutase Exposed to H2O2: Selective Generation of 2-Oxo-Histidine at the Histidine 118. J. Biol. Chem. 269:2405-2410.
15.) Schöneich, C. 2000. Mechanisms of Metal-Catalyzed Oxidation of Histidine to 2-Oxo-Histidine in Peptides and Proteins. J. Pharmaceut. Biomed. Anal. 21:1093-1097.
16.) Cromwell, MEM, E Hilario, and F. Jacobson. 2006. Protein Aggregation and Bioprocessing. AAPS J. article 66 8.
17.) Berlett, BS, and ER. Stadtman. 1997. Protein Oxidation in Aging, Disease, and Oxidative Stress. J. Biolog. Chem. 272:20313-20316.
18.) Zhang, J, and DS. Kalonia. 2007. The Effect of Neighboring Amino Acid Residues and Solution Environment on the Oxidative Stability of Tyrosine in Small Peptides. AAPS PharmSciTech article 102 8.
19.) Kerwin, BA, and RL. Remmele. 2007. Protect from Light: Photodegradation and Protein Biologics. J. Pharmaceut. Sci. 96:1468-1479.
20) Rathore, N, and RS. Rajan. 2008. Current Perspectives on Stability of Protein Drug Products During Formulation, Fill and Finish Operations. Biotechnol. Prog. 24:504-514.
21.) Teh, L-C. 1987. Methionine Oxidation in Human Growth Hormone and Human Chorionic Somatomammotropin: Effects on Receptor Binding and Biological Activities. J. Biolog. Chem. 262:6472-6477.
22.) Chang, SH. 1997. Metal-Catalyzed Photooxidation of Histidine in Human Growth Hormone. Anal. Biochem. 244:221-27.
23.) Fransson, J, and A. Hagman. 1996. Oxidation of Human Insulin-Like Growth Factor I in Formulation Studies, II: Effects of Oxygen, Visible Light, and Phosphate on Methionine Oxidation in Aqueous Solution and Evaluation of Possible Mechanisms. Pharmaceut. Res. 13:1476.
24.) Knepp, VM. 1996. Identification of Antioxidants for Prevention of Peroxide-Mediated Oxidation of Recombinant Human Ciliary Neurotrophic Factor and Recombinant Human Nerve Growth Factor. PDA J. Pharmaceut. Sci. Technol. 50:163-171.
25.) Landi, S, and HR. Held. 1986. Effect of Oxidation on the Stability of Tuberculin Purified Protein Derivative (PPD). Dev. Biol. Stand 58:545-552.
26.) Herman, AC, TC Boone, and HS. Lu Pearlman, R and YJ. 1996.Characterization, Formulation, and Stability of Neupogen (Filgrastim), a Recombinant Human Granulocyte-Colony Stimulating FactorFormulation, Characterization, and Staibility of Protein Drugs: Case Histories, Plenum Press, New York.
27.) Gautriaud, E. 2010. Effect of Sterilization on the Mechanical Properties of Silicone Rubbers. BioProcess Int. 8:S42-S49.
28.) Jenke, D. 2008. Suitability-for-Use Considerations for Prefilled Syringes. Pharmaceut. Technol..
29.) Mark, DF. 1984. Site-Specific Mutagenesis of the Human Fibroblast Interferon Gene. Proc. Nat. Acad. Sci. USA 81:5662-5666.
30.) Koide, H. 1988. Biosynthesis of a Protein Containing a Nonprotein Amino Acid By Escherichia coli: l-2-Aminohexanoic Acid at Position 21 in Human Epidermal Growth Factor. Proc. Nat. Acad. Sci. USA 85:6237-6241.
31.) Levine, RL. 1996. Methionine Residues As Endogenous Antioxidants in Proteins. Proc. Nat. Acad. Sci. USA 93:15036-15040.
32.) Li, S. 2000. Inhibitory Effect of Sugars and Polyols on the Metal-Catalyzed Oxidation fo Human Relaxin. J. Pharmaceut. Sci. 85:868-872.
33.) Lewis, UJ. 1981. Altered Proteolytic Cleavage of Human Growth Hormone as a Result of Deamidation. J. Biolog. Chem. 256:11645-11650.
34.) Gietz, U. 1998. Chemical Degradation Kinetics of Recombinant Hirudin (HV1) in Aqueous Solution: Effect of pH. Pharmaceut. Res. 15:1456.
35.) Furuya, K, D Johnson-Jackson, and DT. Ruscio Deamidated Interferon-Beta.
36.) Friedman, AR. 1991. Degradation of Growth Hormone Releasing Factor Analogs in Neutral Aqueous Solution Is Related to Deamidation of Asparagine Residues: Replacement of Asparagine Residues By Serine Stabilizes. Int. J. Pep. Prot. Res. 37:14-20.
37.) Charache, S. 1977. Postsynthetic Deamidation of Hemoglobin Providence (ß 82 Lys —> Asn, Asp) and Its Effect on Oxygen Transport. J. Clin. Investigation 59:652-658.
38.) Moss, CX. 2005. Asparagine Deamidation Perturbs Antigen Presentation on Class II Major Histocompatibility Complex Molecules. J. Biolog. Chem. 280:18498-18503.
39.) Araki, F. 1989. Stability of Recombinant Human Epidermal Growth Factor in Various Solutions. Chem. Pharmaceut. Bull. (Tokyo) 37:404-406.
40.) Yüksel, KU, and RW. Gracy. 1986. In Vitro Deamidation of Human Triosephosphate Isomerase. Arch. Biochem. Bioph
ys. 248:452-459.
41.) Shahrokh, Z. 1994. Major Degradation Products of Basic Fibroblast Growth Factor: Detection of Succinimide and Iso-Aspartate in Place of Aspartate. Pharm Res. 11:936-944.
42.) 1987. Deamidation, Isomerization, and Racemization at Asparaginyl and Aspartyl Residues in Peptides: Succinimide-Linked Reactions That Contribute to Protein Degradation. J. Biolog. Chem. 262:785-794.
43.) Capasso, S. 1996. Kinetics and Mechanism of the Cleavage of the Peptide Bond Next to Asparagine. Peptides 17:1075-1077.
44.) Wakankar, AA, and RT. Borchardt. 2006. Formulation Considerations for Proteins Susceptible to Asparagine Deamidation and Aspartate Isomerization. J. Pharmaceut. Sci. 95:2321-2336.
45.) Tyler-Cross, R, and V. Schirch. 1991. Effects of Amino Acids Sequence, Buffers, and Ionic Strength on the Rate and Mechanism of Deamidation of Asparagine Residues in Small Peptides. J. Biolog. Chem. 266:22549-22556.
46.) Robinson, NE. 2002. Protein Deamidation. Proc. Nat. Acad. Sci. 99:5283-5288.
47.) Li, X, C Lin, and PB. O’Connor. 2010. Glutamine Deamidation: Differentiation of Glutamic Acid and Gamma-Glutamic Acid in Peptides By Electron Capture Dissociation. Anal. Chem. 82:3606-3615.
48.) Patel, K, and RT. Borchardt. 1990. Chemical Pathways of Peptide Degradation, II: Kinetics of Deamidation of an Asparaginyl Residue in a Model Hexapeptide. Pharmaceut. Res. 7:703-711.
49.) Kosky, AA. 1999. The Effects of Alpha-Helix on the Stability of Asn Residues: Deamidation Rates in Peptides of Varying Helicity. Protein Sci. 8:2519-2523.
50.) Stevenson, CL. 1993. Effect of Secondary Structure on the Rate of Deamidation of Several Growth Hormone Releasing Factor Analogs. Int. J. Pep. Prot. Res. 42:497-503.
51.) Di Donato, A. 1993. Selective Deamidation of Ribonuclease A: Isolation and Characterization of the Resulting Isoaspartyl and Aspartyl Derivatives. J. Biolog. Chem. 268:4745-4751.
52.) Darrington, RT, and BD. Anderson. 1995. Evidence for a Common Intermediate in Insulin Deamidation and Covalent Dimer Formation: Effects of pH and Aniline Trapping in Dilute Acidic Solutions. J. Pharm. Sci. 84:275-282.
53.) Brange, J. 1992. Chemical Stability of Insulin, 1: Hydrolytic Degradation During Storage of Pharmaceutical Preparations. Pharmaceut. Res. 9:715-726.
54.) Li, R. 2000. Effects of Solution Polarity and Viscosity on Peptide Deamidation. J. Pep. Res. 56:326-334.
55.) Rosenberg, AS. 2006. Effects of Protein Aggregates: An Immunologic Perspective. AAPS J. 8:E501-E507.
56.) Kahook, MY. 2010. High-Molecular-Weight Aggregates in Repackaged Bevacizumab. Retina 30:887-892.
57.) Philo, JS, and T. Arakawa. 2009. Mechanisms of Protein Aggregation. Curr. Pharmaceut. Biotechnol. 10:348-351.
58.) Banks, DD. 2009. The Effect of Sucrose Hydrolysis on the Stability of Protein Therapeutics During Accelerated Formulation Studies. J. Pharmaceut. Sci. 98:4501-4510.
59.) Jones, LS, A Kaufmann, and CR. Middaugh. 2005. Silicone Oil Induced Aggregation of Proteins. J. Pharmaceut. Sci. 94:918-927.
60.) Thirumangalathu, R. 2009. Silicone Oil- and Agitation-Induced Aggregation of a Monoclonal Antibody in Aqueous Solution. J. Pharmaceut. Sci. 98:3167-3181.
61.) Carpenter, JF. 2009. Overlooking Subvisible Particles in Therapeutic Protein Products: Gaps That May Compromise Product Quality. J. Pharmaceut. Sci. 98:1201-1205.
62.) Akers, MJ, V Vasudevan, and M. Stickelmeyer Nail, SL and MJ. 2002.Formulation Development of Protein Dosage Forms Development and Manufacture of Protein Pharmaceuticals. Pharmaceutical Biotechnology, Springer, London.
63.) Treuheit, MJ, AA Kosky, and DN. Brems. 2002. Inverse Relationship of Protein Concentration and Aggregation. Pharmaceut. Res. 19:511-516.
64.) Raso, SW. 2005. Aggregation of Granulocyte-Colony Stimulating Factor in Vitro Involves a Conformationally Altered Monomeric State. Prot. Sci. 14:2246-2257.
65.) Thirumangalathu, R. 2006. Effects of pH, Temperature, and Sucrose on Benzyl Alcohol-Induced Aggregation of Recombinant Human Granulocy te Colony Stimulating Factor. J. Pharmaceut. Sci. 95:1480-1497.
66.) Kashiwai, T. 1991. The Stability of Immunological and Biological Activity of Human Thyrotropin in Buffer: Its Temperature-Dependent Dissociation into Subunits During Freezing. Scand. J. Clin. Lab. Invest. 51:417-423.
67.) USP 2010. Particulate Matter in Injections, US Pharmacopeial Convention, Inc., Rockville.
68.) Q4B 2008. Annex: Evaluation and Recommendation of Pharmacopoeial Texts for Use in the ICH Regions on Residue on Ignition/Sulphated Ash. Fed. Reg. www.ich.org/LOB/media/MEDIA3093.pdf 73:9576-9577.
69.) Rader, RA. 2007.Biopharmaceutical Products in the U.S. and European Markets6th edition, BioPlan Associates, Inc., Rockville.
70.) Ruiz, L, K Aroche, and N. Reyes. 2006. Aggregation of Recombinant Human Interferon Alpha 2b in Solution: Technical Note. AAPS PharmSciTech article 99 7.
71.) Ahmad, SS, and PA. Dalby. 2010. Thermodynamic Parameters for Salt-Induced Reversible Protein Precipitation from Automated Microscale Experiments. Biotechnol. Bioeng. (epub ahead of print).
72.) Green, FA.J. 1971. Interactions of a Nonionic Detergent, II: With Soluble Proteins. Colloid. Interface Sci. 35:481-485.
73.) Chou, DK. 2005. Effects of Tween 20 and Tween 80 on the Stability of Albutropin During Agitation. J. Pharmaceut. Sci. 94:1368-1381.
74.) Mahler, HC. 2005. Induction and analysis of aggregates in a liquid IgG1-antibody formulation. Euro. J. Pharma. Biopharma. 59:407-417.
75.) Smith, BJ. 1988.Chapter 6: Chemical Cleavage of Proteins. New Protein TechniquesMethods in Molecular Biology, Springer, Heidelberg:71-88.
76.) Schrier, JA. 1993. Degradation Pathways for Recombinant Human Macrophage Colony-Stimulating Factor in Aqueous Solution. Pharmaceut. Res. 10:933-944.
77.) Bandyopadhyay, S Formulations of PEG-Interferon Alpha Conjugates.
78.) Gaza-Bulseco, G, and H. Liu. 2008. Fragmentation of a Recombinant Monoclonal Antibody at Various pH. Pharmaceut. Res. 25:1881-1890.
79.) Rader, RA. 2008.Biopharmaceutical Expression Systems and Genetic Engineering Technologies: Current and Future Manufacturing Platforms, BioPlan Associates, Inc., Rockville.
80.) Cholewinski, M, B Lückel, and H. Horn. 1996. Degradation Pathways, Analytical Characterization, and Formulation Strategies of a Peptide and a Protein: Calcitonin and Human Growth Hormone in Comparison. Pharm. Acta Helv. 71:405-419.

来源:药时空


