您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-10-28 14:06
近期,国内学者关于电子血管的研究发表在Cell的子刊Matter杂志。近些年,柔性电子领域的快速发展,使传感器和人体组织(如皮肤,血管)成为可能,柔性电子设备可以用于疾病的诊断,生理指标的监测和进行功能性治疗。人工电子血管是如何制备出来的,可以实现哪些功能?让我们一起走进这篇文章,一探究竟。
整合生物电子学和生物组织学的优势将会发挥出强大的功能来克服目前遇到的生物医学难题。在本文中,我们介绍一种电子血管,该血管将导电的液态金属聚合物环与构成血管的三层细胞整合在一起去模拟天然的血管。该电子血管表现出良好的生物相容性和机械性能,可进行电刺激和电穿孔,并在兔模型体内实验中表现出极佳的血流的通畅性。
文章研究亮点
利用生物可降解的聚合物和金属聚合物导体合成电子血管。
体外实验显示电刺激可促进脐静脉血管内皮细胞的增殖和迁移。
电穿孔技术可以将靶基因传递到血管的不同细胞层中。
电子血管系统有较好的生物相容性,并在兔模型中得到很好的验证
摘要
生物电子学的进展具有巨大的潜能去解决心血管系统中尚未克服的生物医学难题。利用聚合物(L-lactide-co-e-caprolactone)来封装液态金属,可以制备出具备良好弹性且可降解的电路环,我们开发了一种电子血管,该血管可以将具备生物弹性的电路环与三层血管细胞集成在一起,来仿生天然血管,该电子血管可通过电刺激改善促进血管内皮化过程,通过电穿孔技术将靶基因可控的递送到血管的特定部位发挥生物学功能。电子血管在血管系统中具有出色的生物相容性,在兔子模型植入后在3月内仍可显示出良好的通畅性。在不久的将来,通过血管组织-机器接口,电子血管将会是心血管系统中进行诊断和治疗的理想平台,实现个体化医疗。
进步与潜力
现有的小直径(<6 mm)组织工程血管(TEBV)植入后主要依赖宿主的重建过程发挥功能,植入后并不能针对各种病理环境提供进一步的诊断或治疗作用。在本研究中,我们制备出了一种具有良好生物相容性,柔韧性,机械强度且可降解的电子血管,该血管可以实现原位电刺激(促进内皮化过程)和电穿孔(在血管细胞的特定层中传递基因),在兔模型中表现出良好的通畅性。它具有传统可生物降解TEBV的电功能,并为我们提供了一个新的平台来解决目前小直径血管遇到的一些问题。当与人工智能等新兴技术结合使用时,它可以发挥血管组织-机器界面的桥梁作用,对健康数据收集/存储和早期干预,来促进未来的个体化医疗。
背景介绍
心血管疾病仍然是全世界死亡的第一大原因,在冠状动脉旁路移植术治疗心血管疾病中,目前还没有小直径(<6 mm)组织工程血管(TEBV)能够满足临床需求。无数科研工作者一直致力于制备符合临床需求的组织工程血管,近年来已经利用如脱细胞基质,自组装细胞片以及生物活性和仿生材料等多种方法制备组织工程血管。然而令人遗憾的是目前大多数这些方法制备的组织工程血管仅可作为支架发挥机械支持的作用,并且主要依赖于宿主组织细胞进行重塑,在帮助新血管再生方面存在明显的局限性。迄今为止,它们均未取得令人满意的临床结果。尤其是血流与组织工程血管之间复杂的相互作用通常会导致炎症发生,进而产生血栓,内膜增生或支架附近平滑肌细胞积聚等问题。为了解决这些问题,新一代组织工程血管不仅充当血管支架以提供机械支持,促进宿主细胞募集,而且还应具有主动响应并与天然重塑过程相结合的能力,以便在植入后提供适应性治疗。
将活体组织与柔性电子设备相结合,可以使常规TEBV具有更多的功能和能力,以克服现有的生物医学瓶颈,例如通过原位感测血流量和温度以及通过治疗性药物或基因递送进行治疗。在之前的研究工作中,我们已经开发出许多方法来在血管不同分层中封装不同类型细胞以期模仿天然的血管结构,主要有如应力诱导的自卷膜和逐层技术。最近,我们开发了可印刷的金属聚合物导体(MPC),它具有出色的相容性和高拉伸性。在本研究中,我们开发了一种电子血管,该血管通过将液态金属与聚合物(L-lactide-co-e-caprolactone)(PLC)结合到金属聚合物导体(MPC)中,将柔性电极集成到可生物降解的支架中。为证实这一概念的可行性,我们使用电子血管进行体外电刺激和电穿孔:通过电刺激,电子血管可以有效地促进伤口愈合模型中的细胞增殖和迁移。它还可以通过电穿孔将绿色荧光蛋白(GFP)DNA质粒原位递送到三种血管细胞中。通过使用兔颈动脉置换模型的3个月体内研究,我们评估了电子血管在血管系统中的功效和生物安全性,并通过超声成像和动脉造影证实了其通畅性。总之,我们的研究结果为将弹性,可降解生物电子学整合到血管系统中铺平了道路,该系统可以用作如基因疗法,电刺激和电子控制的药物释放等治疗的平台。
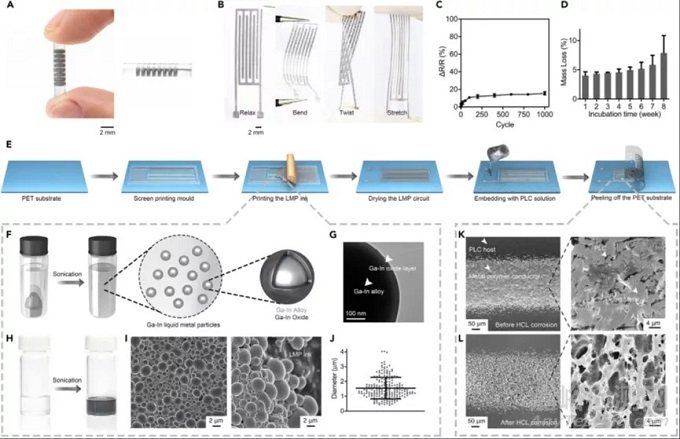
主要结果解读
1、电子血管的制备流程:
(1)液态金属颗粒(LMP)制备:利用Ga-In合金制备金属颗粒核的部分,外部包裹Ga-In氧化物作为壳,设计出直径约为2毫米大小具备核-壳结构的液态金属颗粒(LMP)。
(2)液态金属导电油墨制备:利用超声处理镓铟合金(EGAIn)和挥发性溶剂(1-癸醇)的混合物来制备液态金属导电油墨。
(3)导电油墨喷涂制模:我们在聚对苯二甲酸乙二醇酯(PET)膜的网格模板上喷涂一层导电油墨,通过对电极的调整达到最优的电穿孔和电刺激效果,通过调整电极设计,我们既可以将电极分布在特定区域中,可针对单个血管层(内膜/中膜/外膜),也可以对整个三层电极进行全电极分布。
(4)剥离MPC-PLC膜:基于LMP的电路嵌入到PLC解决方案中(在CH2Cl2中为5 wt%),在化学罩中蒸发掉多余的挥发性溶剂(1-癸醇)后将MPC-PLC膜从PET基材上剥离下来(MPC-PLC膜的厚度约为50毫米,可通过更改PLC体积进行调整厚度)。
(5)卷曲MPC-PLC膜制备电子血管:我们通过在聚四氟乙烯卷轴的帮助下卷起MPC-PLC膜来制备电子血管,结果显示MPC电路环可以很好地分布在三维(3D)多层管状结构中。制备的电子血管的内径约为2毫米,最小直径约为0.5毫米,制备电子血管的MPC-PLC膜富有弹性且可降解,其中的MPC电路环显示出良好的导电功能,其传导率可达8 × 103 S cm,电路的DR / R在经过大约1000次弯曲和摩擦后任然可保持恒定。设计初预计PLC在1-2年内降解,在体外实验显示:MPC-PLC膜置于PBS(37°C)中孵育8周,其质量损失约为10%。
(6)确定导电电路:LMP(液态金属颗粒)在剥离过程中可能会破裂,并释放Ga-In合金以使电路导电。为确定确定了制备的电子血管的导电电路的结构,我们通过添加过量的盐酸来腐蚀Ga-In合金,结果显示LMP(液态金属颗粒)均匀分布在蜂窝PLC主机中,并形成相干的导电路径。
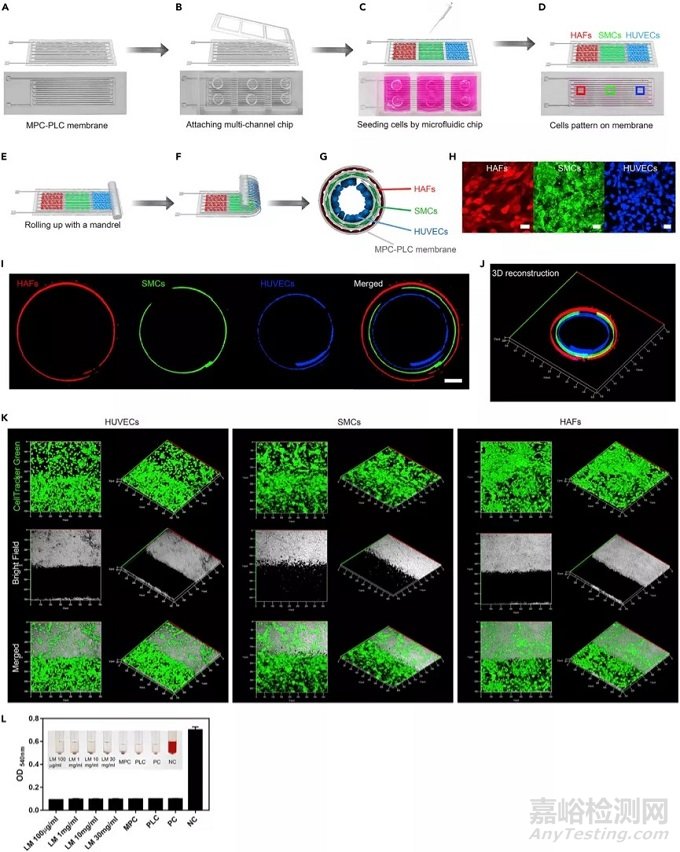
2、体外实验检测电子血管效果:
为了评估电子血管的生物相容性,我们使用微流体技术以模仿天然血管的方式实现了三种细胞在血管中的精确三维结构。通过使用多通道微流控芯片,我们在MPC-PLC膜上依次递送人脐静脉内皮细胞(HUVEC,蓝色),人主动脉平滑肌细胞(SMC,绿色)和人主动脉成纤维细胞(HAF,红色)。我们根据MPC-PLC膜的厚度和管子的直径设计出每个通道的宽度,以匹配管子各层的周长。为了区分不同的细胞类型,我们将HUVEC,SMC和HAF用不同的荧光染料(HUVEC,CellTracker紫色;SMC,CellTracker绿色;HAF,CellTracker深红色)染色,然后将其植入微流控芯片。在培养基(DMEM高糖,10%胎牛血清FBS,37 ℃,5%CO2)中孵育1天后,将细胞附着到MPC-PLC膜上。我们将微流控芯片从充满细胞的MPC-PLC膜上剥离,并用PTFE轴卷起,形成3D多层管状结构,其中HUVEC,SMC和HAF均匀分布在内层,中间层, 外层,很好地模仿了天然血管的结构。为了更好地了解分布在电子血管不同层中的血管细胞,我们用活体细胞示踪剂CellTracker DiO,CellTracker DiI,CellTracker DiD为了更好地了解分布在电子血管不同层中的血管细胞,我们用CellTracker DiO,CellTracker DiI,CellTracker DiD和CellTracker blue对HUVEC,SMC,HAF和MPC-PLC层进行了染色,以显示不同层的相对分布。我们使用了生物医学纤维蛋白胶来促进不同层的结合,我们孵育培养了充满细胞的电子血管14天,并用钙黄绿素对电子血管细胞进行了染色。结果回示:MPC-PLC膜上均匀分布的绿色荧光,提升培养14天后电子血管内细胞仍保持较高的活力。我们测量了离子通过MPC-PLC膜的传输效率来评估和量化电子血管的渗透性,结果显示:Ca2+,Fe3+和Mg2+可很好的渗透到电子血管中。我们还进行了溶血试验,结果表明电子血管具有很好的血液生物相容性。总之,体外实验表明电子血管表现出优异的生物相容性,我们将设计进一步实验对嵌入式MPC电路进行了进一步的功能测试,即电刺激和电穿孔。
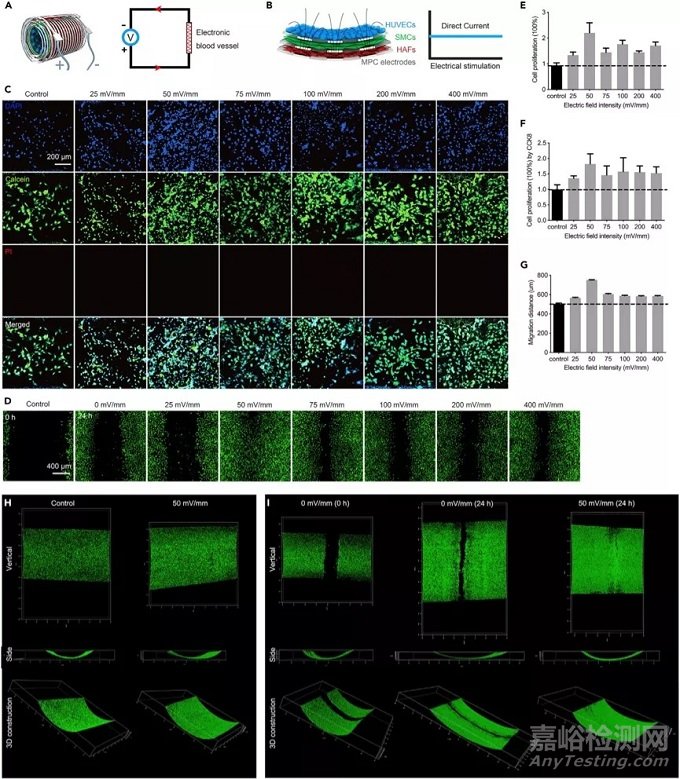
3、体外电刺激促进HUVEC增殖和迁移:
为了证明电子血管的功能,我们进行了体外电刺激以改善HUVEC的增殖和迁移。直流(DC)电场已被证明可以有效提高体外和体内的血管生成。我们通过使用多室聚二甲基硅氧烷(PDMS)芯片在MPC-PLC膜上对HUVEC进行了图案化。每个腔室中的初始细胞数相同即3×104个。孵育12小时后,我们施加了不同的直流电压以产生不同的电场强度,分别为:25、50、75、100、200、400 mVmm-1 。经过2天的孵育和电刺激后,我们在每个样品上随机选择了六个不同的区域,并通过激光扫描共聚焦显微镜对其进行了分析。我们用Hoechst 33342染色细胞核(蓝色),并分别用钙黄绿素AM(绿色)和碘化丙锭(PI)(红色)对活细胞和死细胞染色。绿色细胞占据了整个区域,表明电刺激并未损害HUVEC的增殖。我们使用ImageJ系统数细胞核。50 mVmm-1以下的细胞数最高,约为对照的2.4倍。随后的CCK-8检测增值实验得出相同的结果。综上,我们推测直流电场已经选择性地调节了某些生长因子来影响血管生成。我们探索了在不同直流电场强度下HUVEC的迁移。我们使用10ul吸头在PDMS上划了一个划痕。施加50 mVmm-1 的电场后,HUVEC迁移了750 mm,伤口在24 h后完全愈合, 因此,体外直流电刺激有效地促进了HVEC的增殖和迁移。
我们进一步评估了电刺激在3D血管中内皮化的有效性。在MPC-PLC膜上对HUVEC进行了构图,并使用10 uL吸头在充满细胞的膜上进行了刮擦。我们将2D充满细胞的膜转变为3D充满细胞的结构,并将其连接到电化学工作站以测试增殖和迁移。在多个样品上施加了50 mVmm-1 的电场,并观察了在不同时间点的增殖和迁移。用钙黄绿素AM(绿色)和PI(红色)对活细胞和死细胞进行了染色。同时对细胞进行计数,细胞密度高于对照组。24小时后,HUVEC形成了完整的内皮层。为了更好地评估电刺激下MPC电路的生物相容性,我们将电刺激时间延长至10天,活/死染色表明电子血管有良好的生物相容性。
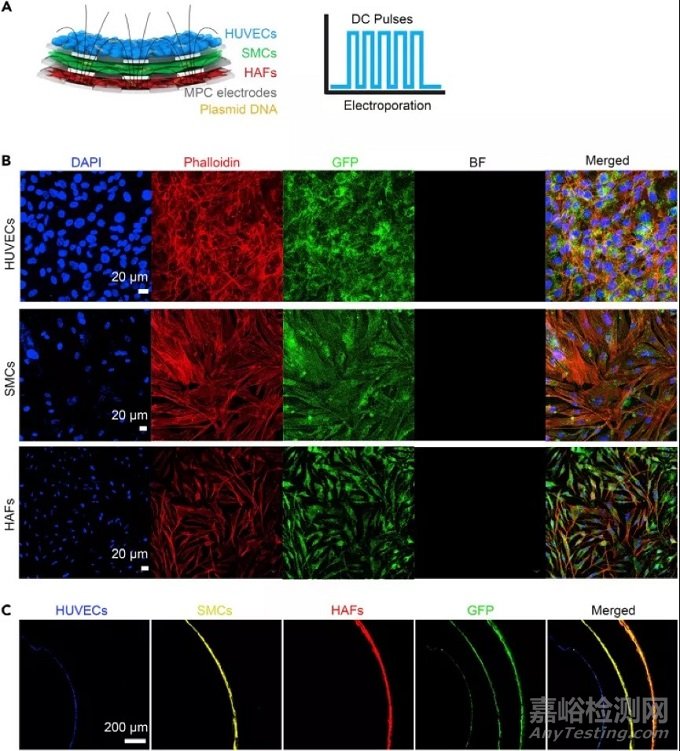
4、体外电穿孔实验:
为了进一步证明电子血管的功能,我们设计了电穿孔的电路模式,能够靶向不同层血管细胞中的病灶部位。我们使用可针靶向血管三层细胞的电路环进行电穿孔实验。我们将细胞接种到MPC-PLC膜上,并将其转化为3D管状结构用于电穿孔。在电穿孔之前,我们将3D细胞负载的电子血管浸入GFP质粒DNA溶液中10分钟。GFP质粒DNA也可以冻干到MPC-PLC膜上,然后播种细胞并转化为3D结构进行电穿孔。我们将载有3D细胞的电子血管连接到电穿孔器上以产生DC脉冲,并实现了GFP和DNA质粒在三种血管细胞中的递送。为了优化电子血管的性能,我们发现了决定电穿孔效力的两个主要参数,包括电压和脉冲持续时间。我们用不同的电压和脉冲持续时间进行了电穿孔实验。结果回示:如果电压太低,将导致转染功效低下,甚至不进行转染。如果电压太高或脉冲持续时间太长,也将导致功效低下且发生细胞死亡。最终摸索出最佳电穿孔条件为:电压60 V,脉冲持续时间为100 ms,五个脉冲的脉冲间隔为1 s,可将GFP质粒DNA递送到三种血管细胞中,并且实现了GFP DNA的表达,结果显示GFP在三层血管细胞之间成功表达,并且它们在电子血管中表现出均匀的3D分布,超过95%的细胞表达绿色荧光。
为了评估电子血管在体内进行电穿孔的潜力,我们将MPC-PLC膜上的GFP质粒DNA冻干,以测试其有效性。通过将载有质粒的MPC-PLC膜附着到离体的兔血管组织上进行电穿孔,该膜的电压为60 V,脉冲持续时间为100 ms,脉冲间隔为1 s,持续五个脉冲。培养2天后,分离出的兔血管组织。结果显示出良好的转染效果。
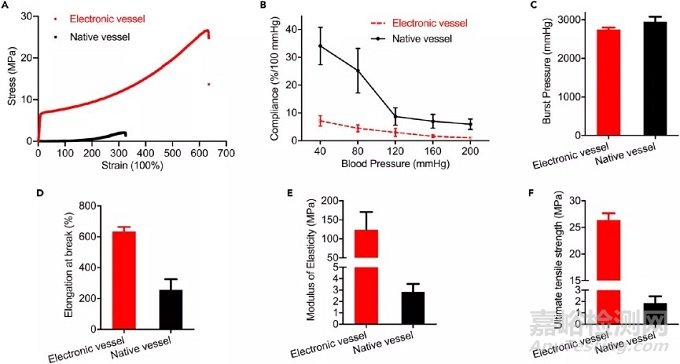
5、电子血管的机械性能测试:
为了确定电子血管是否适合体内植入,我们在植入前测量了电子血管的机械性能,包括应力-应变曲线,顺应性和破裂压力。结果显示:电子血管的弹性模量约为130MPa,电子血管的极限抗拉强度约为27MPa,均比天然颈动脉的值高。电子血管的初始顺应性在100-80 mm Hg范围内为每100 mm Hg约5%,显著低于天然颈动脉。电子血管的破裂压力约为2,800 mm Hg;与天然颈动脉的值相同。电子血管的断裂伸长率约为650%,为天然颈动脉值的两倍。综上表面电子血管具备良好的机械力学性能,具备植入体内的条件。
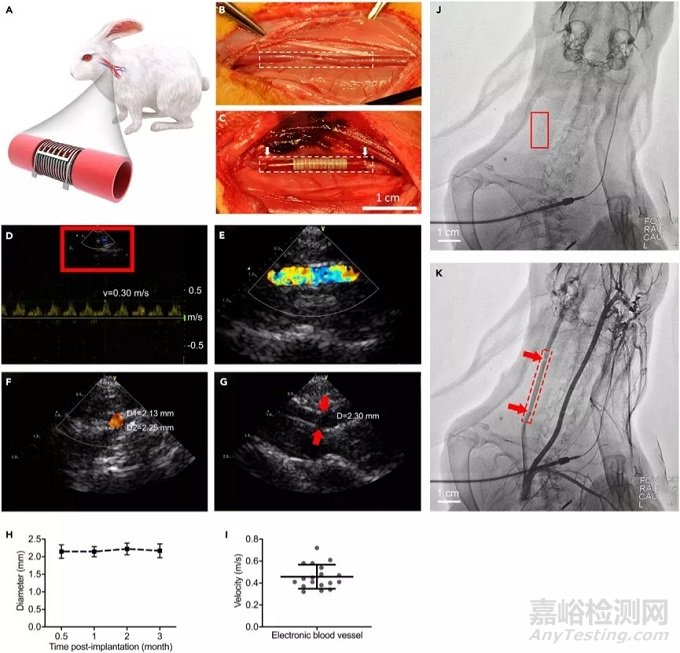
6、电子血管在兔体内植入和原位监测实验:
为了研究将电子血管作为血管植入物的可行性,本研究选择了新西兰兔(年龄为200–300天;体重为3-4 kg)作为动物模型,为避免宿主抗移植物的免疫排斥反应,体内移植实验使用脱细胞电子血管植替代了其颈总动脉。通过多普勒超声成像和动脉造影监测了植入的电子血管在体情况,多普勒超声成像显示:电子植入后3个月后,任具有良好的血流,血管的直径保持在一个相对恒定的值(约2.3毫米),平均血流速度处于正常值范围内,约为0.47ms-1;动脉造影常常作为血管通畅性的检测的金标准,电子血管因有液态金属电路,使得在造影下有良好的对比度,便于观察,造影结果显示:电子血管与天然颈动脉吻合良好,血流通畅,电子血管直径没有缩小,未发生狭窄。
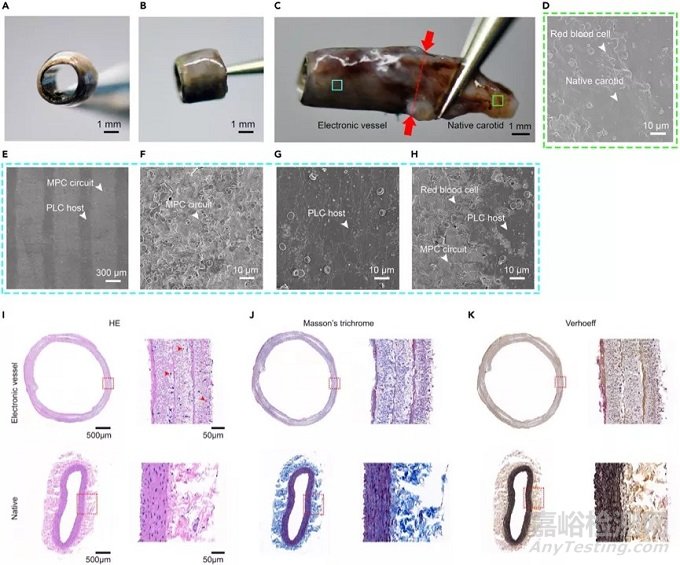
7、电子血管在体研究:
我们解剖分析植入体内3个月后的电子血管,结果显示:植入的电子血管的内腔和外表面光滑,被重塑组织覆盖,由于没有血压的缘故,解剖出的天然血管的直径显著减小,而电子血管可保持与植入前相同的直径。后将解剖出的电子血管行扫描电镜检测,观察其电路的微结构。结果回示:MPC-PLC膜仍与MPC电路和PLC主体保持叉指式结构,膜上形成了一层新组织,覆盖了MPC-PLC膜内表面,有与天然血管壁上的数量相似的红细胞覆盖;植入后3个月检测电子血管中电路的导电性,结果显示:MPC电路仍处于导电状态,电导率约为7.2×3103 S cm-1。
为观察植入的电子血管的组织学形态变化,对电子血管进行了组织学染色,设置天然颈动脉血管为对照,结果显示:HE染色显示,电子血管横截面为圆形、连续呈红色,与天然血管相似。三层MPC-PLC膜合并形成一个完整的层,可见不同层之间分泌出大量的细胞外基质。将电子血管中的细胞密度与天然颈动脉进行了比较,结果显示:电子血管的细胞密度约为400 cells mm2,天然颈动脉约为535 cells mm2。电子血管的内腔中形成了具有弯曲结构的致密细胞层,提示植入的电子血管得到了很好的内皮化,从而确保了良好的血流通过。为进一步分析植入的电子血管中的成分,将其进行Masson染色(Masson染色可以很好区分和评估肌原纤维和胶原蛋白)和Verhoeff染色(Verhoeff染色可以明确弹性蛋白纤维的存在)。Masson染色和Verhoeff染色均提示电子血管各层内部以及不同层之间均分布均匀的胶原蛋白和弹性纤维,与天然血管相比,电子血管细胞外基质分泌更多,这可能与材料降解和组织重塑有关。综上结果表明,电子血管植入3个月后,仍可稳定的工作发挥作用。
参考文献:
Cheng et al., Electronic Blood Vessel, Matter (2020), https://doi.org/10.1016/j.matt.2020.08.029

来源:CCI心血管医生创新俱乐部


