您当前的位置:检测资讯 > 培训会展
嘉峪检测网 2020-08-31 09:59

2020年4月ICH S11《支持儿科药物开发的非临床安全性试验指南》达到ICH流程第四阶段,S11专家工作组制作了第四阶段的介绍性培训材料,于官网发布。该指南的范围包括:
组织工程产品、基因和细胞疗法以及疫苗不包含在内。培训材料主要包含以下内容:
详见:https://admin.ich.org/sites/default/files/inline-files/S5-R3_Step_4_AudioPresentation_2020_0520_Final.pptx
FDA最近公布了2021财年处方药用户费用。《联邦食品、药物和化妆品法案》经2017年《处方药用户费用修正案》(PDUFAVI)修订,授权FDA 对某些人用药和生物制品的审评收取费用,并对某些经批准的产品收取处方药项目费。该通知确定了2021财年的费用。FDA利用从2018年10月1日到2020年4月30日提交的简化新药申请(ANDA)的数据,来估算2021财年将引发申请费的新原始ANDA数量。FDA预估2021财年将有约867份新原始ANDA引发申请费。并非所有新原始ANDA都将被FDA接收,并且其中一些被拒收的将在同一财年重新提交。因此,FDA预计,在2021财年实际引发费用的“完整的申请等价物(FAE)”ANDA数量将为872件。2021财年的申请费估计为每个ANDA196,868美元。一件ANDA视为一件“FAE”(fullapplication equivalents)。ANDA提交分为三个类别,分别是:新原始提交,即先前从未由FDA接收过的提交;曾被FDA拒收过的提交,由于付费失败以外的原因;由于付费失败以外的原因被拒收后,重新提交。为了计算药物主文件(DMF)的费用,FDA评估了DMF提交数量随时间的变化。在2019财年和2020财年,每月收到平均31份付费的DMF提交。将每月平均31份DMF乘以12个月,得出2021财年预计有372份付费DMF提交。因此,2021财年DMF费用为69,921美元。其他费用总结如下:
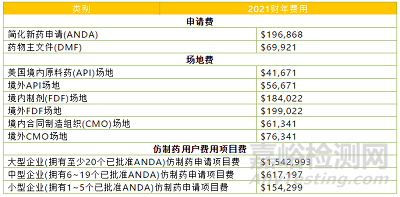
这些费用自2020年10月1日起生效,有效期至2021年9月30日。来源:https://www.federalregister.gov/documents/2020/08/03/2020-16833/prescription-drug-user-fee-rates-for-fiscal-year-2021
根据2018—2022财年仿制药用户费用修正案(GDUFA)的重新授权,FDA承诺在2020年10月之前对非活性成分数据库(InactiveIngredient Database, IID)进行重大改进。如GDUFA II承诺书第17页所述,FDA将致力于完成非活性成分数据库的优化,以便用户可以通过电子查询获得每种给药途径下非活性成分准确的最大每日暴露量(MDE,也称为最大每日摄入量,MDI)。FDA将致力于对IID进行持续更新,并发布季度变更通知,通知包括所做的每一项变更以及变更所替换的信息。变更日志于2019年10月首次以静态文档的形式发布,2020年6月更新为改进的可搜索交互式格式。2020年7月28日,FDA首次在IID中添加MDE信息。随着FDA获得更多的MDE信息,将在IID以后的出版中添加更多辅料的MDE信息。随着更多信息的收集,FDA还期望许多MDE的级别将会提高。来源:https://www.fda.gov/drugs/drug-approvals-and-databases/most-recent-changes-iid-database
2020年8月6日,美国总统特朗普发布了一项行政令,要求确保基本药物、医疗防护措施和关键投入在美国制造。行政令指出:“美国国内供应链必须能够满足国家安全要求,以应对来自核威胁(CBRN)和公共卫生紧急情况的威胁,包括新出现的传染病,如新冠肺炎。减少对基本药物、医疗防护措施和关键投入的外国制造商的依赖是十分关键的,以确保这些产品在美国国内充足且稳定的长期生产,最大限度地减少潜在的短缺,并动员公共卫生产业基地应对这些威胁。”在行政令签署后的90天内,并根据需要定期更新,FDA局长应与管理和预算办公室(OMB)主任、卫生和公众服务部防备和响应助理部长、总统经济政策助理以及贸易和制造政策办公室主任协商,确定基本药物、医疗防护措施及其关键投入的产品清单,这些药物在医疗上是必要的,在任何时候都必须满足患者需求的数量和适当的剂型。卫生和公众服务部部长应通过FDA专员采取适用法律的恰当行动,以:(一)酌情加快FDA对美国国内基本药物、医疗防护措施和关键投入(包括传染病和CBRN威胁防备和响应所需的投入)制造商的批准或许可;(二)发布关于先进制造技术开发的指导和建议;(三)与各国谈判,增加现场检查,增加对生产基本药物、医疗防护措施和关键投入受监管的设施飞行检查的次数;(四)如果生产基本药物、医疗防护措施和关键投入的设施拒绝或不合理地拖延检查,则酌情拒绝进口。来源:https://www.whitehouse.gov/presidential-actions/executive-order-ensuring-essential-medicines-medical-countermeasures-critical-inputs-made-united-states
为确保手部卫生,美国疾病控制和预防中心(CDC)建议在没有肥皂和水的情况下,使用酒精含量至少60%的洗手液。FDA现已开发了一种实验室分析程序来评估洗手液成品的质量。分析程序(经过适当验证)可用于评估以乙醇或异丙醇(也称为异丙醇或2-丙醇)作为标记活性成分的产品,并可筛选潜在的有害杂质。该分析程序旨提供一种方法来帮助确保洗手液产品标签成分的含量准确,且不含有害水平的杂质。气相色谱-质谱联用技术(GC-MS)已开发并验证用于洗手液的质量评估。该方法可用于检测酒精含量(乙醇和异丙醇),并检测FDA洗手液指南中列出的目标杂质。FDA指南附件1表1中提到的杂质被称为1级杂质,指南附件1表2中列出的杂质被称为2级杂质。下表1和表2列出了1级和2级杂质、它们的临时限值、1级杂质GC-MS方法的检测限以及通过该方法评估的每种杂质的浓度范围。
表1 可用所述方法检测的1级杂质列表
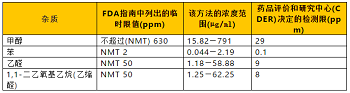
表2 可用所述方法检测的2级杂质列表
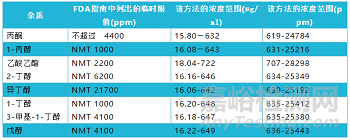
详见:https://www.fda.gov/media/141501/download
COVID-19公共卫生紧急事件不仅影响公共卫生,还影响药物开发项目、正在进行的生产运行以及FDA执行检查的能力。FDA了解到赞助商和申请人对这些影响有许多疑问,因此,FDA开发该指南以提供一些常见问题的解答。其中部分问答摘录如下:Q2:哪些类型的检查将被视为“关键任务”?A2:FDA对检查是否为关键任务的评估考虑了许多因素,这些因素与美国患者从接受检查的产品中获得的健康利益有关。这些因素包括但不限于:产品是否被指定用于突破性治疗或指定用于再生医学高级治疗,或产品是否用于诊断、治疗或预防没有其他合适替代品的严重疾病或医疗状况。有因检查和批准前检查都可以被视为关键任务。在决定是否执行关键任务检查时,FDA会考虑检查官、现场或设施员工的安全问题,并在适当的情况下,考虑临床试验参与者和检查场地其他患者的安全问题。Q9:新冠疫情期间,如何加快对所需药品或生物制品的ANDA、NDA或BLA制造变更的实施?A9:FDA正在使用多种工具来加快制造变更的实施,例如基于风险减少补充申请的报告类别和应用灵活审评。符合FDA关于药品和生物制品批准后化学、制造和控制变更相关法规要求的,FDA可能会考虑使用可用的信息和方法来缓解变更相关产品质量的风险,以支持某些补充申请的报告类别低于最合适的报告类别。在公共卫生紧急情况下,FDA愿意考虑申请人使用较低报告类别提交某些变更申请,报告类别降低基于对治疗或预防新冠肺炎、或短缺的药物/生物制剂相关风险的缓解。
FDA可能额外实施灵活的审评方法,例如加快补充申请评估,调整作为风险效益评估的一部分提交数据的要求,以及使用其他的工具决定对现场检查的需求。详见:https://www.fda.gov/media/141312/download
2020年8月18日,FDA发布了题为《21CFR 320.38(c)条款下生物利用度BA和生物等效性BE留样量的合规政策》行业指南。该指南描述了FDA对体内生物利用度(BA)和体内或体外生物等效性(BE)试验中使用的检测样品和参照标准品留样量的合规政策。该指南仅适用于21 CFR320.38(c)中包含的对留样的要求。21 CFR第320.38(c)条要求申请人保留用于BA和BE试验的检测样品和参照标准品,留样量应足够FDA进行五次申请或补充申请中要求的所有放行检测。随着FDA在留样检测能力方面的技术进步,如果留样量足够进行所有检测,FDA不打算对NDA或ANDA申请人(或其CRO)违反21 CFR320.38(c)的行为采取行动。该指南的附录1提供了FDA目前认为对某些产品满足所有检测的最小留样量列表。如果某一产品包含在该清单中,申请人留样量与该列表中的数量一致,FDA不打算对违反21 CFR320.38(c)的申请人采取行动。对于未包含在附录1中的产品,如果NDA和ANDA的申请人或CROs希望留样量少于21 CFR320.38(c)中规定的用于BA或BE检测样品和参照标准品的留样量,则应向FDA递交申请。对于以单剂量单位生产的药品(即一个单位提供该药品的一次剂量),只要每次装运药品的最小留样量是检测样品和参照标准品的30个单位,则FDA不打算强制要求留样量足够进行五次申请或补充申请中要求的所有放行检测。对于以多剂量单位生产的药品(即一个单位提供该药品的多次剂量),只要每次装运药品的最小留样量是检测样品和参照标准品的3个单位,则FDA不打算强制要求留样量足够进行五次申请或补充申请中要求的所有放行检测。本指南仅适用于21 CFR 320.38(c)中包含的留样要求。不适用于21 CFR320.38中其他部分对留样的要求,例如检测机构如何选择要测试的样品,留样如何保存以及留样是否能代表BA或BE试验中的检测样品和参照标准品。另外,本指南并不会影响21 CFR211.170中cGMP对留样的要求。详见:https://www.fda.gov/media/141218/download
该指南旨在帮助根据《联邦食品、药品和化妆品法案》(FD&C法案) 505(c) 章节批准的新药申请(NDAs)和 505(j) 章节批准的简化新药申请(ANDAs)的持有者,按照506I章节的要求提交上市状态通知。该指南确定了这些上市状态通知所需的内容,以及提交给FDA的格式。FDA要求NDA和ANDA持有者向其通报已批准的NDA和ANDA药品的上市状况。2017年FDA再授权法案(FDARA)在《FD&C法案》中增加了第506I节,对上市状态报告的要求规定如下:撤市通知——要求NDA和ANDA持有者在批准药物撤市前180天向FDA提供书面通知。无法销售通知——要求NDA和ANDA持有者,如果药品在批准之日起180天内无法销售,则在药品批准之日起180天内向FDA提供书面通知。关于上市状况的一次性报告——要求NDA和ANDA持有人在FDARA颁布后180天内向FDA提供书面通知,说明NDA和ANDA持有人在橙书有效部分的药物是否可供销售,或者有效部分的一种或多种NDA或ANDA持有人的药物是否已撤市或从未销售。在考虑药品是否已撤市时,FDA指出,FDA先前曾表示,撤市不仅限于产品的永久撤回,还可以包括“停止销售该产品的任何决定。” FDA特别描述了确定某产品是否被视为“已撤市”的政策,具体如下:根据FD&C 法案的第FD&C 法案505(j)(5)和505(j)(6)(C)章节,如果申请人停止了某药品的分销,无论是否已下令召回以前分销的产品,则该药品应被视为“已撤市”。然而,除非有安全或有效性方面的考虑,否则药品供应常规的、暂时性中断不会被视为撤市。指南全文详见:https://www.fda.gov/media/120095/download
近十年来,各种医疗机构对固体口服剂型药品重新包装到单位剂量容器中的需求不断增加。单位剂量重新包装的增加导致了关于稳定性试验和这些重新包装产品恰当有效期的问题。该指南描述了在何种情况下,FDA不打算对这些重新包装产品的稳定性试验采取行动,以及该情况下适当的有效期。目前,根据FDA目前对所涉及风险的理解,对于重新包装到单位剂量容器中的固体口服剂型药物,如果这些产品被分配有效期并贴上标签,有效期不超过:(1)重新包装之日起的6个月,或者(2)从重新包装之日到原始制造商产品原容器上的有效期之间的25%,以较短的时间为准,并且满足以下条件时,则FDA不打算对不符合211.137和211.166(即由稳定性试验确定有效期)要求的情况采取行动。(1)单位剂量容器符合美国药典通则< 671>《容器——性能测试》中描述的A类或B类标准。只有在以下情况时,重新包装者应该使用符合B类标准的容器:(a)关于B类材料的透湿性和药品的湿敏性的适当数据可用,以及(b)对这些数据的风险评估高度显示,在指定的有效期内,使用这种容器不会损害产品的质量。(2)如果药品对制造商标示对光敏感(如标签上的“避光”),单位剂量重新包装容器封闭系统应提供等于或大于药品原始容器封闭系统的避光保护。(3)药品的原始容器以前没有被打开过,对原始容器所有内容物都在一次操作中重新包装。(4)重新包装和储存应在与原始药品标签中描述条件一致的环境中进行。如果原始标签中没有规定温度和湿度,则在重新包装(包括储存)过程中,产品应保持在“受控的室温”和“干燥的地方”(如美国药典< 659>包装和储存要求中定义)。(5)该药品的标签没有包含禁止重新包装。指南全文详见:https://www.fda.gov/media/70985/download
为了解决与使用含甲醇的乙醇和无水乙醇相关的严重危害,辅料各论专家委员会修订了乙醇和无水乙醇各论。乙醇和无水乙醇各论的修订包括:
“鉴别C”中还包括一个注释,强调鉴别的符合性是通过满足各论中所有鉴别检测的要求来确定的,如下所示:【注:除了上述“鉴别A”和“鉴别B”之外,该检测必须符合美国药典。】
乙醇和无水乙醇各论修订的公告将取代目前有效的各论,并将于2020年9月1日正式生效。来源:https://www.uspnf.com/sites/default/files/usp_pdf/EN/USPNF/revisions/alcohol-rb-notice-20200817.pdfhttps://www.uspnf.com/sites/default/files/usp_pdf/EN/USPNF/revisions/dehydrated-alcohol-rb-notice-20200817.pdf
国际监管机构于7月31日发表了一份报告,内容涉及为开发COVID-19治疗方法进行的临床试验中各个主要终点的可接受性。该报告总结了在国际药品监管当局联盟(ICMRA)组织的第二次新冠肺炎疗法和临床试验研讨会的主要成果。研讨会于2020年7月20日由日本药品和医疗器械管理局(PMDA)和欧洲药品管理局(EMA)共同主持。许多治疗新冠肺炎的药物开发商已经或正在进行临床试验,并已向监管机构提出了第三阶段临床试验的提案。监管机构就可接受的终点达成一致将有助于在全球范围内快速、一致地实施新冠肺炎药物的临床试验。对于患有中度至重度新冠肺炎的住院患者,可利用一系列合适的主要终点来衡量新冠肺炎试验疗法的临床益处,用以支持监管决策。尽管研讨会参与者一致认为死亡率不是这些患者唯一可接受的主要终点,但在所有不打算主要使用这一结果的试验中,死亡率数据仍应作为一个关键的次要终点进行收集。对于轻度新冠肺炎病的门诊患者,监管者同意死亡率作为主要终点可能不合适。相反,根据试验的主要目的,病情恶化的速度和在预先指定的时间点未住院的患者比例作为主要终点可能更合适。研讨会由PMDA国际项目办公室主任佐藤纯子和EMA生物健康威胁和疫苗战略负责人马尔科·卡瓦雷利主持。来源:https://www.ema.europa.eu/en/news/global-regulatory-workshop-covid-19-therapeutics-2-agreement-acceptable-endpoints-clinical-trials
2020年8月3日, EMA更新了上述问答指南,将亚硝胺评估要求扩大至生物制品。2019年9月,EMA针对含有化学合成原料药的医药产品发起了“审核要求”,要求制药公司审核其生产工艺,以确定并在必要时缓解亚硝胺杂质存在的风险,并将结果报告给当局。这项工作是在CHMP根据第5(3)条对人用药中亚硝胺杂质进行审查时启动。根据第5(3)条的审核查结论,CHMP认为生物制品中也存在亚硝胺的风险,特别是具有以下风险因素的生物制品:
由于上述原因,目前的审核要求已经扩大到所有供人类使用的生物制品。审核要求包括以下三步:第一步:上市许可持有人(MAH)进行风险评估,以确定原料药和/或制剂中是否存在亚硝胺的风险;第二步:如果确定存在风险,MAH将继续进行确认性检测,以确认亚硝胺是否存在。MAH应尽快报告结果;第三步:如果确认存在亚硝胺,MAH应通过提交变更申请实施有效的风险缓解措施。对于含有化学合成原料药的产品,第一步风险评估应在2021年3月31日前完成并报告。对于含有生物原料药的产品,第一步风险评估应在2021年7月1日前完成并报告。第二步确认性检测应根据产品优先级进行。对于含有化学合成原料药的产品,第二步的确认性检测和需要提交的上市许可变更(第三步),期望最迟在2022年9月26日完成。对于含有生物原料药的产品,第二步的确认性检测和需要提交的上市许可变更(第三步),期望最迟在2023年7月1日完成。详见:https://www.ema.europa.eu/en/documents/referral/nitrosamines-emea-h-a53-1490-questions-answers-marketing-authorisation-holders/applicants-chmp-opinion-article-53-regulation-ec-no-726/2004-referral-nitrosamine-impurities-human-medicinal-products_en.pdf
先前有报道称某一持有CEP证书的公司所生产的扑热息痛可能受到杂质对氯苯胺(PCA)的污染,目前欧洲药品质量管理局(EDQM)的调查已有了结论。PCA是一种已知的杂质,可能在扑热息痛生产过程中的某些条件下形成,应通过适当的控制策略去除或限制该杂质。即使使用最高日给药剂量的扑热息痛计算,媒体报道的PCA水平远低于ICH M7指南(评估和控制药品中DNA反应性/诱变性杂质以限制潜在致癌风险)附录中规定的34微克/天的可接受摄入量(AI)。此外,没有关于用于该批次检验的分析方法及其方法验证等信息。由于报告的结果显示PCA水平没有高于国际商定的可接受限值,因此EDQM认为扑热息痛的安全性没有受到影响,没有对相关证书采取任何措施,CEP证书仍然有效。来源:https://www.edqm.eu/en/news/update-review-cep-application-regarding-impurity-active-substance-paracetamol
2019年10月,EDQM要求持有CEP的公司使用质量风险管理原,对其化学合成原料药潜在亚硝胺形成的情况进行风险评估。在EMA官网站上发布的专门问答文件中概述了风险评估中要考虑的因素。CEP持有人进行第一步风险评估并将已确定风险通报EDQM的最后期限原先定为2020年3月26日,后因COVID-19疫情推迟到2020年7月31日。2020年6月,EMA根据欧盟第726/2004号条例第5(3)条审核报告,为MAH提供了如何避免人用药品中存在亚硝胺的指南。作为此次审核结果的一部分,EMA通过了实施第5(3)条意见的最新期限。然而,EDQM决定不改变CEP持有人的截止日期,仍为2020年7月31日。原因是,活性物质中亚硝胺存在的风险评估应该足够早,以便为MAH收集制剂相关的数据。另外,大多数CEP持有人已经完成了这一步骤。任何在进行风险评估时遇到困难的CEP持有人应尽快通知EDQM,必要时提出合理的时间表。另外,根据上述问答文件,从2020年10月1日起,申请人和CEP持有人应在所有新的CEP申请、姐妹文件或更新申请,以及可能引入亚硝胺形成风险的任何变更(即生产工艺的变更、起始原料或中间体供应商的变更等)中,系统性地包含一份关于亚硝胺潜在形成的风险评估。风险评估不仅应强调与制造过程相关的风险,还应强调制造过程中使用的材料和引入其他潜在污染源(如起始物料、试剂、溶剂、回收物料、设备、降解等)而产生的风险。无论是否识别出风险,风险评估都应包含在CEP申报资料中。来源:https://www.edqm.eu/en/news/nitrosamines-risk-assessment-update-cep-holders
2020年8月世卫组织发布上市指南第三版草案。政府的基本作用是保护和促进公众的健康与安全,包括提供医疗保健。一个运行良好的医疗保健系统依赖于安全、有效且质量始终有保证的医疗产品的可及性和可负担性。由于各种医疗产品对健康的影响,评估其质量、安全性和有效性的难度以及与这些产品开发、生产、供应和监督相关的复杂性,医疗产品行业是所有行业中监管最严格的行业之一。更重要的是,公众的利益和安全依赖于对监管机构的信任,该机构负责确保只有合法贸易中的产品才可用,并且上市的产品是安全的、具备声称的特性和有保证的质量。监管当局有责任确保以实现公共政策为目标的方式进行监管。应当建立和实施一个条理清晰的法律框架,以提供所需的监管水平,同时促进创新和获得安全、有效和高质量的医疗产品。这也意味着建立必要的灵活性和响应能力以管理公共卫生突发事件,着眼于新技术和实践,并促进国际监管合作。政府建立和维护保护和促进公民健康的监管体系会产生成本。受监管方遵守监管会产生费用。但是,低效的监管系统会产生额外的影响(卫生系统、社会经济和经济影响),对疾病发病率/死亡率、医疗保健成本和经济有潜在的重大影响。健全的法律框架、采用国际规范和标准以及招聘和培养有能力的工作人员是确保“良好监管”的必要条件,但不是充分条件。这些措施必须与良好监管规范(GRP)相结合,指导受委托监管的组织内的所有个人应用法规要求,基于科学和法律建立清晰、一致、公正、适度、适时的决策方法。GRP可以定义为一系列原则和实践,用于制定、实施和维护监管工具(包括法律、法规和指南),从而以最有效的方式实现公共卫生政策目标。GRP的成功应用是基于科学和快速反应的现代化监管体系的标志,该体系将监管规范转化为期望的结果。作为卫生系统性能和可持续性的重要组成部分,GRP提供了一种方法,用于建立和实施对医疗产品进行合理、可负担和有效的监管。该文件旨在向成员国介绍得到广泛认可的GRP原则。该文件提出的原则来自对各国政府和多边组织就此问题编写的公开文件的广泛审查,以及许多协商研讨会、基准制定工作和与会员国的互动。该文件中提出的九项原则,如合法性、一致性、独立性、公正性、恰当性、灵活性、清晰度、高效和透明度,适用于所有负责医疗产品监管的机构,无论其资源、复杂程度或监管模式如何。GRP是有关最佳监管实践的一系列相关指导文件的基础。这套不断扩展的指导文件旨在为监管机构提供全面的指导,以提高其监管效率。实践“操作指南”和工具将对该文件进行补充,以促进GRP的实施。指南主要内容包括:1.概述2.背景3.目的4.范围5.目标6.主要考虑因素7.医疗产品监管体系概述8.良好监管规范原则8.1合法性8.2一致性8.3独立性8.4公正性8.5恰当性8.6灵活性8.7清晰度8.8高效8.9透明度9.良好监管规范的促进因素9.1政策和政府范围的支持9.2具有领导力的有效组织和优良管理9.3组织间和组织内的沟通、合作和协调9.4稳健和运作良好的质量管理体系9.5充足和可持续的财政资源9.6有资质的人力资源9.7预设的组织道德和价值观9.8科学和数据驱动的决策流程10.实施良好监管规范的做法详见:https://www.who.int/medicines/areas/quality_safety/quality_assurance/QAS16_686_rev_3_good_regulatory_practices_medical_products.pdf

来源:Intertek化学与药业


