您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-06-08 09:48
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
今日头条
豪森药业阿法替尼首仿获批。豪森药业4类仿制药马来酸阿法替尼片获国家药监局批准上市,成为该品种国内获批的首仿药。阿法替尼属于第二代EGFR-TKI,原研药由勃林格殷格翰研发。与第一代可逆的EGFR TKI不同,阿法替尼会不可逆地与EGFR结合,从而达到关闭癌细胞信号通路、抑制肿瘤生长的目的。原研产品已于2017年2月获批进入中国,用于一线/二线治疗EGFR突变阳性的非小细胞肺癌。全球目前共有8款EGFR-TKI获批上市,其中豪森药业三代EGFR-TKI阿美替尼已于2020年3月在中国获批上市,厄洛替尼仿制药上市申请正处于“在审评”阶段。
国内药讯
1.一致性评价研发费用榜:47个药品超1000万。据医药魔方不完全统计,上市公司公告过研发费用的通过一致性评价药品(包含视同通过)共有156个。其中,研发费用在1000万元以下的药品有109个,占比70%,1000-2000万元的有34个,占比22%,2000万以上的有13个,占比8%;3/4类视同通过一致性评价的20个药品中,费用大于等于1000万元的药品有13个;恒瑞医药的醋酸阿比特龙研发费用最高,达3905万元。而恒瑞医药同样也是一致性评价研发费用超过1000万药品个数最多的企业,共有9个,其次为华海药业,有4个。
2.正大天晴艾滋病药Truvada首仿获批。正大天晴4类仿制药恩曲他滨替诺福韦片获国家药监局批准上市,成为该品种国内首仿,并视同通过一致性评价。恩曲他滨替诺福韦(Truvada)由吉利德开发,最早于2004年8月获FDA批准上市,联合其他抗逆转录病毒药物治疗HIV-1感染,2012年被FDA批准用于预防性传播导致的成人获得性HIV-1感染。2019年Truvada全球销售额约30亿美元。目前该品种国内按新4类提交上市申请的厂家还有齐鲁、海思科、倍特和安徽贝克生物。
3.海正药业2款仿制药获批。海正药业2款新4类仿制药(富马酸喹硫平缓释片和盐酸多奈哌齐口崩片)获国家药监局批准上市并视同通过一致性评价。其中,富马酸喹硫平缓释片为该品种国内第2家通过一致性评价的产品,盐酸多奈哌齐口崩片为该品种国内首个获批的仿制药。这2款产品均已在2018年获得FDA批准。富马酸喹硫平缓释片原研由阿斯利康开发,临床上主要用于治疗精神分裂症和双相情感障碍的抑郁发作。盐酸多奈哌齐口崩片原研由卫材制药研发,临床上主要用于治疗轻度、中度或重度阿尔茨海默病。
4.礼来甘精胰岛素中国Ⅲ期研究结果积极。礼来长效基础胰岛素类似物Basaglar(甘精胰岛素)治疗中国成年2型糖尿病(T2DM)患者的Ⅲ期研究ABET达主要终点。该研究评估联合口服降糖药,Basaglar每日一次给药(QD)非劣效于来得时QD,研究证实在0.4%非劣效性界值下Basaglar不劣于来得时,来得时也不劣于Basaglar(LS平均差异 [Basaglar - 来得时] = -0.05%,95%CI:-0.19%~0.10%)。两治疗组之间总体低血糖、夜间低血糖及严重低血糖的总发生率和总比率均没有显著的统计学差异,不良反应及注射部位反应发生率也相似。
5.珐博进“first-in-class”新药Pamrevlumab国内申报临床。珐博进“first-in-class”新药Pamrevlumab在中国提交的临床申请获CDE受理。Pamrevlumab可抑制结缔组织生长因子(CTGF)的活性,目前正处于治疗特发性肺纤维化(IPF)和局部晚期不可切除胰腺癌(LAPC)的III期临床阶段,以及治疗Duchenne肌营养不良(DMD)的II期临床阶段。在美国,Pamrevlumab已获FDA授予的针对上述3种适应症的孤儿药资格,以及治疗IPF和LAPC患者的快速通道资格。珐博进/阿斯利康共同开发的first-in-class肾性贫血药物罗沙司他已于2018年12月在中国率先获批上市,Pamrevlumab是珐博进开发的又一款潜力药物。
6.和铂医药联手艾伯维等合作开发COVID-19创新单抗。艾伯维、和铂医药、荷兰乌得勒支大学及伊拉斯姆斯大学医学中心联合宣布就一项创新型单克隆抗体的共同开发达成战略合作关系。此次合作开发的创新型全人源、47D11中和抗体,靶向冠状病毒的S蛋白的保守区域,拟用于预防和治疗由SARS-CoV-2病毒引起的新型冠状呼吸道疾病(COVID-19)。该抗体由和铂医药与荷兰乌得勒支大学及伊拉斯姆斯大学医学中心共同发现。根据协议,艾伯维将通过前期研究和临床开发准备工作全力支持和铂医药及和铂医药合作者。同时,艾伯维也将有机会获得有该项目全球独家商业化权益。
国际药讯
1.FDA发布69份仿制药BE指南。6月3日,FDA发布69份产品生物等效性(BE)指南,其中26项为新增,43项为修订。新增指南涉及产品包括:安斯泰来公司的急性髓性白血病药物Xospata(吉瑞替尼),辉瑞的PARP抑制剂 Talzenna(他拉唑帕尼),ViiV Healthcare的 HIV治疗药物 Dovato(多替拉韦+拉米夫定),费森尤斯卡比的 Omegaven(ω-3鱼油脂肪乳),皮下丁丙诺啡和缓释二甲双胍等等。新修订的产品指南涉及:阿斯利康2型糖尿病治疗药Farxiga(达格列净)和 Qtern(达格列净/沙格列汀),Keryx公司的慢性肾病贫血药 Auryxia(枸橼酸铁)等。
2.默沙东创新抗生素获FDA批准。FDA批准默沙东开发的复方制剂Recarbrio(亚胺培南/西司他丁/relebactam)扩展适应症,治疗18岁以上的医院获得性细菌性肺炎和呼吸机相关细菌性肺炎(HABP/VABP)患者。在一项临床试验中,HABP/VABP患者接受Recarbrio或哌拉西林+他唑巴坦治疗,在接受治疗28天内,Recarbrio治疗组有16%患者死亡,哌拉西林+他唑巴坦治疗组患者的死亡率为21%。Recarbrio此前已获FDA批准用于治疗复杂性尿路感染和复杂性腹腔内感染患者。
3.诺华苏金单抗治疗中轴型脊柱关节炎长期数据积极。诺华(Novartis)特异性抗IL-17A单抗药物Cosentyx(司库奇尤单抗,俗称苏金单抗)治疗活动性非放射学中轴型脊柱关节炎(nr-axSpA)的Ⅲ期临床PREVENT的52周结果积极。与安慰剂相比,接受Cosentyx加载剂量(诱导:每周一次皮下注射150mg;维持:每月一次皮下注射150mg)治疗的患者在第16周和第52周达到ASAS40的比例显著提高(第16周:41.5% vs 29.2%:P<0.05;第52周:35.4% vs 19.9%:P<0.05)。在52周之前的试验中,加载剂量组也达到疼痛、活动性和健康相关生活质量改善的次要终点。目前,Cosentyx用于nr-axSpA已获欧盟批准。
4.英国羟氯喹治疗住院新冠患者未提供临床益处。在一项由英国政府资助的旨在评估多种潜在疗法治疗COVID-19住院患者的大型临床RECOVERY研究中,使用羟氯喹治疗未能提供临床益处。与标准护理相比,羟氯喹未能使患者在28天后死亡的比例降低(25.7%vs23.5%,HR=1.11,95% CI:0.98-1.26,p=0.10),而且没有证据表明它在患者住院时间和其它临床结果指标上表现出益处。目前该试验已停止注册患者接受羟氯喹的治疗。
5.渤健红斑狼疮创新抗体达Ⅱ期终点。渤健在EULAR 2020大会上公布其在研抗BDCA2单抗BIIB059治疗皮肤红斑狼疮(CLE)患者的Ⅱ期临床LILAC积极数据。试验结果表明,使用皮肤红斑狼疮疾病面积和严重程度指数活性(CLASI-A)评分,接受BIIB059治疗的患者在16周时皮肤症状获得剂量依赖性缓解,达主要终点。50 mg、150 mg和450 mg BIIB059治疗组CLE患者的CLASI-A评分分别降低38.8%(p=0.015)、47.9%(p<0.001)和42.5%(p=0.001),显著高于安慰剂组(14.5%)。
6.阿斯利康和Accent合作开发靶向RNA修饰蛋白疗法。阿斯利康和Accent Therapeutics公司将合作发现、开发和推广靶向RNA修饰蛋白(RMP)的创新药物,用于治疗癌症。Accent公司致力于探索调节RNA修饰蛋白(RMP)的药物,目前研发管线中已拥有METTL3和ADAR1两个创新靶点药物。根据协议,Accent将负责指定临床前项目的研发活动,直至Ⅰ期临床结束。Ⅰ期临床完成后,阿斯利康将主导该项目的开发和商业化活动。Accent将获5500万美元的先期付款、里程碑付款和产品销售额的分成。
医药热点
1.《抗击新冠肺炎疫情的中国行动》白皮书发布。6月7日,国务院新闻办公室发布《抗击新冠肺炎疫情的中国行动》白皮书。截至2020年5月31日24时,我国累计报告确诊病例83017例,累计治愈出院病例78307例,累计死亡病例4634例,治愈率94.3%,病亡率5.6%。截至5月31日,全国各级财政共安排疫情防控资金1624亿元。截至5月31日,全国确诊住院患者结算人数5.8万人次,总医疗费用13.5亿元,确诊患者人均医疗费用约2.3万元。其中,重症患者人均治疗费用超过15万元,一些危重症患者治疗费用几十万元甚至上百万元,全部由国家承担。
2.世卫组织发布使用口罩预防新冠最新指南。世卫组织5日发布使用口罩预防新冠的最新指南,就哪些人群应佩戴口罩、何时佩戴以及口罩应使用何种材料等给出最新建议。相对先前版本,新指南建议,在疫情广泛传播的地区,所有在卫生临床区域工作的人员都应佩戴医用口罩,而不只是与新冠患者直接接触者;在出现新冠社区传播的地区,60岁及以上者,或患有其他疾病的人群,在无法保持社交距离的情况下应佩戴医用口罩。
3.北京7月1日起实行医院安检。北京市十五届人大常委会第二十二次会议表决通过《北京市医院安全秩序管理规定》,《规定》自2020年7月1日起施行。《规定》提出,医院应当建立安全检查制度,拒不接受安全检查的,医院有权拒绝进入。二级以上医院设警务室,与医院保卫部门联合办公。医院实行医院内主要通道、重点区域视频监控全覆盖,在急诊室、安检口等重点部位配备一键报警装置。
股市资讯
【广生堂】公司收到国家药监局核准签发的关于拉米夫定片的《药品补充申请批件》,公司拉米夫定片(贺甘定)通过仿制药质量与疗效一致性评价。适应症治疗伴有丙氨酸氨基转移酶持续(ALT)升高和病毒活动复制的、肝功能代偿的成人慢性乙型肝炎,是《国家基本医疗保险、工伤保险和生育保险药品目录》中临床使用经验丰富的抗乙肝病毒药物。
【香雪制药】2020年半年度预计实现归母净利润约1.34亿元-1.51亿元,同比增长140-170%。
【药明康德】(1)董事、监事、高级管理人员Edward Hu (胡正国)拟通过竞价交易减持不超过71,344股,即不超过0.0031%。(2)董事、监事、高级管理人员Steve Qing Yang(杨青)拟通过竞价交易减持不超过50,803股,即不超过0.0022%。(2)董事、监事、高级管理人员Shuhui Chen (陈曙辉)拟通过竞价交易减持不超过74,245股,即不超过0.0032%。(4)董事、监事、高级管理人员姚驰拟通过竞价交易减持不超过10,506股
审评动向
1. CDE最新受理情况(06月07日)
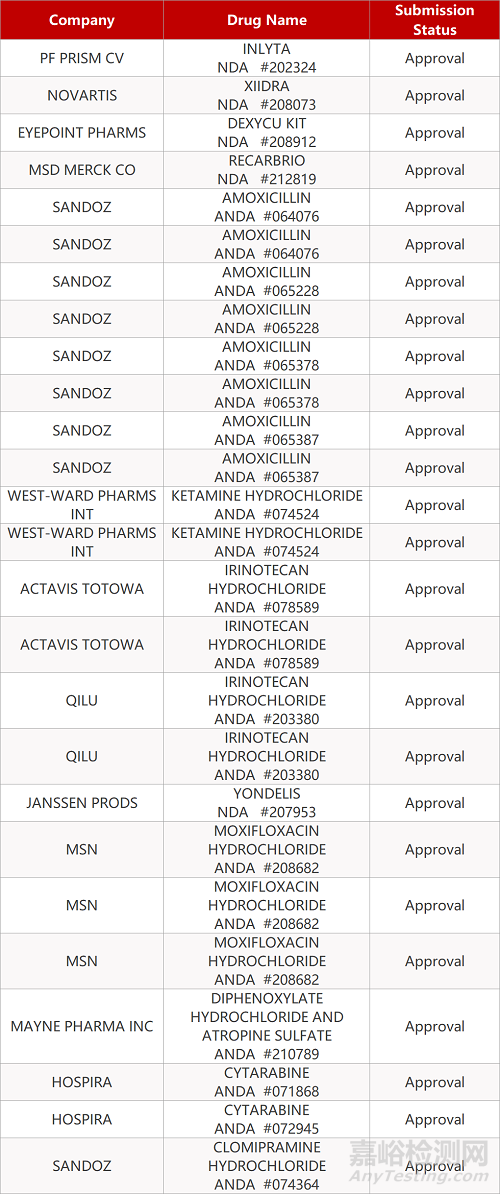
2. FDA最新获批情况(北美06月04日)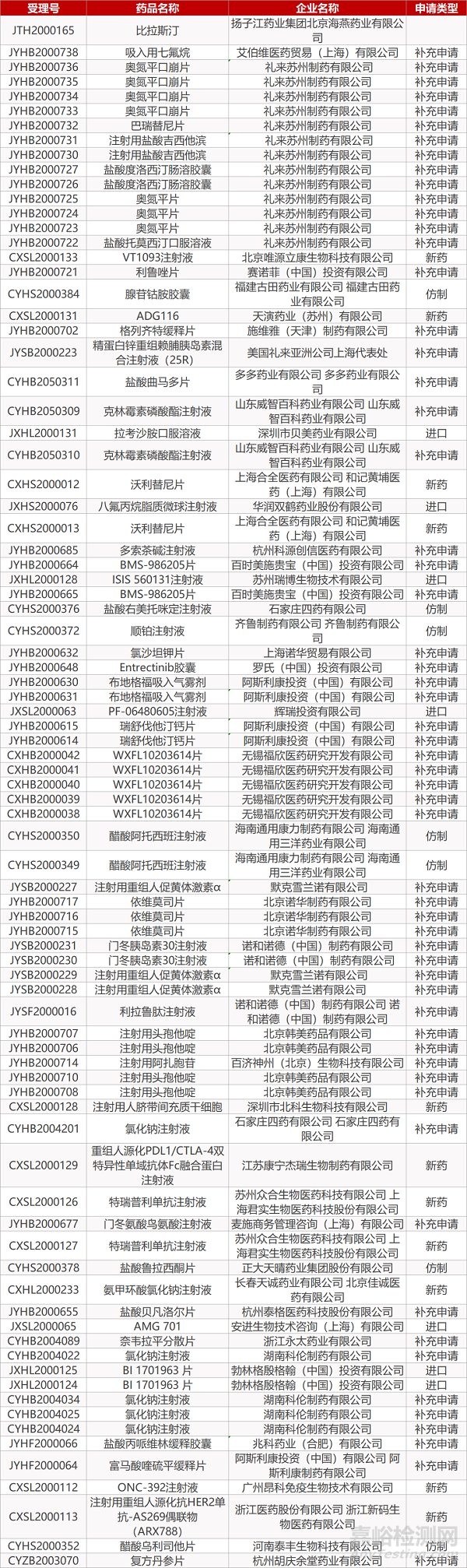
- The End -

来源:药研发


