您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-06-01 10:12
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
罗氏Tecentriq组合获FDA批准一线治疗肝癌。FDA批准罗氏旗下基因泰克PD-L1抑制剂Tecentriq(atezolizumab)与抗血管生成药物Avastin(bevacizumab)联用,一线治疗无法切除或转移性肝细胞癌患者。据悉这是目前唯一获FDA批准一线治疗无法切除或转移性肝细胞癌的癌症免疫治疗方案。在一项Ⅲ期临床IMbrave150中,与标准疗法相比,该组合将患者死亡风险降低42%(HR=0.58;95% CI:0.42-0.79;p=0.006),将患者疾病进展和死亡风险降低41%(HR=0.59;95% CI:0.47-0.76;p=0.006)。完整结果已在《新英格兰医学杂志》上发表。
国内药讯
1.绿叶制药利斯的明透皮贴国内即将获批。绿叶制药利斯的明透皮贴剂在国内的上市申请处于「在审批」状态,预计即将获批上市,用于治疗轻中度阿尔茨海默病(AD)。利斯的明贴剂是由绿叶集团德国子公司 Luye Pharma AG 的透皮贴剂研发平台开发,该产品及其制剂工艺受到全球多个专利的保护。目前,该产品已在全球20 多个国家获批上市销售。国内同类产品只有诺华的艾斯能获批上市销售。
2.正大天晴重组人凝血因子Ⅷ申报上市。正大天晴注射用重组人凝血因子Ⅷ的上市申请获得CDE受理,这是继神州细胞之后,国内第2家提交该品种上市申请的厂家。据统计,国内已获批上市的血源性凝血因子 VIII厂家有上海莱士、华兰生物和成都蓉生药业等7家,重组人凝血因子 VIII因生产工艺技术门槛高、生产难度大,尚未有经批准上市的国产重组凝血八因子蛋白药物。目前还主要依赖进口,生产厂家有拜耳、辉瑞和百特3家。
3.和黄医药MET抑制剂在华申报上市。和黄医药口服小分子MET抑制剂沃利替尼(savolitinib)新药上市申请获CDE受理,用于治疗间充质上皮转化因子(MET)外显子14跳变的非小细胞肺癌(NSCLC)。这也是沃利替尼在全球范围内递交的首个新药上市申请。此次提交申请是基于一项治疗MET外显子14跳变的肺肉瘤样癌(PSC)及其他类型非小细胞肺癌患者的Ⅱ期注册研究积极结果。和黄医药在2019年CSCO年会上已经公布了初步的研究数据。
4.康方生物PD-1启动肝细胞癌Ⅲ期临床。康方生物PD-1-1单抗 AK105(派安普利单抗)联合安罗替尼一线治疗晚期肝细胞癌(HCC)III期临床启动。该研究旨在评估这一联合疗法对比索拉非尼一线治疗晚期HCC患者的安全与有效性,评价AK105注射液的免疫原性以及探索PD-L1的表达与疗效之间的相关性。拟入组648例患者。AK105是康方生物自主开发的PD-1抗体新药,正大天晴已与康方生物签订协议共同推动该药物的注册上市及产业化进程。
5.恒瑞医药阿帕替尼肝细胞癌III期结果公布。恒瑞医药在ASCO 2020年会上公布10多项临床数据,包括阿帕替尼、吡咯替尼、卡瑞利珠单抗以及在研CDK4/6抑制剂SHR6390。其中阿帕替尼二线治疗晚期肝细胞癌(HCC)III期AHELP研究以口头报告形式入选ASCO 2020年会。该研究达到预设的主要终点指标。相较于安慰剂,阿帕替尼可显著延长患者的总生存期(8.7个月 vs 6.8 个月),也显著延长无进展生存期(4.5个月vs 1.9个月)、疾病进展时间,提高客观缓解率(10.7% vs 1.5%)。同时,阿帕替尼耐受性良好,与既往研究相比,未发现新的安全信号。
6.百济神州公布多项临床进展。百济神州在ASCO 2020年会上公布4项临床数据,其中3项为BTK抑制剂泽布替尼临床数据,另一项为PD-1替雷利珠单抗(百泽安)的Ⅲ期临床(BGB-A317-307)的重磅数据。BGB-A317-307研究评估百泽安联合紫杉醇与卡铂(A组)或联合白蛋白紫杉醇(ABRAXANE®)与卡铂(B组),对比仅用紫杉醇与卡铂(C组)用于一线治疗晚期鳞状NSCLC的效果。结果显示,在360例可评估患者中,接受百泽安联合化疗的A、B组中位PFS皆为7.6个月,而仅接受化疗的C组仅有5.5个月,达主要终点指标;ORR分别为A组73%、B组75%、C 组50%(40%-59%)。百泽安联合化疗在患者中总体耐受,未出现新的安全警示。
国际药讯
1.FDA批准首款tau病理成像药物。礼来开发的放射性诊断试剂Tauvid(flortaucipir F18)静脉注射剂获FDA批准上市,用于需要接受阿尔茨海默病评估的认知障碍成人患者。Tauvid适用于使用正电子发射断层扫描(PET)成像,评估大脑中聚集的tau神经纤维缠结(NFTs)的密度和分布,这是阿尔茨海默病的主要标志物之一。Tauvid也是FDA批准用于帮助对大脑中的tau病理进行成像的首款药物。
2.杨森CD38组合疗法达到Ⅲ期主要终点。Genmab公司与杨森共同开发的CD38抗体daratumumab,在联合环磷酰胺、硼替佐米和地塞米松(CyBorD)治疗新确诊免疫球蛋白轻链型淀粉样变性患者的Ⅲ期临床ANDROMEDA中,达到血液学完全缓解率的主要终点。388例患者接受CyBorD单独治疗,或daratumumab联合CyBorD的治疗,接受联合疗法治疗的患者血液学完全缓解率达到了53.3%,而单用CyBorD治疗的患者比例仅为18.1%。
3.瑞德西韦/IL-6抑制剂组合启动COVID-19Ⅲ期临床。基因泰克(Genentech)公司IL-6抗体Actemra(tocilizumab)联合吉利德抗病毒药物瑞德西韦将启动全球Ⅲ期临床用于治疗严重新冠肺炎住院患者。该研究预计在6月份注册450例患者。Actemra是基因泰克的一款已获批治疗类风湿性关节炎的IL-6单抗,目前也正在Ⅲ期临床中评估单药治疗COVID-19患者的效果。据悉,该试验已完成患者注册,预计在今年夏天获得试验结果。
4.Iovance公布TIL细胞疗法关键性队列数据。Iovance公司第二代TIL疗法lifileucel治疗晚期黑色素瘤的Ⅱ期临床C-144-01获积极结果。汇集队列2和队列4最新数据的分析表明,一次注射lifileucel,能够在接受过PD-1抑制剂和BRAF/MEK靶向疗法的难治性患者中达到34.3%的总缓解率,疾病控制率达到76.1%。在中位随访时间为10.6个月时,中位缓解持续时间尚未达到。Iovance公司将在ASCO年会上公布队列2患者的详细数据。该公司预计今年向FDA递交生物制品许可申请。
5.BMS联手Repare开发创新“合成致死”精准疗法。致力于利用CRISPR基因编辑技术,筛选“合成致死”精准疗法的Repare Therapeutics公司宣布,拟与百时美施贵宝合作开发创新“合成致死”精准疗法。根据协议,两家公司将利用Repare公司的SNIPRx平台共同发现多个“合成致死”精准肿瘤靶点,用于候选药物的开发;BMS将获合作产品全球独家开发和商业化权益;Repare将获6500万美元的前期付款、可能高达约30亿美元的里程碑款项以及合作产品的销售分成。
6.GSK明年拟生产10亿剂佐剂支持COVID-19疫苗开发。葛兰素史克(GSK)宣布计划在2021年生产10亿剂大流行病疫苗佐剂系统,用于支持多项使用佐剂的新冠病毒候选疫苗的开发。GSK的佐剂技术能够降低每一剂疫苗中的病毒蛋白数量,从而能够生产更多剂疫苗,保护更多人。而且,佐剂疫苗能够帮助激发更强、更持久的免疫反应。目前,GSK已与赛诺菲、昆士兰大学以及三叶草生物制药达成研发协议,提供佐剂支持这些机构的新冠疫苗开发。
医药热点
1.纽约新冠病毒主要由欧洲和美洲输入。为了确定新冠病毒在纽约市区的早期快速传播事件,美国西奈山伊坎医学院研究人员对在西奈山卫生系统(Mount Sinai Health System)寻求治疗的新冠患者病毒进行了基因测序。对84个不同的SARS-CoV-2基因组的系统发育分析表明,纽约的新冠病毒主要来自欧洲和美国其他地区的多个相互独立的引入,该病原是从中国直接引入的证据非常有限。此外,研究者还发现了SARS-CoV-2的社区传播证据。研究成果发表于国际权威期刊《科学》杂志上。
2.一新冠确诊病例治愈出院3个月后复阳。5月30日下午,安徽省合肥市网宣办官方微博发布消息,合肥市高新区某公司员工魏某某(女,24岁),系合肥市已公布第105号新冠肺炎确诊病例,治愈出院后严格按规定落实“三段式”管理措施,期间数次核酸检测结果均为阴性。5月26日下午,该员工进行第3个月健康随访复查,被医院查出复阳。相关部门已对当事人进行隔离观察,同时对其密切接触者进行集中隔离和核酸检测。截至目前,所有密切接触者及扩大筛查人员核酸检测结果均为阴性。
股市资讯
【科伦药业】(1)公司将所持四川科伦药研30%的股权转让给员工持股平台用于实施员工股权激励;(2)公司同意分别以1元的对价将所持子公司科伦博泰和科伦药研各10%的股份/股权转让给王晶翼先生;(3)公司控股子公司伊犁川宁生物拟整体变更为股份有限公司。
【舒泰神】公司及全资子公司德丰瑞于近日取得了西班牙和印度药品和医疗器械管理局关于授权临床试验申请的决定文件,批准BDB-001注射液在西班牙开展治疗进展期重型 COVID-19的多中心、开放、随机平行对照的II期临床试验。
【药明康德】公司近日收到中国证券会出具的关于公司提交的《上市公司非公开发行新股核准》行政许可申请材料和《股份有限公司境外增发股份(包括普通股、优先股等各类股票及股票的派生形式)》行政许可申请材料的《中国证监会行政许可申请受理单》。
审评动向
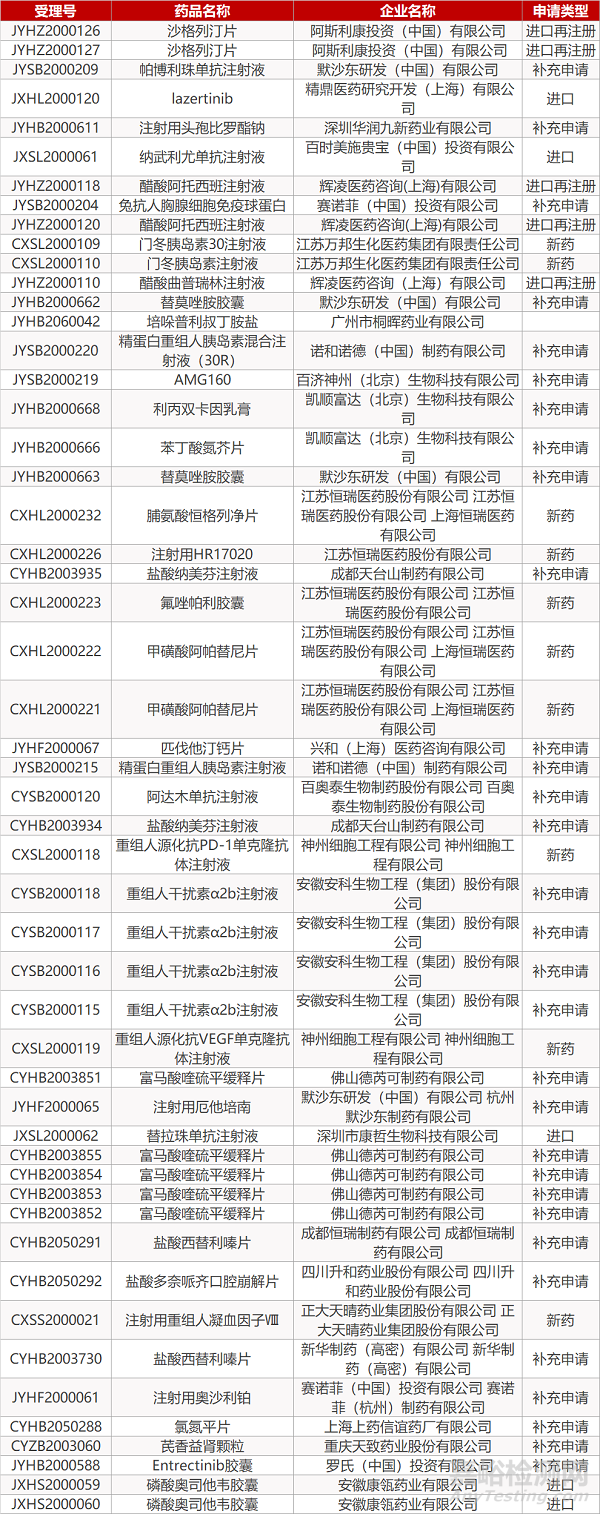
1. CDE最新受理情况(05月31日)
- The End -

来源:药研发


