您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2025-06-17 19:23
在医疗器械领域,注册质量管理体系核查至关重要。其旨在全面评估企业产品从设计开发到生产的质量把控能力,确保医疗器械的安全、有效与合规,规范行业秩序,促进产业高质量发展。关于注册质量体系核查,小编总结内容如下:
注册质量体系核查的范围
申请人应当在申请注册时提交与产品研制、生产有关的质量管理体系相关资料,受理注册申请的药品监督管理部门在产品技术审评时认为有必要对质量管理体系进行核查的,应当组织开展质量管理体系核查,并可以根据需要调阅原始资料。
范围
按照医疗器械生产质量管理规范的要求开展质量管理体系核查。
重点
对申请人是否按照医疗器械生产质量管理规范的要求建立与产品相适应的质量管理体系,以及与产品研制、生产有关的设计开发、生产管理、质量控制等内容进行核查。
在核查过程中,应当同时对检验用产品和临床试验产品的真实性进行核查,重点查阅设计开发过程相关记录,以及检验用产品和临床试验产品生产过程的相关记录。
提交自检报告的,应当对申请人、备案人或者受托机构研制过程中的检验能力、检验结果等进行重点核查。
来源:《医疗器械注册与备案管理办法》
注册质量体系核查的必要情况判断
判断依据
本次申请注册产品与既往已通过核查产品工作原理、预期用途,并且具有基本相同的结构组成、生产条件、生产工艺的对比情况等,确定是否现场检查以及检查内容,避免重复检查。
检查内容酌情调整
产品具有相同工作原理、预期用途,并且具有基本相同的结构组成、生产条件、生产工艺的,现场检查时,可仅对企业检验用产品和临床试验用产品的真实性进行核查,重点查阅设计开发过程实施策划和控制的相关记录,用于产品生产的采购记录、生产记录、检验记录和留样观察记录等。
境内三类核查的流程和时限
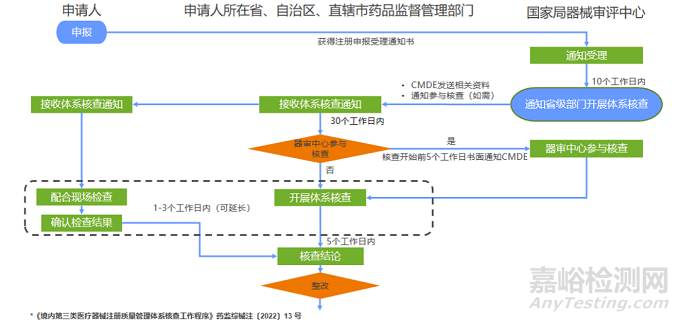
境内三类核查整改的流程和时限
现场核查
检查方案
现场检查方案内容包括:企业基本情况、检查品种、检查目的、检查依据、现场检查时间、日程安排、检查项目、检查组成员及分工等。
检查时间
般为1至3天,如3天仍不能完成检查的,可适当延长时间。
检查组
检查组应当由2名以上(含2名)检查员组成,企业所在的市级药品监督管理部门可派1名观察员参加现场检查。必要时,药品监督管理部门可邀请有关专家参加现场检查。对于提交自检报告的,检查时应当选派熟悉检验人员参与检查。
组长负责制
检查组长负责组织召开现场检查首次会议、末次会议以及检查组内部会议,负责现场检查资料汇总,审定现场检查结论。
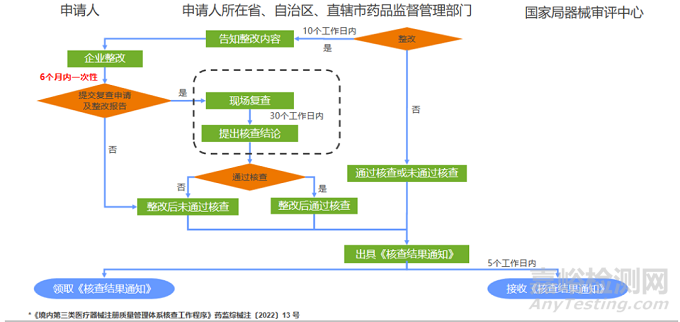
整改结论
通过检查
现场核查未发现申请人存在不符合项目的。
未通过检查
现场核查发现申请人存在真实性问题。
现场核查未发现真实性问题,但发现申请人存在关键项目3项(含)以上或者一般项目10项(含)以上不符合要求的。
申请人拒绝接受质是管理体系现场检查的。
整改后复查
现场核查未发现真实性问题,发现申请人存在关键项目3项(不含)以下且一般项目10项(不含)以下不符合要求的,建议结论为“整改后复查”。
【核查结论为“整改后复查”的申请人应当在注册核查结束后6个月内完成整改并向原核查部门一次性提交整改报告,必要时核查部门可开展现场复查。】
整改后通过核查
全部项目整改符合要求的,建议结论为“整改后通过核查”。
整改后未通过核查
对于规定时限内未能提交整改报告或者复查仍存在不符合项目的。

来源:Internet


