您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-05-27 08:42
近年来,我国的生物医药产业获得了蓬勃发展。制药行业也由仿制向创新逐步过渡。生物药的研发是一个投资周期较长的过程,ICH Q10《药品质量体系》将药品的全生命周期分为药品研发、技术转移、商业生产和产品终止四个阶段。笔者结合本人多年的工作经验,对以生物药的技术转移为例进行简单分享,以期为更多的制药同仁在工作中提供启示和帮助。
一、技术转移的定义及法规
1.1 国外关于技术转移的法规及指导原则
1.1.1 世界卫生组织(World Health Organization,WHO) 第961 号技术报告
WHO 第961 号技术报告于2011 年生效,附件7《制药产品生产的技术转移指南》中将技术转移定义为:控制研发方和生产方,或两个生产场所之间所有工艺及其文件和专业技术转移的逻辑程序;并对技术转移的组织和管理,工艺、包装、清洁转移,分析方法转移,厂房设施和设备,文件以及确认与验证等方面做了规定。同时指出,技术转移可出现在产品生命周期的各个阶段,从研发、放大、生产、成品上市,直至上市批准后。
2020 年12 月,WHO 发布《制药产品生产的技术转移指南》修订稿第一轮征求意见,于2021年5 月发起第二轮征求意见( 以下简称“2021 年修订稿”) 。2021 年修订稿指出,产品转移可能发生在开发、临床研究或全面商业化和商业批量生产过程中,作为产品生命周期管理的一个组成部分,应受到监管以实现“受控状态”和数据管理,并多次强调技术转移的严格程度应与相应的产品生命周期阶段相称,以及知识转移的重要性。该指南适用于临床研究用药品和已上市产品。
同时,定义技术转移成功的标准为:应证明可以常规化地按双方预定的标准生产出所转移的产品的工艺或方法。
1.1.2 国际制药工程协会(International Society for Pharmaceutical Engineering,ISPE) 操作指南
2003年,ISPE首先发布了有关“技术转移的良好操作指南(第1版)”,2018年11月更新至第3版。第3版指南将转移分为3种情况:分析方法的技术转移、原料药的技术转移和制剂的技术转移,并提供了一些必要的技术转移案例以及实用的文档模板工具,提出将技术转移按项目管理的方式进行并分为6个阶段:
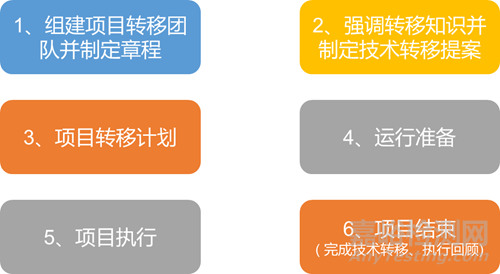
指南主要聚焦于如何去达到技术转移设定的目标,形成一个清晰的能被技术转移双方容易使用的流程,为技术转移成功、有效以及达到控制风险管理和经济效益之间的平衡设计了良好的工业规范。
1.1.3 美国注射剂协会(Parenteral Drug Association,PDA) 第65号技术报告
2014年8月,美国PDA发布第65号技术报告《Technology Transfer》,赋予技术转移更广阔的内涵并列举了技术转移的方式,包括从研发到商业生产(公司内)、从商业生产到商业生产(公司间)。从技术转移项目、技术转移过程、技术转移中质量风险运用3个方面对技术转移的理念和核心要点进行解析,从应用及案例分析等角度非常细致全面地阐述技术转移的各个环节及注意事项,是继WHO、ISPE 之后对技术转移的又一个重要指南。
PDA第65号技术报告强调技术转移中质量风险管理(Quality risk management,QRM) 工具的作用,列表说明技术转移每个阶段使用的QRM工具,并给出实际案例分析,对企业实施技术转移具有很好的借鉴意义。
1.1.4 国家药品监督管理局食品药品审核查验中心(Center for Food and Drug Inspection of NMPA,CFDI)
2021 年12 月,CFDI 正式发布了《药品注册核查要点与判定原则( 药学研制和生产现场)》(试行),首次将技术转移列入药品注册核查的要点内容。此举也对国内药物研发产生了重要的影响。

1.2 技术转移(Technology Transfer)
针对项目不同,转移活动可能发生在不同阶段。技术转移可能发生在药品上市申请之前,也可能发生在药品获批上市以后,可能是公司内部的转移,也可能是委托研发、委托生产或受托生产过程。
● 新产品从开发到生产的转移;
● 已上市产品在生产和检测场地内或场地间的技术转移。
本次笔者主要针对新产品从开发到生产阶段的技术转移进行阐述说明。
二、生物制品技术转移流程
2.1 技术转移流程
生物制品的技术流程通常可分为项目计划、转移准备、转移实施和项目总结。
此次笔者以抗体药物为例,简述其技术转移的整个流程。抗体药物工艺流程通常包括细胞株选择与构建、细胞培养与监测、抗体纯化、抗体药物制剂等环节,具体如下:
细胞复苏与传代→一级种子扩增→二级种子扩增→三级种子扩增→生产反应器培养→深层过程→亲和层析→低pH孵育→阳离子交换→阴离子交换→除病毒过滤→超滤浓缩、置换缓冲液→过滤(降低微生物负载)→原液(Drug Substance,DS)→制剂生产→制剂成品(DrugProduct,DP)→包装等。


需要注意的是,不同指导原则对于阶段的划分不同,不同阶段的转移要求内容的详尽度不同。
技术转移时由SU(转出方)提供所有相关文件给RU(接收方),由QA监管相关文件,包括但不限于:
● 项目实施计划;
● 常规的技术转移文件可包括:
● 批记录;
● 工艺计划物料清单(BOM);
● 技术参数及质量标准;
● 稳定性概述;
● 杂质/相关物质及其限度、微生物/病毒(含病毒清除、灭活)等情况;
● 起始物料及物料MSDS;
● 分析方法相关文件;
● 原液DS制备的主文件及辅料相关文件;
● 工艺流程图(应提供上游工艺、下游工艺、设备、临床适应症和制剂DP配方的选择依据);
● 生产商确认;
● 培训方案;
● 工艺验证方案/计划和报告;
● 生产工艺、质量控制等开展的各类风险评估;
同时还应考虑法规方面,包括注册申报需求相关文件、现场核查时备查文件等。
2.2 技术转移准备
技术转移准备环节中的差距分析和风险评估是重要的组成部分,也是企业在实施过程中最困难的环节。
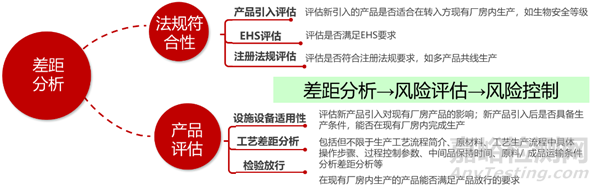
差距分析(Gap Analysis)是对产品在转出方生产要求与转入方目前状态间的能力评估,是技术转移风险评估的过程;在评估过程中应运用风险管理工具并结合公司质量管理系统的相关要求。转入方引入新产品的风险评估,通常可主要包含法规符合性和产品评估两方面的内容。法规符合性包括产品引入评估、EHS评估、注册法规评估等部分;产品评估通常涵盖设施设备适用性、工艺差距分析、检验放行等。
风险评估(Risk Assessment)可基于“人员(接收方现有人员配置、技能是否满足要求)”、“设备(厂房设施、设备是否满足转移产品的需求)”、“物料(物料是否需变更,是否有新增供应商)”、“工艺(设备或批量差异是否引起工艺变化)”、“法规(是否符合GMP及注册法规要求)”、“检测(接收方检测条件是否满足需求)”进行。
2.3 技术转移实施
技术转移实施时应当具备书面的技术转移计划,通常包括但不限于以下内容:
● 技术转移的目的与范围;
● 转移团队基本信息机职责,包括接收方(RU)和转出方(SU);
● 转移产品概述;
● 资源和预算;
● 风险降低计划;
● 技术转移策略;
● 里程碑事项及时间表;
● 交付成果及验收标准、文件要求;
根据差异评估结果及改进措施/行动项的实施,进行技术转移活动前需完成的活动,通常需形成一个审核确认表,以评估转人入方是否已经具备了进行技术转移的状态条件,可能包括但不限于以下内容:厂房设施设备的调试和确认、物料的评估或替换、 工艺控制策略的调整、分析方法的调整、生产流程的调整等。
例如在技术转移过程中,通过原辅料对比,确认RU方与SU方原辅料等级、规格等方面的一致性,并对商业化阶段物料供应风险进行评价,如部分物料存在供应保障风险,建议在Ⅲ期临床前或商业化生产前替换为国产物料或增加合格供应商。结合上游、下游、制剂生产等各个主要工艺环节,确保RU方原辅料采购自经审计的合格供应商,且与供应商签订质量协议,取得使用授权。应建立耗材/供应商(特别是一次性耗材)管理制度,对于直接接触产品的耗材,还应当考虑进行相应的生物相容性研究。
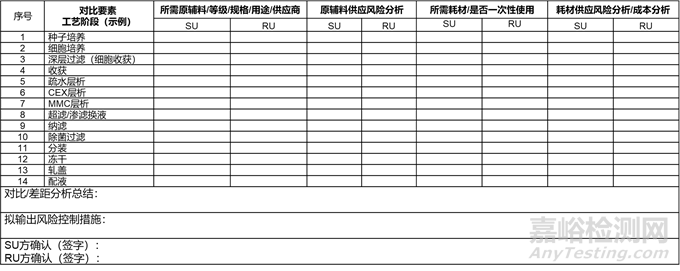
对于工艺流程、工艺设备、产品取样、人员培训等内容,可以参照上表并按照要素展开。
2.4 技术转移总结
技术转移结束后,应当及时进行技术转移总结,包括技术转移方案中的各个方面,并对项目进行的主要任务和里程碑进行梳理汇总,形成技术转移最终报告。
以公司研发的一款单抗药物为例,对转移前后进行可比性研究,主要包括:
● 转移前后的工艺参数均在操作范围内;
● 层析图谱与转移前一致;
● 原液的质量属性与转移前进行比对,糖型、纯度、鉴别(肽图)、蛋白质含量等检测图谱的峰形与转移前一致,转移后产品纯度项在转移前±3SD范围内,且部分纯度项高于转移前,两者质量可比。
…….
以上结果证明转移成功。
技术转移结果的评估如下图所示:
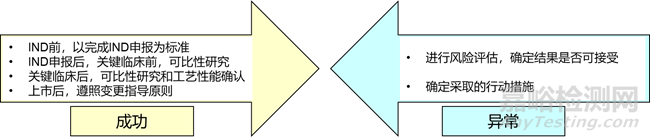
对技术转移活动成功经验进行总结,明确需改进的方面,以及后续双方需要继续采取的活动,确定责任人及时限。
2.5 QRM在技术转移用的运用
QRM(Quality Risk Management)的理念和措施应贯穿于药品的整个生命周期。风险管理应该被用于整个技术转移项目的过程中。风险评估和差距分析共同构成了技术转移项目计划的基础。而生物制品研发设计使用的方法,其中对工艺输入(物料属性和工艺参数)与关键质量属性(CQAs)之间的关系进行了评估和描述,可以用于TTP 管理。技术转移项目中,QRM 的应用应确保:
①能够识别潜在影响CQA 的变化根源;
②能确保合适的风险降低策略和控制手段己经被整合至生产工艺中,可以减小和控制对患者的潜在产品质量风险;
③所有关键单元操作和相关的质量和关键参数必须加以控制,以确保最终药品的质量得到支持。
三、技术转移常见问题
结合中国国内药品监管机构在多次核查和现场检查中的总结,目前制药企业在技术转移过程中仍然存在一定的问题,主要体现在分析方法转移、生产技术转移、清洁方法转移以及转移培训等方面。

四、总结
技术转移作为药品生命周期中的重要环节,对于产品的安全性、有效性和质量可控性起到了重要的影响。目前,国内很多药企尚未建立起完善的制度和体系文件去指导如何实施药品的技术转移。秉承“为人民做好药”的责任感和使命感,制药企业应当始终贯彻“质量源于设计”的理念,建立基于风险和科学的流程,实现产品的全生命周期管理。

来源:注册圈


