今日头条
康泰脊髓灰质炎疫苗报产。康泰生物旗下民海生物研发的Sabin株脊髓灰质炎灭活疫苗(Vero细胞)上市申请获NMPA受理,用于预防由脊髓灰质炎1型、2型和3型病毒感染导致的脊髓灰质炎。与传统的脊髓灰质炎灭活疫苗和脊髓灰质炎减毒活疫苗相比,Sabin株脊髓灰质炎灭活疫苗(Vero细胞)结合了这两种传统疫苗安全的优势,可用于预防脊髓灰质炎病毒所引起的急性传染病。
国内药讯
1.BMS促红剂中国报sNDA。百时美施贵宝血红细胞成熟剂罗特西普(Reblozyl)新适应症上市申请获CDE受理,推测适应症为“骨髓增生异常综合征(MDS)”。公布在ASCO2023年会上的III期COMMANDS研究数据显示,与重组人促红素组相比,Reblozyl治疗组24周时患者实现摆脱红细胞输注12周(RBC-TI)且平均血红蛋白(Hb)水平增加≥1.5g/dL的比例更高(58.5%vs31.2%,p<0.0001)。此前,该新药已获CDE批准用于治疗β-地中海贫血患者。
2.石药EGFR单抗启动III期临床。石药集团EGFR单抗becotatug(JMT101)登记启动一项III期临床,拟评估JMT101联合奥希替尼对比顺铂联合培美曲塞一线治疗携带EGFR 20号外显子插入突变晚期非小细胞肺癌(NSCLC)的疗效和安全性。该项研究由中山大学肿瘤防治中心张力博士牵头开展。在II期BECOME研究中,在ITT人群中,IRC评估的JMT101联合奥希替尼确认的客观缓解率(cORR)为50.0%,疾病控制率(DCR)为79.5%。
3.康方湿疹单抗启动Ⅲ期临床。康方生物IL4-Rα单抗AK120注射液登记启动一项Ⅲ期临床,拟评估治疗中重度特应性皮炎(AD)患者的有效性与安全性。AK120可通过与IL-4Rα特异性结合以阻断IL-4与IL-13介导的信号通路,抑制相关免疫炎症反应的发生与发展。在Ⅰ期临床中,AK120治疗后湿疹面积和严重程度指数(EASI)评分明显改善,患者整体评分(IGA)0或1和降低≥2的比例增加。
4.诺诚健华BTK抑制剂启动III期临床。诺诚健华BTK抑制剂奥布替尼在ClinicalTrials.gov上登记注册一项III期临床(NCT06363994),拟评估奥布替尼联合苯达莫司汀+利妥昔单抗对比苯达莫司汀+利妥昔单抗用于未经治疗的套细胞淋巴瘤(MCL)患者的疗效与安全性。去年5月,该新药在Blood子刊上发表了治疗R/R MCL的长期疗效数据:中位随访为23.8个月时,奥布替尼经IRC评估的总缓解率(ORR)达到81.1%,其中完全缓解(CR)率为27.4%。
5.同源康抗耐药肿瘤药获批临床。同源康医药新型小分子YAP/TEAD抑制剂TYK-01054获FDA批准开展新药研究。YAP、TAZ和TEAD是Hippo通路的下游效应子;YAP/TAZ/TEAD信号传导的失调,可能是患者对各种靶向疗法和化疗产生内在和获得性耐药的主要机制。TYK-01054能结合TEAD并抑制了TEAD下游基因的表达,有望为耐药性肿瘤患者提供新的治疗选择。在国内,同源康已与NMPA进行了Pre-IND沟通交流,预计近期将提交TYK-01054的IND申请。
国际药讯
1.AZ哮喘单抗获批用于低龄儿童。阿斯利康IL-5Rα单抗Fasenra(benralizumab)获FDA批准扩大适用人群,用于6至11岁嗜酸性粒细胞表型严重哮喘患者的附加维持治疗。Benralizumab可直接与嗜酸性粒细胞上的IL-5受体α结合,并吸引自然杀伤细胞通过细胞凋亡(程序性细胞死亡)诱导嗜酸性粒细胞快速且几乎完全耗尽。2017年11月,benralizumab首次在美国获批上市,用于12岁及以上的重症嗜酸性粒细胞性哮喘患者的附加维持治疗。
2.艾伯维偏头痛新药Ⅲ期临床积极。艾伯维CGRP拮抗剂Qulipta(atogepant)用于预防慢性或发作性偏头痛患者疾病发作的Ⅲ期扩展研究结果积极。数据显示,atogepant治疗使患者每月偏头痛天数平均减少8.5天,且疗效维持长达48周;患者每月偏头痛天数减少≥50%的患者比例达到70%;atogepant总体安全性良好。去年4月,Qulipta用于上市适应症的sNDA申请已获FDA批准。
3.Lipocine公司减脂增肌新药Ⅱ期临床积极。Lipocine公司减脂增肌口服疗法LPCN 2401在治疗肥胖或超重并患有体重相关合并症患者的Ⅱ期临床获积极结果。在36周时,与安慰剂相比,LPCN 2401治疗患者的肌肉量(LM)增加4.4%,脂肪量(FM)减少6.7%;同时,患者的腹部脂肪(AF)降低4.1%,骨矿物质含量(BMC)增加2.8%。此外,药物治疗对患者的体重没有影响,患者的脂肪减少被其无脂体重增加所抵消。
4.Eliem公司购进自免病抗体。Eliem公司宣布完成1.2亿美元的融资,以用于支持收购Tenet Medicines公司,并推动Tenet Medicines主打候选抗体药物TNT119的开发,用于治疗多种自身免疫疾病。TNT119旨在靶向和消耗产生自身抗体的CD19阳性B细胞,为系统性红斑狼疮的潜在治疗提供一种新方法。完成收购后,Eliem公司预计下半年将启动TNT119用于治疗系统性红斑狼疮和免疫性血小板减少症的Ⅱ期临床。
5.诺华引进一款前列腺肿瘤PROTAC。诺华与Arvinas公司达成了合作许可协议,获得后者第二代雄激素受体(AR)降解剂ARV-766的全球临床开发和商业化权益,应用于前列腺癌的治疗。诺华还拥有Arvinas公司临床前AR-V7项目相关的所有研究、开发、制造和商业化授权。根据协议,Arvinas将获得1.5亿美元的预付款、高达10.1亿美元的开发、监管和商业里程碑后期付款,以及ARV-766的分层版税。
6.基因泰克终止超30亿美元合作。Adaptimmune公司宣布,已终止与基因泰克于2021年达成的超过30亿美元的战略合作。2021年9月,基因泰克与Adaptimmune公司达成了研发和许可协议:Adaptimmune公司将利用诱导多能干细胞(iPSC)衍生同种异体细胞技术平台来生成T细胞,基因泰克公司将负责设计T细胞受体(TCR),两家公司将联合开发靶向5种癌症相关靶点的同种异体T细胞疗法,以及个体化同种异体T细胞疗法。
医药热点
1.香港特区查获日本福岛等受管地食品。4月11日,香港特区政府发布新闻公报,香港特区食物环境卫生署食物安全中心在检查日本进口食品时,发现其中有来自日本受管制县份的蔬菜和水产品,产品没有附上辐射证明书及出口商证明书。有关进口商涉嫌违反相关《食物安全命令》,涉事产品已被封存,没有流出市面。食安中心正跟进该事件。
2.北京儿童医院开出首张“先行先试”罕见病药品处方。4月11日,北京儿童医院为软骨发育不全患儿开出了由北京市罕见病药品保障先行区引进的“先行先试”罕见病药品的首张处方。该处方药品名为伏索利肽,是全球首款治疗儿童软骨发育不全的罕见病药品,也是北京罕见病药品保障先行区中首款“先行先试”的罕见病药品。
3.成都明确医院要配置“医保员”。4月8日,《成都市医保员体系建设管理暂行办法》公布并实施。办法明确,定点医疗机构应独立设置医保科,三级医院医保科原则上应作为一级科室设置。床位数1000以下的医疗机构,建议医保员配置不少于3人;床位数1000以上的医疗机构,建议配置不少于10名医保员。医保员负责督导开展本科室(部门)医保费用审核和自查,发现其他工作人员或病人的违法违规行为报告科室(部门)负责人并及时提醒制止,涉嫌欺诈骗保的,同步报告医院医保管理机构。
评审动态
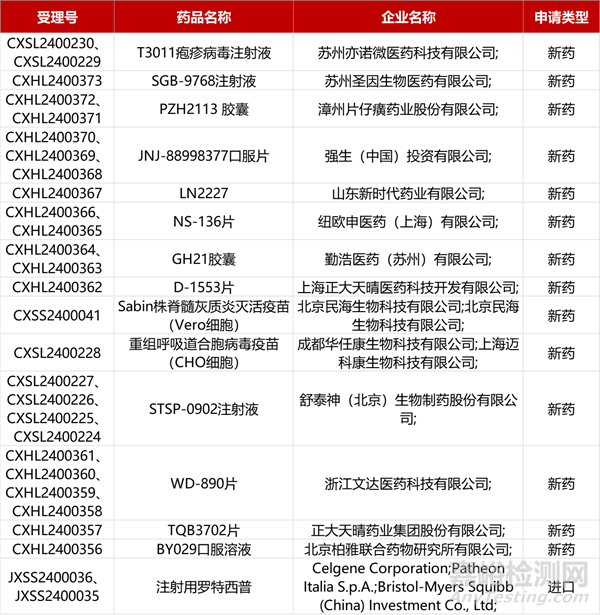
1. CDE新药受理情况(04月13日)
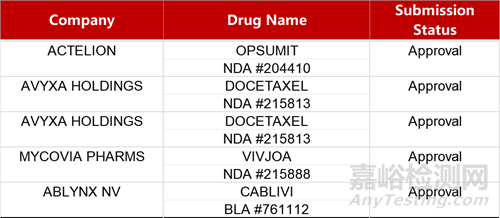
2. FDA新药获批情况(北美04月11日)