加拿大医疗器材2019年市场规模约68亿美元,于全球医疗器材市场排名第九,在八大工业国中排名第四,仅次于美国、德国及法国,在全球医疗器材市场上占有重要地位。
根据加拿大统计局数据显示,2020年加拿大医疗器材(含防疫用品)之进口总额达130亿2,301万美元,较上年大幅成长45.98%;主要进口来源国及占比依序为中国(32.81%)、美国(32.64%)、墨西哥(5.27%)、德国(4.10%)、马来西亚(2.71%)、爱尔兰(2.42%)、日本(1.88%)、英国(1.43%)、越南(1.26%)和新加坡(1.19%)。根据中国海关总署进出数据显示,截止2021年,中国出口海外的医疗器械总出口额为847.3亿美元,同比下降31.5%。美国仍然是中国医疗器械的最大出口国,中国出口美医疗器械总共211亿美元,占全球出口总额的24.9%。其次出口金额最多的地区分别是德国,英国,日本,中国香港,荷兰,印度,加拿大,法国。据易讯数据平台的消息,2023年全球医疗器械贸易涉及到:155 个目的国/地区、167952 次交易次数、8108个采购商、10123 个供应商。
加拿大按产品风险程度将医疗器械分为四个(I, II, III, IV)风险等级,所有风险等级的医疗器械在加拿大销售,都必须申请医疗器械营业许可证Medical Device Establishment Licence(MDEL),而II类, III类和IV类的医疗器械则需要申请医疗器械注册证New Medical Device Licence(NMDL), I类的医疗器械豁免医疗器械注册证。
一 、医疗器械营业许可证(MDEL)
1、谁需要申请MDEL?
根据加拿大法规要求,向加拿大进口医疗器械,或在加拿大销售医疗器械的公司都必须申请医疗器械营业许可证(MDEL),
以下几种情况可以豁免:
(1)零售商,
(2)医疗保健单位,
(3)在加拿大销售自己名下取得医疗器械注册证的II类, III类和IV类的医疗器械的制造商(注:如果是销售别的公司名下取得医疗器械注册证的II类, III类和IV类的医疗器械的制造商,也必须申请MDEL。
(4)I类医疗器械的制造商通过持有医疗器械营业许可证(MDEL)的公司在加拿大销售医疗器械,可以不用申请MDEL。
申请者向加拿大监管机构提交 MDEL申请表格,加拿大监管机构在约120天左右完成审核,批复MDEL。
2、MDEL的有效期与年度许可证审查(ALR)
MDEL没有注明有效期,加拿大卫生部每年 12 月将 ALR(年度许可证审查) 包发送给存档的机构联系人,您必须尽快在每年的 4 月 1 日之前通过电子邮件发送您完成的 ALR申请包,即使信息没有更改,并交付适用的申请费用,MDEL才能继续有效,否则MDEL会被取消。MDEL被取消后,在加拿大的器械销售活动则会被禁止。MDEL被取消,MDEL持有者必须重新申请并交费,才能重新取得新的MDEL。
更改通知:
根据条例第48条,当更改许可证持有人的名称或地址,或更改联系人的名字,职位,和电话号码时,许可证持有人须在15天内通知加拿大卫生部。这些信息要发到加拿大卫生部的MDEL负责部门,之后,会发放一个更新的MDEL许可证;
3、医疗器械合规周期和费用
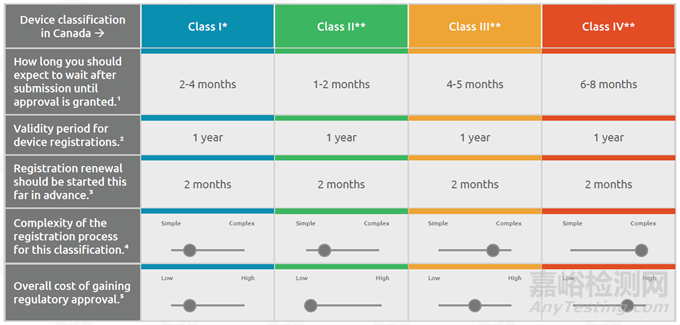
关于医疗器械企业需要出口到加拿大,合规需要的周期、费用以及复杂程度的概况请见表。
合规周期
收费要求和收费标准:
新申请和年度审核申请都是要交费的,而在这期间,申请MDEL更改,可以不用交费的。
对于新持有MDEL,还没超过一日历年的MDEL持有者,费用可以延迟至第一日历年年底。
MDEL 的当前费用为 5,060 美元。
如果您符合小型企业的资格,您有资格获得 25% 的费用减免。目前注册小型企业应支付的费用为 3,795 美元。
小型企业的资格认定标准是:
员工人数少于 100 人的任何企业,包括其关联公司,或年总收入在 30,000 至 500 万加元之间。申请人在提交 ALR 申请之前必须在加拿大卫生部注册为小型企业。您必须通过药品和医疗器械小型企业申请门户完成注册。
请注意,公司的小型企业身份在注册后 1 年到期。
如果您之前在我们这里注册为小型企业,并且您仍然符合定义,则在提交 ALR 申请之前,您需要确保身份有效或更新。
如果您的唯一标识符自上次注册以来发生了变化,您还需要重新注册。
如果您在提交 2024 年 ALR 申请时不再持有小型企业身份,我们将开具全额费用的发票。
一旦开具,全额费用金额的发票将不会被重新访问。无论您的小型企业状态未来发生任何变化,它仍将支付。
请注意,小企业注册和续签过程最多可能需要 2 周时间。尽早开始以确保在提交 ALR 申请之前完成它非常重要。
4、新医疗器械注册New Medical Device Licence (NMDL)
按加拿大医疗器械法规,II类, III类和IV类的医疗器械则需要申请医疗器械注册证New Medical Device Licence(NMDL), I类的医疗器械豁免医疗器械注册证。
其风险等级的划分原则和方法类似于欧盟CE认证,都是根据产品的与人体接触程度, 接触时间,有源.无源等情况进行分类.
新医疗器械注册需要提供的资料根据产品风险等级不同,要求提供的资料也不同,II类器械需要的资料相对简单。
新医疗器械注册需要提供质量管理体系证书,从2019年一月一日起,强制要求要有MDSAP证书。
与医疗器械营业许可证(MDEL)的申请一样,新医疗器械注册证(NMDL)的 申请是需要付费和年费的.费用的交付也同样样是可以延期和减免的.费用的减免额根据公司在过去一年里产品在加拿大销售额来定。
医疗器械注册证也是需要年度收费的, 每年8月份,加拿大卫生部会给持有II,III,IV类产品注册证的制造商发出年度注册单证更新的通知和相 关资料.制造商要按照收到的通知和相关资料要求,缴费和提交要求的资料.