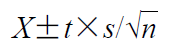摘要
外用药物制剂具有复杂的药物递送途径,通常局部起效,辅料成分复杂,处方组成和制备工艺参数的微小差异就有可能导致产品不同的质量特性,从而影响药物的安全性和有效性。体外释放试验(IVRT)可用于表征一个产品批次的稳态药物释放速率,表征某些工艺、配方和/或生产的变更对药品的影响,在某些情况下,可用于论证产品批量放大或上市后变更的等效性。尽管IVRT不能模拟体内性能情况,但其仍是一项关键质量属性,应订入产品放行和货架期质量标准。本文参考国内外相关技术指导原则及文献,对皮肤外用制剂的IVRT研究技术要求概况进行综述,期望为业内人士提供参考。
关键词
外用药物制剂;经皮给药;体外释放试验;一致性评价
外用药物制剂相较于口服、注射剂等给药方式具有许多优势:①避免肝脏的首过效应;②药物吸收不受胃肠道内pH值、食物及其他药物等因素的影响;③具有控释效果;④维持恒定的有效血药浓度,避免因吸收过快产生血药浓度过高引起不良反应;⑤给药方便,安全性高,患者顺应性好[1]。已成为现代医学中重要的组成部分,同时具有较好的发展前景。
外用药物制剂是一类发挥局部或全身治疗作用的制剂,剂型包括软膏剂、乳膏剂、凝胶剂、散剂、乳剂、糊剂、混悬剂、喷雾剂、气雾剂、溶液和其他半固体和/或液体剂型[2-3]。其中,乳膏剂、软膏剂及凝胶剂处方组成复杂,多为半固体制剂,涉及油相、水相及油包水/水包油等热力学不稳定体系,使用多种不同性质的辅料(油相、水相、表面活性剂、矫味剂、清凉剂、抑菌剂等)。相对于传统的注射剂和片剂等剂型,其制备和稳定性过程中的动力学和热力学影响因素众多,在设计、制造、储存和运输等多个环节均存在较大的挑战。
对于该类制剂,药物在体外释放的速率和程度是其性能的综合体现,主要用于产品的药学质量控制,也可用于药品开发过程中处方工艺的筛选研究。虽然不能根据体外释放试验(IVRT)释放速率的差异预测体内生物利用度的变化[4],但其具有潜在反应制剂中药物生物学特性变化的能力,而这种特性的变化可能与以下因素有关,如处方中的活性或非活性组分、制剂的物理化学特性、生产工艺的变更、运输和储存条件、产品的放置时间长短和其他对终产品质量特性具有关键作用的因素等[5]。
基于制剂的定性(Q1)、定量(Q2)以及物理化学和结构特性(Q3),Shah等[6]于2015年提出了外用药物分类系统(TCS),该系统将皮肤外用制剂分为4类。如果仿制药和参比制剂(RLD)之间的Q1、Q2和Q3都相同,则仿制药可能实现生物等效性豁免(TCS1类)。在TCS理念中,某些辅料可能在药物传递、发挥作用和随之产生的疗效中起到积极作用。但总体来看,许多辅料是惰性的。如果仿制药和RLD之间Q1、Q2不同,但在充分评估辅料的安全性和功效后,可进行IVRT评价,若仿制药和RLD一致,则可以实现生物等效性豁免(TCS3类)。
欧洲药品管理局(EMA)允许通过证明Q3及IVRT的等效性,用于支持单相的溶液剂、凝胶剂、软膏剂等简单的配方制剂与参比制剂相比的治疗等效性,以代替等效性临床试验[7]。美国食品药品监督管理局(FDA)要求,对于外用半固体制剂,如果仿制药的Q3与对照标准制剂相同,仅需提供有限的其他证据(体外、in silico和/或体内),即可支持生物等效性论证[8],如根据2022年10月之后FDA更新的特定药品指南,在Q1、Q2和Q3一致的基础上,阿达帕林凝胶[9]、乳酸铵乳膏[10]、盐酸布替萘芬乳膏[11]、磷酸克林霉素凝胶[12]和酒石酸溴莫尼定凝胶[13]等仅需要论证IVRT等效,即可豁免临床等效性研究。日本医药食品局(PMDA)可通过IVRT研究对已上市半固体制剂和贴剂的B水平处方变更进行论证[14-15]。
综上可知,IVRT研究在外用药物制剂处方开发、生物等效性论证以及上市后变更中的重要性,因此对IVRT研究进行合理设计,确保其结果准确可靠十分重要。虽然FDA、EMA和PMDA均有发布关于IVRT研究的相关指南,但目前国内暂无统一的技术要求规范,且各国技术要求亦不统一,因此本文对IVRT研究相关技术要求概况进行总结,期望为业内人士提供参考。
1、国内外政策法规
在2018年国家药品监督管理局药品审评中心(CDE)发布的《新注册分类的皮肤外用仿制药的技术评价要求(征求意见稿)》中阐述可参照FDA SUPAC-SS指南[16]进行IVRT研究[17],但在2021年发布的《皮肤外用化学仿制药研究技术指导原则(试行)》中,建议参考FDA、EMA和PMDA相关指导原则开展相关研究工作。
在1997年FDA发布SUPAC-SS指南中首次对IVRT研究的相关参数及数据统计进行了阐述,包括上样量(300mg)、上样方式(闭环)、接收介质(水性缓冲液或水醇混合溶液)、合成膜、试验时长和取样点(至少5个取样点)等。2016年发布的《阿昔洛韦指南草案》[18]是第一份关于IVRT方法验证及接受标准的指南,但其部分参数(如线性与范围、专属性)的接受标准相对2022年10月FDA发布IVRT指南[3]较为宽松,目前已被FDA IVRT指南替代。2022年5月美国药典(USP)发布的《PF48(3)<1724>Semisolid drug products-performance tests》(以下简称USP<1724>)是现有国内外药典或指南中对IVRT的研究设计最为全面的法规指南[4],而FDA IVRT指南是专门阐述IVRT方法验证的相关指南。
2010年PMDA发布的《皮肤局部适用制剂(半固体制剂和贴剂)处方变更生物等效性研究指南》中对IVRT的研究设计和数据统计进行了阐述,但未说明IVRT各参数的可接受标准,亦未对方法验证内容进行说明[14]。
2018年EMA发布的《外用制剂质量和等效性指南草案》中亦对IVRT研究设计的相关参数进行了阐述,但未明确膜惰性的可接受标准、接收介质的组成,且在方法验证模块仅要求对区分力、精密度和耐用性进行评估[7]。
USP、FDA、EMA和PMDA对IVRT研究设计的技术要点如表1所示。
2、研究设计
2.1 设备
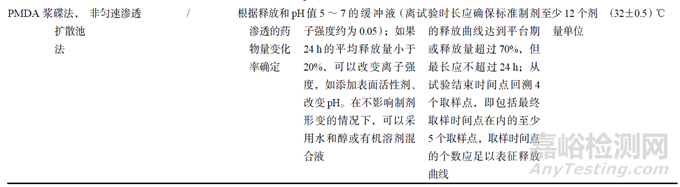
在IVRT研究中,可用的设备包括立式扩散池(VDC)、浸没池、USP装置4(流通池)、USP装置5(浆碟法)和浆式提取法[19]。其中,USP<1724>收载3种型号的VDC和2种型号的浸没池,PMDA可以采用VDC和浆碟法进行试验,EMA则没有明确说明。
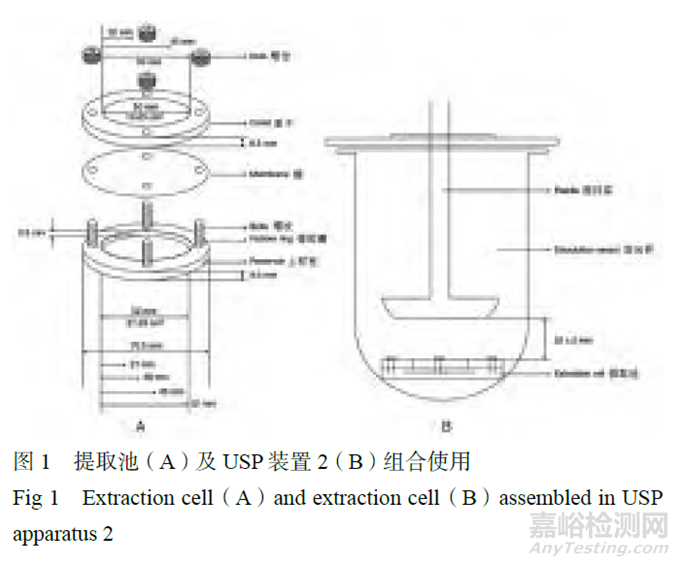
采用浆碟法时,不需要使用膜,因此需评估配方制剂溶解于接收介质的可能性[20]。浆式提取法是将欧洲药典(Ph. Eur)通则2.9.4中的提取池[21]与USP装置2组合使用(见图1)。虽然,也可以采用浸没池和流通池,目前国内外最常用的设备仍是VDC。
对于VDC,应根据实验室的风险承受能力和生产商的建议,在6~12个月的周期内对其进行再确认,确认内容包括但不限于:①确认供给室和接收室的孔口直径在规定值的±5%;②将所有组件组装后测定接收室的体积(精确到0.01mL),在实际计算过程中,采用测定的体积替代标称体积;③温度达到平衡后,确认膜表面温度的稳定性(在目标温度的±1℃范围内);④搅拌速率(通常在400~600r·min-1)。
在研究期间,应监控和报告实验室环境的温度和湿度。如适用,建议将温度控制在(21±2)℃、湿度控制在(50%±20%),避免将设备置于空调的通风口之下及暴露在直射阳光中。工作台要保持水平,建议倾斜度≤1°[22]。
2.2 合成膜
除浆碟法和浆式提取法外,其他类型的扩散池都需要采用一种膜来防止接收介质的搅拌对样品的机械扰动。在IVRT研究中,应选择具有适当的惰性和商业化的人工膜(如聚丙烯膜、聚醚砜膜、醋酸纤维素/尼龙混合酯膜、聚四氟乙烯膜、尼龙膜、聚砜膜等),但不宜采用生物膜或模拟生物膜开发的合成膜,因为这些膜可能会不恰当地影响药物释放的表观速率[4,16]。
EMA要求膜不应限制活性成分释放,PMDA要求膜呈非匀速渗透。通常情况下,商业化的合成膜有不同的厚度、孔径和物理性质,在IVRT研究中常用的膜厚度为70μm、孔径为0.45μm。对于脂溶性药物和亲脂性基质,可采用较大孔径的膜(如1.2μm),此外可能还需要将膜预先在适当的溶剂(如肉豆蔻酸异丙酯)中浸泡,以赋予膜亲脂性,提高药物从亲脂性基质中扩散的速率。
纤维素膜在制造时通常会添加增塑剂(如甘油),以保持膜的柔软性,使用前需去除增塑剂,如可在接受介质中浸泡30min[23]。在测试亲脂性基质的软膏时,使用预先浸泡的膜可以确保恒定的体外测试条件。此外,接收介质和配方制剂不应影响膜的物理完整性,Realdon等[24]使用不同类型的软膏,在进行IVRT研究期间和之后采用“气泡点(bubble point)”测试来评估膜的完整性,这个测试也可以帮助决定是否需要对膜进行浸泡处理。
膜的非匀速渗透,可通过采用不同规格制剂(如50%、100%和150%规格)获得不同的释放速率进行评估。对于FDA和EMA要求的惰性(不与活性成分结合)评估方法为:①在IVRT的整个研究期间,将膜放置到相应温度的接收液中进行孵化(例如,采用接收介质配制成待分析物的预期最高和最低浓度水平,在(32±1)℃下放置6h),至少重复测定3份;②并在相同条件下,同步考察3份不加膜的对照溶液,评估与膜吸附无关的药物损失;③如果实验结束时,接收液中药物的回收率在(100±5)%,可认为在该条件下膜是惰性的。
综上所述,在合成膜的选择过程中,应选择具有适当惰性和商业化的人工膜,不宜采用生物膜或模拟生物膜开发的合成膜。在方法开发过程中,应确定合成膜的种类(包括孔径大小、厚度、材质)、是否需要进行浸泡处理(如需浸泡处理,需确定浸泡介质和浸泡时间),同时需对膜的惰性和非匀速渗透情况进行评估。此外,部分膜有正反面,在试验过程中,应根据厂家说明书进行使用。
2.3 样品分析方法
通常,IVRT样品分析方法可基于成品的含量测定方法建立,但应确保所用的分析方法具有适当的灵敏度,以便可以定量测定从半固体制剂释放到接收介质中低浓度水平的药物量。建议将接收液的选择作为样品分析方法开发的初始步骤,其优点是:在使用接收液对不同膜评估前,可先采用选定的接收液对样品分析方法进行优化。此外应对方法的专属性进行评估,以确认从制剂和/或膜中浸出的其他物质不干扰药物的定量测定;同时,应对样品在最高相关温度的接收液中放置的最长时间进行评估。
根据FDA IVRT指南和USP<1724>,应采用多点校正曲线法(6~8个)进行测定。
2.4 IVRT方法开发
2.4.1 上样量及上样方式
FDA SUPAC-SS指南[16]建议上样量为300mg,在上样过程中为防止样品挥发,供给室应保持封闭状态。USP<1724>要求拟定的上样量应确保剂量损耗不会影响试验期间的稳态药物释放动力学,正如FDA IVRT指南所述,虽然一些外用制剂在剂量消耗大于30%时也能持续观察到稳态释放动力学,但通常而言,稳态释放动力学应假定剂量消耗低于30%。EMA为伪无限上样,但应确保实际上样量在拟定上样量的±5%范围内。PMDA要求根据释放和渗透的药物量确定。
因此,通常建议上样量在300mg以上,以避免过量的剂量消耗,或因上样量过低导致上样难度的增加(如需将上样量控制在±5%范围内)以及对检测方法的重复性、灵敏度造成挑战。此外,EMA要求释放量至少为标示量的70%,PMDA要求至少为70%或达到平台期,因此上样量亦不能过高,以免整个试验时间过长。
除上述要求外,在上样过程中应尽量减少和控制剪切应力,采用相同的上样方式(如直接从管中挤出到膜上、用抹刀转移后涂覆到膜上、用外置活塞式移液器或一次性采集器转移后分配)将药物均匀地涂覆到膜上,制成紧凑的圆柱形,且在上样过程中应避免膜与样品之间产生气泡。
综上所述,在IVRT方法开发过程中,应根据样品特性的不同对不同的上样方式进行评估,确保上样的均匀性和一致性,并根据稳定药物释放动力学、释放量、试验时长以及方法的灵敏度和重复性等要求综合考虑确定样品的上样量。
2.4.2 接收介质
Proniuk等[25]分别采用pH7.4磷酸盐缓冲液(pH7.4PBS)和肉豆蔻酸异丙酯为接收介质,用肉豆蔻酸异丙酯对膜进行浸泡,以及采用pH7.4PBS为接收介质并用pH7.4PBS对膜进行浸泡的三种方法,对IVRT从两种密切相关的水凝胶中选择酮洛芬释放速率最快的外用半固体制剂的能力进行评估。结果表明,在产品开发早期进行处方筛选时,只有当接收介质具有与人体皮肤相似的特性时,IVRT才有助于预测可供吸收的药物量,说明接收介质选择的重要性。
pH是接收介质选择时需要考虑的一个重要因素,其选择应基于配方制剂的pH、原料药在不同pH条件下的溶解度以及药物作用部位的pH,通常情况下,皮肤的pH在5~6[20,26]。
虽然希望接收介质具有与皮肤相似的生理状态,但也必须确保其能够恰当的测量药物的释放,而选择的最重要因素是药物在其中的溶解度,即在半固体制剂的药物释放过程中,接收介质应可以提供合适的漏槽条件。
EMA指南[7]中未明确说明接收介质的组成,但要求在整个试验期间,接收介质中活性物质的最大浓度不应超过在该接收介质中活性物质最大溶解度的30%。同时要求,应尽量减少接收介质的反向扩散,以避免药物产品的转化,且在整个释放测试期间,应使接收介质的pH值保持恒定。
PMDA要求采用pH值在5~7的缓冲液(离子强度约为0.05)作为接收介质,但当采用标准制剂进行试验时,如果24h的平均释放量小于20%,则可改变离子强度,如添加表面活性剂、改变pH。在不影响制剂形变的情况下,可以采用水醇或有机溶剂混合液。
FDA IVRT指南和USP<1724>指出接收介质通常为水和醇或有机溶剂混合液,要求药物在接收介质中的溶解度应超过IVRT研究中最高样品浓度,理想情况下是一个数量级,同时需要证明在研究期间可达到稳态释放速率。
根据上述分析,在接收介质选择中,可从以下几个方面进行考虑:①通常可采用水醇或有机溶剂混合液,但采用该类型的接收介质时,应尽量减少接收介质的反向扩散,以避免药物产品发生形变,如Kanfer等[27]研究表明乙醇可通过聚合物膜反向渗透导致乳膏制剂的完整性发生改变;②对于水性缓冲液(pH值在5~7,离子强度约为0.05),在整个释放测试期间,应使接收介质的pH值保持恒定,如释放量较低,可添加表面活性剂、改变pH;③符合漏槽条件;④采用标称规格150%的配方制剂,也可达到稳态释放速率;⑤在整个试验期间,药物在接收介质中稳定;⑥如适用,需对接收介质进行脱气处理,避免试验期间产生气泡。
2.4.3 设备平衡
在IVRT试验开始之前,设备应在预定的试验条件下进行适当的平衡。通常情况下需对接收介质进行脱气处理,以避免在试验前或试验过程中膜下产生气泡。系统温度应保持恒定并进行良好的控制。根据不同的试验方法,IVRT膜可以在扩散池组装之前预先用接收介质浸泡,也可以上样前在扩散池内与接收介质原位平衡(如在膜温度为32℃下保持30min)。
2.4.4 试验时长和取样
根据USP<1724>,试验时长应适合于表征药物的稳态药物释放动力学,这通常是基于4~6h的持续稳定释放。在第1h获得的数据通常不能代表稳态释放动力学,对于很多IVRT方法,稳态释放动力学是根据1h之后的时间点计算的(例如,在1、2、3、4和5h,或在2、3、4、5和6h)。至少选取5个取样时间点,以获得表征良好的释放率。在稳态释放速率评估中,取样时长至少为4h,较短的取样时长(例如2h)可能不能有效表征稳态释放动力学。此外,应精确控制样品的取样时间,将其控制在预定取样时间的±15min或±2%,取较窄的时间间隔范围。FDA SUPAC-SS指南要求至少进行5次取样。在取样后,需要采用预热至系统预定温度的接收介质进行补液,同时需确保,在每次取样和补液后,膜下均无气泡产生。
EMA要求试验时长应足以表征释放曲线,理想情况下,释放量至少为活性物质的70%。在药物释放曲线的线性部分至少选取6个时间点(每小时至少取样一次),包括药物扩散达到稳态后的第一个取样时间点。PMDA要求试验时长应确保释放曲线达到平台期或释放量超过70%,但最长不应超过24h。
如上所述,在试验时长和取样时间点方面,各国要求存在差异,其中FDA仅要求对稳态释放动力学(即释放曲线的线性部分)进行评估,EMA除需要对稳态释放动力学进行评估外,还要求在试验结束时释放量至少为70%,PMDA与EMA要求相似,但相对较为宽松(如释放曲线达到平台期或释放量超过70%均可作为释放终点)。
因此,在IVRT研究过程中,对于试验时长和取样,通常应满足以下要求:①在稳态药物释放阶段至少选取5个取样点(如申报欧盟,至少选取6个时间点),且取样时长不应少于4h;②将样品的取样时间控制在预定取样时间的±15min或±2%,取较窄的时间间隔范围;③如适用,释放曲线应达到平台期或释放量超过70%,但最长时间不应超过24h;④在取样后,需采用预热至系统预定温度的接受介质进行补液,同时需确保在每次取样和补液后,膜下均无气泡产生。
2.4.5 重复次数
根据USP<1724>和FDA SUPAC-SS指南,通常采用6个剂量单位可足以表征该产品的性能(释放速率),但在数据等效性评估中,如不能满足要求,应额外增加12个剂量单位进行评估。EMA要求在首次进行方法验证或等效性评估时,每个批次的样品最少需要12个重复,而在日常放行检测中,每个批次采用6个剂量单位即可。PMDA主要用于上市后处方变更的生物等效性评估,要求每个批次至少采用12个剂量单位。
2.4.6 膜温度
对于皮肤外用制剂,FDA和EMA均要求控制在(32±1)℃,而PMDA要求将温度控制在(32±0.5)℃。对于直肠和阴道等内用产品,温度应控制在(37±1)℃。如适用,实验前用非接触式红外温度计对温度进行测定。
2.5 数据统计分析
对于每个扩散池,应测定每个取样点(t1,t2,etc)的药物释放量(通常以µg·cm-2为单位),并以累计释放量对√t作图,在稳态药物释放阶段,两者应呈线性关系(r2≥0.97),其斜率为药物释放速率。在IVRT研究中,各国均要求对药物释放速率的一致性进行评估。在理想情况下,EMA和PMDA还要求药物的累计释放量大于70%。下文对FDA、EMA和PMDA指南中推荐的一致性评价方法进行介绍。
2.5.1 FDA
由于普遍存在测定误差,如气泡和膜缺陷,测定结果常呈非正态分布,推荐采用Mann-Whitney U检验计算受试制剂(T)与参比制剂(S)之间斜率比值的90%置信区间。通过以下示例说明,采用6个剂量单位,分别以RS和TS代表参比制剂和受试批次的斜率,计算所有T/R斜率的比值,如表2所示。
在计算出T/R斜率比值后,将36个T/R斜率比值从低至高排序。然后,将第18个和第29个斜率比值转换为百分单位,分别代表90%置信区间的下限和上限,如果两者均在75%~133.33%内,则药物释放速率是等效的。如果置信区间在75%~133.33%之外,R和T再各测12个剂量单位,与第1次实验结果组合,2组各有18个释放速率,按上述进行置信区间计算,如果第110个和第215个斜率比值均在75%~133.33%内,可判定药物释放速率是等效的。
2.5.2 EMA
与FDA的统计方法相似,采用12个剂量单位,计算R和T各释放速率的相互比值TS/RS(共计144个),然后对这些TS/RS值进行对数变换,使用下式计算置信区间:
其中,X是计算所得的所有TS/RS对数的平均值,n表示样本量,t是n-1个自由度(t)的90%置信区间的t值(n=6,t=2.015;n=12,t=1.796),s表示所有对数转换比率的标准偏差。所得结果取反对数,即为置信区间。如果R和T释放速率几何均值比的90%置信区间在90%~111%内,则药物释放速率是等效的。
2.5.3 PMDA
在规定的试验时间或释放曲线达到平台期后的1个时间点,以及和该时间点对应的释放速率的一半所对应的时间点,受试制剂与标准制剂的平均释放速率之比应在0.8~1.2。此外,PMDA要求受试制剂释放速率的偏差与标准制剂相比,应相同(可采用F检验进行判断)或更小。
3、结语
本文汇总了FDA、EMA和PMDA等国家关于IVRT研究的政策法规,目前国内陆续发布外用药物制剂相关研究技术指南,但尚未有统一的技术规范对IVRT的研究进行规定。外用药物制剂本身具有工艺复杂性,在IVRT研究中亦有很多技术难点,如合成膜的选择及处理、接收介质的筛选、上样方式的控制等。伴随着我国对外用制剂研究的越加深入,希望结合上述对IVRT研究技术参数的讨论,重点参照2022年USP<1724>和FDA IVRT指南,结合我国实际需要,尽早统一IVRT研究技术要求。