摘要
通过对国内外文献进行调研,探讨往复架溶出度测定方法的研究进展和应用现状。往复架法可根据剂型选择样品架,能够更好地满足透皮贴剂、缓释制剂、眼用植入剂、阴道环制剂、药物涂层支架等多种特殊剂型或药械组合产品的研发和质量控制需求,有着广阔的应用前景,为相关制剂开展体内外相关性的研究提供有益的技术支持。
关键词
往复架法; 溶出度; 透皮贴剂; 缓释制剂; 眼部植入剂; 大分子药物的制剂; 阴道环制剂; 药物涂层支架
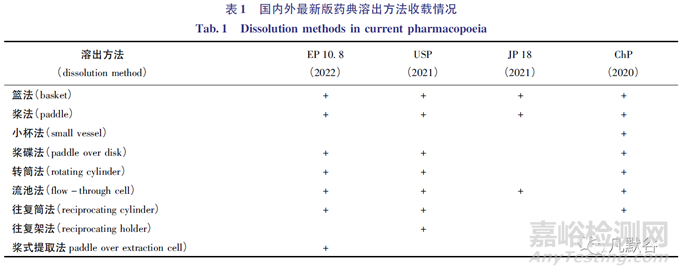
往复架法溶出度仪(reciprocating holder dissolution apparatus)的工作原理与往复筒法溶出度仪工作原理相似,这2种溶出仪器不仅可共享同一操作平台,而且都可方便地更换不同pH的溶出介质。往复架法溶出度仪被广泛应用于透皮贴剂、缓释制剂、植入剂、阴道环制剂、药物涂层支架等多种剂型和药械组合产品的溶出度研究[1-2]。截止至2022年,仅USP通则<724>中收载了往复架法[3]。国内外药典溶出方法的最新收载情况见表1。
往复架法的研究历史可追溯至20世纪70年代,国内对其的研究尚处在起步阶段。目前国内已有数十家机构和企业正采用往复架法开展药物制剂的溶出或释放研究。本文将对往复架法的发展背景、装置组成和工作原理、主要特点及其在药物制剂中的应用进行综述,并对往复架法的未来应用进行探讨。
1、发展历史
往复架法最早是为了适应透皮贴剂质量控制的需求而发展起来的溶出度方法。1968年Alejandro Zaffaroni博士创立了ALZA公司[4],该公司的业务主要集中在透皮贴剂、渗透泵制剂、脂质体和植入剂等的研发。其中,透皮贴剂又称经皮给药制剂[5],透皮贴剂可有效避免肝脏首过效应,还可以实现缓释给药,因此在临床上成为了一些疾病治疗的首选剂型[6]。1969年,Zaffaroni博士申请了第1个通过皮肤或者口腔黏膜吸收的可作用于全身的药物缓释胶布技术专利后,陆续有越来越多的透皮制剂申请专利并批准上市[7-8]。1979年12月,由ALZA公司研发的现代医学意义上的第1款透皮贴剂东莨菪碱透皮贴剂(Transderm ScopⓇ)由美国食品药品监督管理局(FDA)正式批准上市。随后该公司陆续研发上市了用于治疗心绞痛的硝酸甘油透皮吸收贴剂(Transderm-NitroⓇ),用于补充雌激素的雌性激素透皮贴剂(EstrogenⓇ),用于止痛的芬太尼透皮贴剂(DuragesicⓇ),用于辅助戒烟的尼古丁透皮贴剂(NicodermⓇ)等。1974年为满足透皮贴剂质量控制的需求,ALZA公司设计制造了第1台拥有手动操作系统的采用往复碟为样品架的ALZA溶出度仪,又称往复碟法溶出度仪(reciprocating disk dissolution ap-paratus),即为往复架法溶出度仪的雏形。
随着透皮贴剂制剂技术的不断进步,单一的往复碟样品架已经不能满足研发和质控的需求。于1990年获批上市的储库型芬太尼透皮贴剂,最小规格制剂的释药面积较大,为10cm2,且不宜剪裁,故不适用于表面积较小的往复碟,为满足试验需要,选用了圆筒贴剂专用样品架。
FDA要求新型制剂质量控制所用的仪器须是商业化的装置,所以ALZA公司后与Vankel公司合作开发出了往复架法商用溶出仪,该装置于1990年被USP[9]收载为药典标准溶出装置,命名为往复碟法。1995年往复碟法正式更名为往复架法,并收载了用于透皮贴剂、渗透泵型缓释片等用于多种不同类型制剂的专用样品架[10]。
渗透泵型缓释制剂也可采用往复架法进行体外溶出度的测试。1955年Rose S和Nelson J设计了首个基于渗透压的连续给药装置,渗透泵制剂的概念也首次被提出[11]。缓控释制剂,被认为是目前最为理想一种口服制剂,也越来越受到药物制剂工作者的青睐。1972年Theeuwes等[12]共同研发了初级渗透泵专利,Theeuwes[13]于1975年采用往复架法装置对氯化钾渗透泵片的体外溶出行为进行了考察。1982年全球第1款渗透泵型缓释片吲哚美辛片成功在美国和英国上市,随后陆续有多个品种的渗透泵型制剂获批上市。1989年硝苯地平缓释片在美国上市,FDA溶出度数据库公开信息表明该品种采用了往复架法进行溶出度试验。
随着制剂技术的发展,往复架法应用的制剂类型越来越具有多样性。2003年4月全球第1款药物涂层支架西罗莫司涂层支架在欧洲上市[14],同年,Varian公司开始着手研制用于药物涂层支架类药物的改进型往复架法溶出装置。改进型往复架法溶出装置于2007年4月正式投入市场,为医疗器械类产品的释放速率测试提供了新思路[15]。1958年在美国首次获批的醋酸地塞米松眼用植入剂,在2010年的上市审评报告中采用了往复架法进行药物的体外溶出测试[16]。
1998年ALZA公司的芬太尼透皮贴剂首次在中国注册,中国食品药品检定研究院也引进了国内第1台可采用透皮贴剂专用圆筒的往复架法装置,开始了往复架法的相关溶出试验。2019年以来,国内有多个仪器公司实现了往复架溶出度仪的国产化,有助于扩大该方法在药物研发、审评和监管中的应用。包括制药企业、科研院所以及药检机构在内,国内有往复架法溶出度仪的实验室共计50余家。2021年我国国家药典委员会将往复架法的建立和研究,列入药品标准提高计划,为《中华人民共和国药典》通则<0931>溶出度与释放度测定法中增订该方法进行专项研究[17]。
2、仪器装置及其工作原理
往复架法装置由溶出杯、电动机、垂直往复移动样品的往复轴和支架、恒温水浴或其他适当的温控系统组成。
采用往复架法溶出度仪进行试验时,可根据待测样品的剂型特点和药物释放特点选择适宜规格的样品架和适当体积的溶出杯,将样品进行固定后,在溶出工作站软件按照试验要求设置温度、往复频率、振幅及规定样品自动运行到新一排溶出杯继续溶出试验的时间间隔等试验参数。目前,相关药典暂未对取样位置和取样体积进行明确的规定,用户可根据需要来确定。溶出工作站软件还可以结合取样工作站对往复架法溶出度仪进行控制和事件记录。由此来完成待测样品采用往复架法溶出度仪的完整体外释放过程。
仪器一般为六排七列,各排之间互不干扰,每排可根据试验条件选择不同的溶出介质,即在试验过程中可以使用至少6种溶出介质,如果程序设计适当,也可在第6种溶出介质溶出结束后,回到初始或适当的位置,在新的溶出杯或介质中继续试验。
往复架法溶出度仪的溶出杯为平底管状容器,一般由玻璃或其他的惰性材料制成,也可根据试验的具体需要选择其他适当的材料。根据不同品种制剂的试验要求可选用3~1000mL不同规格的溶出杯。对于一些试验时间较长的剂型,则推荐使用带刻度的溶出杯,方便溶出介质挥发后进行补液,并建议使用防蒸发盖。
在试验过程中,溶出杯浸没于适宜温度的水浴中,试验温度可选择范围为5~55℃。用于透皮贴剂时,溶出介质的温度为(32±0.5)℃,用于其他剂型时溶出介质温度一般为(37±0.5)℃。
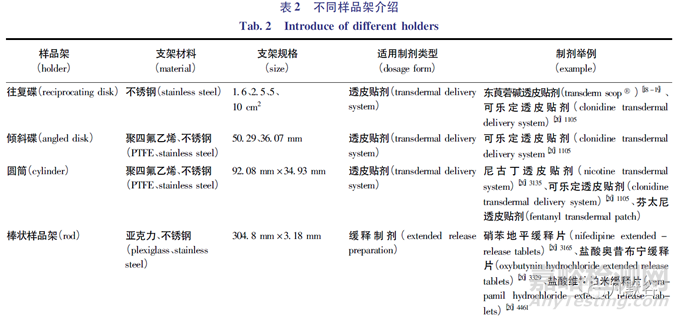
往复架的各项参数除另有规定外,往复频率约为30dip·min-1,振幅约为2cm。在USP中往复架法收载有多种不同的样品架。不同类型和尺寸的样品架适用于不同形状的剂型和不同用途的产品,如透皮贴剂、渗透泵片、植入剂、药物涂层支架、微球、微囊、脂质体、纳米粒等,试验时可根据具体的样品选择相应的样品架,然后将其固定并在介质中以一定频率做上下往复运动。不同样品架的示意图见图1,样品架的相关尺寸、材料信息和应用情况详见表2。
3、往复架法的特点
3.1 可模拟体内环境
与篮法、桨法溶出度仪相比,往复架法溶出度仪通过控制温度、往复架运动频率等物理参数,获得了更为剧烈的剪切力,以达到和体内动态环境相似的生物学相关条件,可满足透皮贴剂、口服缓释制剂、植入剂等对溶出试验条件的需求。
药物口服进入体内后,在复杂的胃肠道生理环境中逐渐发挥药效,往复架法溶出度仪的突出优点之一,即可以几乎不受限制的改变溶出介质,对于一些需要考察一系列pH梯度或不同溶出介质对药物释放度影响的制剂有着一定优势。
3.2 可灵活选择样品架
与往复筒法、桨碟法与转筒法相比,往复架法更适用于透皮贴剂、植入剂、药物涂层支架等特殊制剂的原因在于,往复架法根据制剂种类、规格等不同分别开发了不同的样品架,可在试验设计中根据试验的具体需求进行选择。在一定程度上,往复架法可以实现往复筒法、桨碟法、转筒法装置的功能。
Mazzo等[18]研究表明,使用桨碟法与往复架法2种溶出方法分别进行溶出试验,得到的药物释放曲线是相似的,但是往复架法得到的溶出曲线的平均相对标准偏差更小。对透皮贴剂类药物进行体外释放度的评价,往复架法具有仪器成本低,操作简单等优点,且往复架法溶出仪器具有良好的数据重复性。
一些贴剂因为贴片的特殊设计,几何形状和尺寸等并不适合采用桨碟法进行试验。例如面积较大的贴片,桨碟法因其样品盘面积固定且有限,就无法完成体外溶出检测,对于这样的产品,此时往复架法溶出度仪中的圆筒样品架就成为了首选[26]。
3.3 适用于低剂量化合物
往复架法溶出度仪可以根据受试制剂的具体情况,灵活地选择5、10、20、50、100、300、1000mL的溶出杯。一些植入剂、药物涂层支架等载药量低且药物溶解度也低的新型制剂,体外释放试验复杂,且释药周期往往需要数周甚至数月。此时可以选择往复架法采用较小溶出介质体积,并选择有密封盖等密封性好的装置进行试验,可以显著提高检测的灵敏度,并且最高限度地减少溶出介质的挥发。往复架法为这类载药量低及释药周期长的药物的释放试验提供了思路[27]。
4、往复架法在药物制剂中的应用
4.1 透皮贴剂
透皮贴剂在进行体外溶出试验时,常在扩散池中进行,为了实现更好的质量控制,使试验操作更为经济便捷,透皮贴剂的溶出还可以通过往复筒法、桨碟法、转筒法等方法进行试验[18,28],在USP和FDA溶出数据库中收载的透皮贴剂中还采用了往复架法,为透皮贴剂溶出度测定提供了更多选择。
在采用往复架法开展透皮贴剂的溶出度试验时,一般将透皮贴剂固定于往复碟、倾斜碟或圆筒(图1-A、B、C)等专用于透皮贴剂的样品架上,释药面朝外。对仪器装置进行往复运动的振幅、往复频率、浸出时间和保持时间等试验参数的设置,以实现体外释放的试验目的。
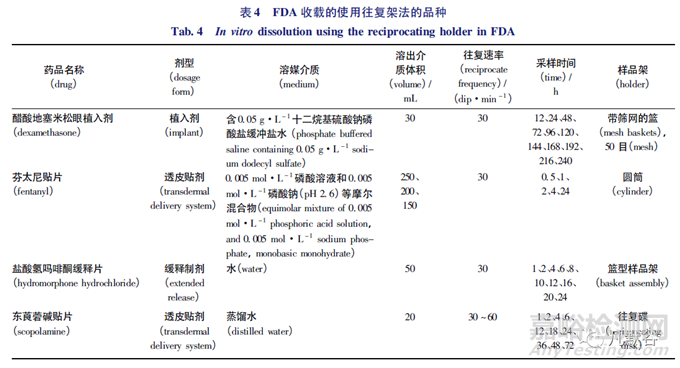
东莨菪碱透皮贴剂是一种圆形扁平状贴片,应用于头部或耳后完整的皮肤区域,实现东莨菪碱连续释放的目的,用于预防与晕车有关的恶心、呕吐,以及麻醉和手术中的恢复[29]。Mazzo等[18]分别采用往复架法、桨碟法和扩散池法3种溶出装置对东莨菪碱透皮贴剂开展了体外溶出研究。试验选择了往复碟(图1-A)作为样品架,试验结果表明,以上3种方法在72h内的东莨菪碱释药量大致相同,其中往复架法与扩散池法单位时间内东莨菪碱释药量几乎相同,桨碟法24h的初始释药量明显较为缓慢,往复架法与桨碟法2种溶出方法所获得的药物释放曲线是相当的; 往复架法、桨碟法和扩散池法3种溶出方法的平均相对标准偏差分别为4.6%、5.4%和6.7%,即往复架法的变异性与其他2种方法相比较小,更适用于透皮贴剂这一类型制剂的体外溶出度试验。但是在试验过程中往复架法与桨碟法需采用透析膜将制剂与支架进行固定,这时就需证实透析膜是否会改变制剂的释放速率,且往复架法与桨碟法都需将东莨菪碱透皮贴剂完全浸泡,因此如果制剂边缘未完全密封,会造成制剂不受控制的从边缘扩散的情况。东莨菪碱透皮贴剂作为全球首款透皮吸收制剂就采用了往复架法进行体外溶出质量控制,体现出了往复架法在透皮贴剂中应用的优势。
Zhou等[19]分别采用VanKel/Varian公司生产的往复架仪器和Logan公司生产的RRT-7往复架仪器对东莨菪碱透皮贴剂进行释药考察,试验条件为选用20mL的水作为溶出介质,温度为(32.0±0.3)℃,以往复碟(图1-A)作为样品架,振幅为2~3cm,往复频率为45dip·min-1。试验结果表明,2种仪器得到了相似的释药溶出曲线,表明不同厂商生产的往复架具有一定的重复性。
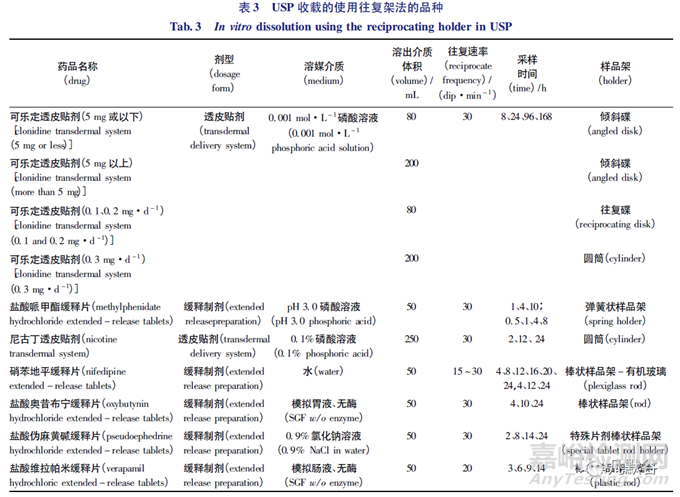
可乐定是可用于各型高血压的中枢性强效降压药。可乐定的有效浓度极低,在4.63~9.26nmol·L-1浓度范围内,即可产生降压药效,如血药浓度过高,可能会引起血压上升等不良反应,故其应用受到限制,而透皮贴剂的剂型特点为解决这一问题提供了思路[30]。USP中收载的可乐定透皮贴剂药品标准有4种体外溶出试验测定法[20]1105,其中2种方法是往复架法。标准中除规定了试验温度为(32.0±0.3)℃,往复频率为30dip·min-1外,还根据制剂规格的不同、释药面大小区别,分别提供了往复碟、倾斜碟和圆筒(图1-A、B、C) 3种样品架,并选用80mL或200mL的0.001mol·L-1磷酸溶液作为溶出介质。同时USP中还规定在试验完成后,将溶出杯取出烘干杯外水浴水后称量,以计算蒸发量。
尼古丁,又称为烟碱,是烟草具有成瘾性的主要原因。目前尼古丁透皮贴剂常作为一种戒烟的辅助剂,其作用已经在多年临床应用中得到了广泛的验证[31]。USP收载的尼古丁透皮贴剂药品标准有4种体外溶出试验测定法[20]3153,涉及桨碟法、往复架法和转筒法3种仪器,其中第一法是往复架法。具体要求参数为将尼古丁透皮贴剂置于10cm×10cm高分子透析膜中心,将粘合剂侧贴在膜上。用2个O型圈将薄膜固定在圆筒(图1-C)上,使透皮系统的1个边缘与凹槽对齐,缠绕在圆筒上。介质为250mL的水,温度为(32.0±0.3)℃。往复频率为30dip·min-1,振幅为(2.0±0.1) cm。分别在2、12和24h,将样品架转移至新的介质中继续溶出直至试验结束。且在每个取样时间点结束时,将溶出杯放冷后通过加水弥补蒸发损失。Li等[26]采用桨碟法和往复架法对尼古丁透皮贴剂的体外药物释放进行了比较,在桨碟法中溶出介质体积为200mL,转速为50r·min-1,桨叶与圆盘的距离为(25±2) mm; 在往复架法中溶出介质体积为20mL,选用了往复碟(图1-A)为样品架,采用了2-氰基丙烯酸酯胶对贴剂与样品架进行固定,往复频率为30dip·min-1,振幅为(2.0±0.1) cm。试验选用了pH7.4的PBS缓冲溶液,试验温度为(32.0±0.5)℃。试验结果表明2种溶出方法的溶出曲线相似,往复架法的RSD(0.4%~3.1%)小于桨碟法的RSD(2.4%~7.1%); 试验人员同时还在不同日期进行了往复架法的试验以验证方法的重复性,结果表明2次试验的药物释放的差异由药物内部的差异产生,重复性符合要求。该研究显示,往复架法的溶出结果数据变异性小,且具有操作更为简单及使用溶出介质体积小的优点。对于大型透皮贴剂系统而言,往复架法可更换各种样品架以适应不同规格的透皮贴剂,而桨碟法因其样品盘面积固定在具体应用中受到了一定限制。
4.2 缓释制剂
缓释制剂是指能在长时间内持续释放有效成分以达到长效作用的制剂,这种制剂的优点在于可在较长的时间内维持平稳的血药浓度,减少了药物浓度“峰谷”的出现,与普通制剂相比显著减少了患者的用药次数,并且因其独特的释药机制,缓控释制剂可以实现药物释放的定时、定位、定速,从而使药物发挥出了更大的疗效,进而成为了近几年临床上研究的热点[32]。
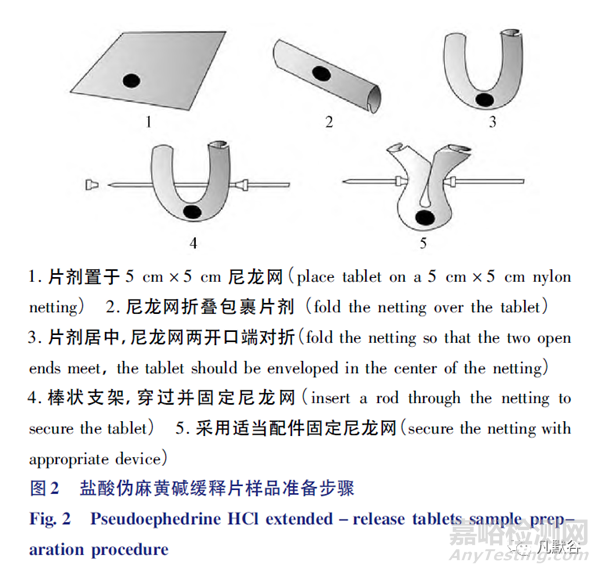
在USP中收载了采用棒状样品架(图1-D)的盐酸奥西布平缓释片、硝苯地平缓释片、盐酸伪麻黄碱缓释片和盐酸维拉帕米缓释片,其中盐酸伪麻黄碱缓释片采用的棒状支架较为特殊(见图2)[20]972,将制剂放置包裹于尼龙网中心后,使用棒状支架,穿过并固定尼龙网。
盐酸哌甲酯缓释片采用了弹簧状支架(图1-E)。FDA溶出度数据库中盐酸氢吗啡酮缓释片推荐使用篮型支架(图1-F)进行试验。缓释制剂最常用的体外溶出试验方法是篮法和桨法,在USP中90%以上的品种选用了上述2种方法,但这2种方法在实际应用中存在一些问题,比如部分缓释制剂采用桨法时极易黏壁,采用篮法时易黏连在金属篮上影响其释放,导致方法的重现性较差,且区分效果不理想。当采用往复架法的棒状支架后,样品固定于棒状支架尖端,有效避免了黏连问题,提高了方法的重现性。
采用往复架法进行缓释制剂体外溶出研究的相关文献报道主要集中在渗透泵型缓释制剂和缓释微丸。1975年,Theeuwes[13]的报告中选用往复架法对渗透泵型缓释片氯化钾渗透泵片的体外溶出进行了考察,试验中并没有明确说明选用了往复架法溶出装置,但是在对试验参数的具体描述时,比如定时将系统从1个溶出杯移动到下1个溶出杯,并测定每个溶出杯中制剂的释放量,且要求往复频率为30dip·min-1,振幅为2.5cm等都可看出该研究使用了往复架法。试验结果表明往复架法得到的体外溶出数据与狗胃肠道中的体内试验数据体内外相关性良好,表明往复架法适用于渗透泵型缓释制剂的体内外相关性研究。
缓释微丸是由药物与阻滞剂混合成丸或在普通丸芯基础上包裹控释衣膜的小型丸剂[33]。缓释微丸的涂层厚度显著影响着药物的释放速度,因此,开发可以准确评价微丸涂层厚度的方法很有必要。Xu等[32]采用往复架法对单个微丸颗粒体外溶出进行评价,试验人员采用三因素三水平的Box-Behnken响应面法对往复频率、取样间隔和溶出介质体积进行了考察,采用了方差分析和响应面分析确定了设计变量之间的主要影响和交互影响,最终确定了试验条件为在(37.0±0.5)℃,往复频率为30dip·min-1,溶出介质体积为6mL,取样间隔40min的试验条件。通过上述确认的试验方法与采用篮法和桨法的药物从颗粒团中的释放结果进行比较,试验结果表明,篮法和桨法得到的颗粒团的释放曲线变异性较大,主要原因是颗粒间的聚集; 采用往复架法对单个颗粒进行试验时发现得到了累计释放呈线性的曲线,并可以很好地区分不同包被量的微丸。
4.3 其他特殊药物制剂
一些低剂量的缓释剂型的药物释放试验需要精确化、标准化的方法。目前很多新兴的剂型比如阴道环制剂、眼用植入剂、血管支架、关节腔内混悬液、大分子多肽类药物等在体外溶出试验中都普遍存在着溶剂量低,释药时间长,加速试验温度较高等的问题,应用往复架可在一定程度上解决上述问题。
4.3.1 眼部植入剂
眼部植入剂(ocular implant),系指将药物与辅料混合制成条状或小块状的由手术植入眼部的无菌固体制剂,从而使得药物缓慢、平稳、持续的释放,其释药时间可长达数月至数年,多用于治疗眼后部感染等疾病[34]。但是,因其给药时间间隔一般在1~2个月,时间较长,结果导致体内药物浓度难以控制,经常低于治疗浓度,因此眼部植入剂的体外释放方法的开发很有必要。在USP中流池法、往复架法和摇瓶法均是玻璃体内植入剂溶出测试的推荐方法[35-36]。这3种溶出方法方便采用较小的溶出介质体积以实现较小载药量的植入剂的溶出所需的条件。
以醋酸地塞米松眼用植入剂为例,地塞米松是糖皮质激素,具有优越的抗炎和免疫抑制作用[37],醋酸地塞米松眼用植入剂是由Allergan公司研发的玻璃体植入剂,外观呈棒状,用于治疗白内障摘除并植入人工晶体后的术后眼内炎症[38],最早于1958年在美国上市。根据FDA溶出数据库,醋酸地塞米松眼用植入剂体外释放选用了50目带筛网的篮作为样品架(图1-G),以0.05g·L-1的十二烷基硫酸钠缓冲液30mL作为溶出介质,在(45±0.5)℃的温度下以30dip·min-1的往复频率进行溶出试验,试验过程持续240h。FDA建议,眼用植入剂可选在45℃的温度下进行高温溶出试验,以加速药物的释放行为[39]。FDA推荐的试验方法有温度较高和持续时间较长2个特性,所以如果采用普通的往复架仪器进行试验,将会面临溶出介质蒸发对试验结果造成的影响,因此可使用带有刻度的溶出杯并定期对蒸发掉的溶出介质进行补液,也可选用密封性更好的装置进行试验。
Sandra等[21]分别采用往复架法和摇瓶法对醋酸地塞米松眼用植入剂的体外释放度进行了考察,其中往复架法选用pH7.4的缓冲溶液在37℃的条件下用3孔和12孔的带筛网的篮(图1-G)以20dip·min-1的频率进行溶出试验,试验表现出较高的变异性,可为临床观察到的高变异性提供支持,各植入剂的差异可能是由制剂间不同的崩解行为导致的,试验结果同时表明3孔的金属篮(7.6%±1.2%)平均释药率高于12孔金属篮(4.4%±2.5%)的平均释药率,在试验的前9d时间里,2种支架的释药量是相当的,约在0.5%±0.03%。往复架法与摇瓶法相比可通过更换样品架。介质体积、往复频率等改变测试条件。例如较低的往复频率,可以为植入剂提供较缓和的流体动力学环境,避免植入剂在较大机械应力的条件下造成的制剂破裂导致药品的突释。
目前很少有在生物条件下眼内植入剂的药物释放的相关研究,在模拟玻璃体的生理条件时,其独特的特性如其凝胶状结构等总是被忽略[40],使得药物的体外释放数据与体内的实际生理情况不等效问题出现。Tobias等[41]针对玻璃体内植入剂开发了仿玻璃体生理环境的体外溶出模型,并分别通过USP收载的流池法和往复架法与其开发的体外溶出模型进行比较。在试验中往复架法选用了12孔的带筛网的篮(图1-G)作为样品架,以30dip·min-1的往复频率在10mL pH7.4的溶出介质中试验,结果表明,流池法中35min后和往复架法中150min后,含曲安奈德的普通植入剂药物释放完成,而在新的体外溶出模型中96h后药物才实现完全的释放,这些结果表明这种新型体外溶出模型与USP溶出方法相比药物释放速率明显更慢,即USP可能存在高估了植入剂在玻璃体内的释放速率的问题。综上建立具有玻璃体生理相关条件的体外释放方法是非常有必要的,这也是往复架法的改进方向之一。
4.3.2 大分子药物的制剂
多肽等大分子药物的制剂在胃肠道中降解且经黏膜的渗透较低,因此设计口服给药剂型极具挑战,是研发口服大分子类药物必然要面临的问题。在现阶段研究中提出了使用弹性材料(elastomeric material)的口服给药装置的概念,这种装置具有增加胰岛素等肽类分子吸收的潜力。
在体外溶出试验中为了验证弹性材料是否完全展开,并得到递送装置的胰岛素释放曲线,以此证实在胃的pH下的胰岛素是否得到了保护作用,试验人员选择了可以随时自由更换溶出介质的往复架法进行试验验证。
Jørgensen等[23]采用往复架法对胰岛素的体外释放进行了研究,以pH为4.0的50mmol·L-1的柠檬酸盐缓冲液和pH为7.0的50mmol·L-1磷酸盐缓冲液为释放介质,将口服给药装置置于50目带筛网的篮(图1-G)中,在5mL溶出杯中,以15dip·min-1的频率在pH4.0的溶出介质中溶解1h,以考察制剂的耐酸性,后在pH7.0的溶出介质中溶解5h,分别在10、30、60、70、80、90、105、120、150、180、240和360min定时自动取样0.5mL,每次取样完成后每个溶出杯内介质都用新鲜的溶出介质替换。试验结果表明,即使在相对酸性较大的胃酸条件下,弹性材料也起到了很好的保护作用。当介质更换为pH7.0的介质时,胰岛素开始释放,持续释放时间约为2~3h。这一体外释放度试验充分体现出了往复架法可方便并及时更换介质的优越性。
4.3.3 阴道环制剂
阴道环(intravaginal rings)是20世纪70年代初发展起来的新型药械组合产品,是非常有前途的全身给药的方式。阴道环制剂是缓释给药系统中的1种,即将药物置于无活性的载体中,药物通过载体的微孔向体内扩散,以恒定速率释放最低有效剂量的药物。随后药物经阴道上皮黏膜吸收,直接进入血循环,避免了肝肠的首过效应,并维持血药浓度的相对稳定,达到长效作用的目的,尤其适用于一些低剂量的例如炔雌醇等固醇类化合物[42-44]。
1969年,Duncan[45]申请了第1个用于雌性哺乳动物阴道内的环形给药装置,但直到20世纪90年代初,第1款孕酮阴道环(ProgeringⓇ)才被批准上市,在此后不久FemringⓇ和EstringⓇ陆续上市。2002年第1个由依托孕烯/炔雌醇联合避孕的阴道环制剂NuvaRingⓇ被FDA批准上市。
目前,市场上有几种用于激素替代疗法或避孕的长效类固醇释放阴道环制剂可供选择。目前尚无针对阴道环制剂的标准药物释放方法。常用于阴道环制剂的药物测试方式通常在培养箱摇瓶(incubative shaking in stoppered flasks)中进行,以水和缓冲溶液作为溶出介质[22]。Externbrink等[46]采用往复架法对NuvaRingⓇ进行溶出度的体外研究,试验选用了50目带筛网的篮(图1-G)作为样品架,分别选用37℃下10mL的模拟体液(VFS)和水作为溶出介质,介质每12h更换1次,结果表明2种溶出介质的试验结果相当,即水中的平衡溶解度为(6.46±0.23)μg·mL-1,模拟体液中的平衡溶解度为(6.04±0.24)μg·mL-1,其体外溶出曲线具有一致性。同时试验人员还分别在44、50和55℃的条件下用模拟溶出介质进行了高温加速试验,在37、44、50和55℃温度下的零级释放常数分别为97.4、207.2、440.3、738.5μg·d-1,符合在高温条件下溶出速率会增加的猜想,当试验温度从37℃升到55℃时,体外释放的评价效率提高了7倍以上,验证了加速试验的有效性。
4.3.4 药物涂层支架
药物涂层支架(DES)是利用裸金属支架平台携带(载)抗血管内膜增生的药物,在血管局部洗脱释放,有效抑制支架内膜增生,以预防支架内再狭窄的支架。药物涂层支架包括以不锈钢或钴-铬制成的裸支架,这些支架被带有抗增生作用的药物载体所覆盖,其聚合物载药涂层包括永久、可降解和无聚合物载药涂层等技术。所载药物包括利莫司类和紫杉醇等[47]。这一类药物的体内研究一般都集中在血液中的药物水平,而不是药物在靶部位的血药浓度,药物在组织中的浓度目前一般是在移除支架后的动物模型中进行确认,试验过程较为繁琐复杂,因此,开展体外研究对药物涂层支架的释放行为研究非常有帮助。洗脱支架类药物在临床上得到了非常广泛的应用,但是在体外释放行为研究中只有少数的几种体外释放装置可供选择。这类药物体外释放研究的难点在于载药量(通常在50~350μg)和溶解度较低,血药浓度低不利于测定; 体外释放试验复杂; 释药周期较长; 试验方案、装置的选择存在着很多问题[24]。
20世纪70年代中期科学家发现了天然的具有抑制细菌增殖作用的抗生素—西罗莫司(也被称为雷帕霉素)。2002年和2003年含有药物西罗莫司的药物装置组合产品分别在欧洲和美国获批上市,这是市场上最早的药物涂层支架。Seidlitz等[24-25]采用流池法、改进流池法(vessel-simulating flow-through cell,VFTC)[48]和往复架法等多种装置对西罗莫司药物涂层支架的释放特性进行了比较研究。其中往复架法的溶出试验方法是将药物固定于样品架上置于带有密封圈的10mL溶出介质中,以40dip·min-1或5dip·min-1的频率上下往复运动,振幅为2cm。试验结果表明,不同的溶出装置的溶出结果有明显差异,往复架法中40dip·min-1和5dip·min-1的试验结果差异不大,说明流体力学对试验结果具有较大的影响。综合试验结果表明往复架法,具有介质消耗少,重复性好,检测灵敏度高等优点,更适于开展药物支架的释放研究的优点。
目前各国药典都没有收载药物涂层支架类药械组合产品的溶出测定方法,使用最多的2种方法分别是流池法和往复架法。Katharina等[49]采用流池法、改进流池法(VFTC)和往复架法对使用流化床制备的药物涂层支架模型进行体外溶解度考察,采用心血管内支架(图1-H),分别考察了2、10、75mL溶出介质体积和5、40dip·min-1往复频率条件下的溶出行为,结果表明溶出介质的体积会对结果造成微小差异,在75mL中溶出速率略快,分析原因为支架与溶出介质产生了较大的机械应力导致洗脱支架骨干发生性变; 而往复频率对试验结果几乎没有影响。综合来看洗脱支架的初始释放频率较快,1d后释放超过55%,2d后约70%,随后释放速率放缓,7d后达到90%,14d后基本释放完成。相比14d后流池法(80.6%±2.0%)和改进流池法(78.2%±12%)的药物释放量,往复架法的释放量明显更快。但在上市的CYPHER溶出度测试时间为90d,与文献中往复架法测试结果相差较远,因此溶出时间必须延长,以确保药物完全溶出。至于文中完全溶出时间较短的原因可能是所建立的方法并没有很好的模拟药物在体内组织中的情况,因此选用更可以模拟体内生理环境的溶出介质并优化试验装置,能建立更有效的制剂溶出方法,并建立体内外生物相关模型。
5、总结与展望
往复架法在设计之初是为了满足透皮贴剂体外质量控制的需求,随着透皮贴剂制剂技术的发展,往复架法的样品架也由最初的往复碟逐渐丰富起来,倾斜碟、圆筒等往复架在透皮贴剂体外溶出中的应用也越来越广泛。
往复架法具有可根据制剂的不同特性选择不同的样品架的优势,越来越多药物制剂开始尝试使用往复架法解决体外溶出过程中遇到的问题。目前除透皮贴剂外,往复架法在缓控释制剂、植入剂、大分子药物的制剂、药物涂层支架、阴道环等许多复杂制剂或药械组合产品中也有应用。在这些复杂制剂或药械组合产品中更体现出了往复架法溶出度仪可改变溶出介质pH和组成,溶出介质体积小,长时间自动运行的优点。在实际应用中,往复架法溶出度仪尚存在溶剂挥发,噪音等问题。
往复架法溶出仪,相比其他溶出装置,在样品架、溶出杯等装置部件的选择上更具多样性和个性化,为相关制剂研发阶段的方法开发和质量研究提供了便利。随着往复架溶出度方法在质量控制阶段的应用和推广,对装置部件的标准化和仪器的重现性、耐用性提出了更高的要求。目前,暂未见公认的针对往复架法溶出仪的仪器性能评价方法和标准,尚待进一步探索研究。
近年来,国内外越来越多的企业、高校及科研院所逐渐将往复架法用于药物的研究中,盐酸哌甲酯缓释片、帕利哌酮缓释片等国内批准上市的药物制剂已经采用了往复架法进行溶出度的测定。随着制药行业的不断发展,透皮贴剂和缓控释制剂等改良型新药成为企业立项的热点,眼部植入剂、大分子药物的制剂、阴道环制剂、药物涂层支架等特殊药物制剂和药械组合产品也日益得到关注,往复架法的引入将为相关制剂的质量研究和质量控制工作发挥积极的作用。
参考文献
详见 《药物分析杂志》 Chin J Pharm Anal 2023,43(3)