您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-11-28 08:49
众所周知,系统适用性为许多分析方法的必要组成部分,该试验是把分析设备、电子仪器、实验操作和被分析样品作为一个整体来进行评价[1]。系统适用性试验参数是根据被论证的方法类型,针对某一特定方法而建立的。当一个分析方法被建立后,它可能会被不同人员,在不同时间、不同实验室、不同仪器下使用,也可能用于分析不同厂家制备的样品,可能会产生许多异常或偏差。因此,为了确保检测结果的准确性和重现性,需要研究者在方法开发伊始就对上述情况做出一定的预判或者模拟,即建立一系列的系统适用性参数(如分离度)来保证分析方法在任何情况下都有效。系统适用性参数通常通过耐用性试验进行评估。由此可得,对于分析方法而言,系统适用性试验至关重要。
一、色谱分析
1.1 参数要求
▲表1-各国药典色谱法系统适用性试验要求
|
试验参数 |
药典 |
中国药典ChP[2] |
美国药典
USP[3] |
欧洲药典
EP[4] |
英国药典
BP[5] |
日本药典
JP[6] |
|
理论板数 |
应指明测定物质,一般为待测物质或内标物质的理论板数 |
/ |
/ |
/ |
/ |
|
|
分离度 |
待测物质色谱峰与相邻色谱峰之间的分离度应大于1.5(分子排阻色谱法要求大于2.0) |
确保临近的洗脱物质彼此分离,确保内标物质与药物分离 |
/ |
/ |
/ |
|
|
拖尾因子 |
0.95 -1. 05 |
/ |
0.8-1.5 |
0.8-1.5 |
/ |
|
|
重复性 |
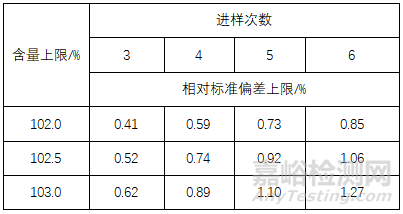
对照品溶液连续进样5次,其峰面积相对标准偏差应不大于2.0% |
标准溶液连续进样5次,其峰面积相对标准偏差应不大于2.0%,如果相对标准偏差的要求大于 2.0%,则需重复进样6次。具体应参考表2 |
与含量上限和进样次数有关,详见表2 |
与含量上限和进样次数有关,详见表2 |
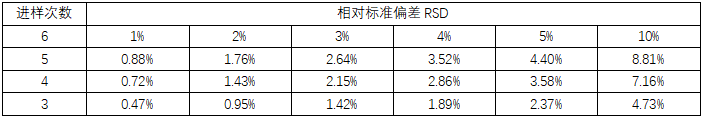
与含量水平和进样次数有关,详见表3 |
|
|
灵敏度 |
定量测定时,信噪比不小于10,定性测定时,信噪比不小于3 |
/ |
定量测定时,信噪比不小于10,且定量限≤报告限 |
定量测定时,信噪比不小于10,且定量限≤报告限 |
/ |
|
|
适用的色谱类型 |
液相色谱、气相色谱、分子排阻色谱、离子色谱、超临界流体色谱、临界点色谱、毛细管电泳 |
液相色谱、气相色谱 |
液相色谱、气相色谱、分子排阻色谱、超临界流体色谱 |
液相色谱、气相色谱、分子排阻色谱、超临界流体色谱 |
液相色谱、气相色谱 |
|
▲表2-美国药典、欧洲药典和英国药典的重复性要求
▲表3-日本药典中不同进样次数对应6次进样的限度规定[7]
▲表4-中美药典部分品种含量或有关物质测定系统适用性要求
|
品名 |
要求 |
|
|
美国药典 |
中国药典 |
|
|
abacavir sulfate(硫酸阿巴卡韦) |
含量:相对标准偏差不大于1.5% |
未收载 |
|
abiraterone acetate(醋酸阿比特龙) |
含量:anhydro abiraterone和3-deoxy-3-chloroabiraterone分离度不小于1.0,对照品溶液相对标准偏差不大于0.73% |
未收载 |
|
acebutolol hydrochloride(盐酸醋丁洛尔) |
含量:理论板数不低于1500,拖尾因子不大于2.5,相对标准偏差不大于0.73% |
未收载 |
|
acepromazine maleate(马来酸乙酰丙嗪) |
含量:理论板数不低于1500,拖尾因子不大于2.5,相对标准偏差不大于2.0% |
未收载 |
|
Acetaminophen(对乙酰氨基酚) |
含量:拖尾因子不大于2.0,相对标准偏差不大于1.0% |
有关物质:理论板数按对乙酰氨基酚峰计算不低于2000。对氯苯乙酰胺峰与对乙酰氨基酚峰之间的分离度应符合要求。 |
|
Acetazolamide(乙酰唑胺) |
含量:拖尾因子不大于1.5,相对标准偏差不大于0.73% |
未收载 |
|
Acetylcysteine(乙酰半胱氨酸) |
含量:Acetylcysteine和L-phenylalanine分离度不小于6,相对标准偏差不大于2.0% |
含量和有关物质均要求理论板数按乙酰半胱氨酸峰计算不低于 1000。 |
1.2 试验方法
二、元素杂质分析
三、粒度及粒度分布测试
四、结论
参考文献

来源:注册圈


