摘要:
硬脂酸镁(Mg-St)是一种常用的固体制剂润滑剂,以其易过润滑特性导致片剂崩解溶出延迟而闻名。本研究采用固定圆盘法、扫描电镜能谱仪(SEM-EDS)、傅里叶变换红外光谱(FTIR)等方法,对含Mg-St的盐酸二甲双胍模型片产生溶出延迟的机理进行了研究。结果揭示了延迟溶出的过程和机理:在溶出过程中,Mg-St在片剂表面的暴露量增加,且片剂的溶出受到Mg-St扩散的限制。此外,在酸性介质中,用FTIR检测出片剂表面存在硬脂酸,分析原因可能是片剂表面的Mg-St解离成其离子,并发生氢化反应生成硬脂酸。由于硬脂酸的溶解度低于Mg-St,因此在酸性介质中的溶解速度比在中性介质中的慢。
1.简介
硬脂酸镁(Mg-St)是一种传统且常用的固体剂型润滑剂,也因其疏水性而被认为可以延缓片剂的溶出。虽然对Mg-St的作用机制和特性的研究较多,Mg-St的一些问题仍有报道,如片剂硬度下降、粘连问题、混合过度导致润滑过度,有时会导致片剂崩解/溶解延迟。口服药物的溶出度是一个重要的质量属性,它会影响药物的生物利用度和药代动力学(PK),最终影响药物的有效性和安全性。因此,溶出度试验不仅包含在常规的质量控制试验中,而且还用于保证两个药品在体内溶出度的相似性,这与生物等效性(BE)有关。
当对一种品牌的500 mg盐酸二甲双胍片剂进行体外溶出度测试时,溶出度随介质pH值的变化而变化,尽管盐酸二甲双胍的高溶解度与pH值无关,因为片剂配方中除Mg-St外的其他成分是可溶的,因此对Mg-St的性能进行了初步研究。提出了Mg-St在不同pH介质中的不同性质,以及Mg-St的分散度与被试片的溶出度之间的相关性,因此,本研究以盐酸二甲双胍片为原料,制备了盐酸二甲双胍模型片,考察了Mg-St在不同pH条件下的溶出行为,并探讨了Mg-St延缓溶出的作用机理。
2. 材料与方法
2.1物料准备
2.1.1 材料
购买了盐酸二甲双胍500毫克规格的商用片剂,用于溶出度试验。为了制备模型片,盐酸二甲双胍购自Farmhispania S.A.(西班牙巴塞罗那),符合日本药典(JP)、欧洲药典(Ph.Eur.)和美国药典(USP)的规范。它的晶体形式是已知的热力学稳定形式。聚维酮(polyvinylpyrrolidone)购自BASF (Ludwigshafen,Germany), Mg-St购自Wako Pure Chemical Industries, Ltd. (Tokyo, Japan)。采用硬脂酸(>98.0%)和Mg-S作为参考红外光谱。
2.1.2 模型片的制备
为制备湿颗粒,将9.5 g盐酸二甲双胍和0.5 g聚维酮混合,并逐渐加入1.5 mL水。然后,在850 μm的筛网上进行挤出造粒,湿制粒在70℃下干燥1天。随后的颗粒用直径为8 mm的压片试验机(TG-50KN, Minebea Co., Ltd, Nagano, Japan)进行压片。以10 mm/min的压缩速度和13 kN的压力制备200 mg片剂,不含mg - st(“Mg-St(-)” tablets);在干燥的颗粒中加入1% (w/w) Mg-St,制得含1% Mg-St的片剂(“Mg-St(+)”tablets)。将颗粒混合1分钟,在与“Mg-St(-)”片相同的条件下进行压片操作。
2.1.3 溶出介质的配制
对于盐酸二甲双胍市售片的溶出度试验,推荐的溶出介质在Ph.Eur中描述。采用不含胃蛋白酶的模拟胃液(SGF, c.a.ph 1.2)、醋酸缓冲液(c.a.ph 4.5)和磷酸盐缓冲液(c.a.ph 6.8)。
对于其他实验,使用JP中描述的溶解试验的第一和第二介质(“pH 1.2”和“pH 6.8”)。还使用了pH 1.2和pH 6.8含0.01% (w/v) MgSO4 (“pH 1.2 (Mg+)”和“pH 6.8 (Mg+)”)。
2.2方法
2.2.1 溶出试验
使用溶出测试装置(Evolution 6100, disk, Inc., New Jersey)。在测试过程中,介质体积为900 mL,控制在37.2±0.5ºC,篮转速为100 rpm。溶出度测定按JP、Ph、Eu和USP进行。在每个时间点取样采用高效液相色谱法分析其药物浓度。
2.2.2初始溶出速率测定
片剂的释药速度不仅取决于各成分的溶出速度,还取决于片剂的崩解行为。在溶出度研究的初始阶段,当片剂表面积恒定时,固定圆盘法可用于检查片剂成分的内在药物释放率,同时消除药物尺寸效应。本研究采用固定式药片法。将测试片放入支架中,使其单面(直径为6mm的圆)暴露于测试溶液中,并悬浮在图1所示的溶出介质中。片剂的位置设置使其直径方向与水流成正比。
使用溶出测试仪(NTR-3000, Toyama Sangyo Co., Ltd, Toyama, Japan)和光纤多通道光谱仪(S-2450, Soma Optics, Ltd, Tokyo)。介质体积为900 mL,试验时温度控制在37.2±0.5°C,桨叶转速为50 rpm。将分光计探头浸入溶出仪中,在曝光时间为20 ms,光程长度为5 mm,测量间隔为5 s,累计次数为50次的条件下,监测溶出试验过程中介质的紫外光谱。pH为1.2时检测波长为235 nm, pH为6.8时检测波长为245 nm。
2.2.3 片表面镁元素的SEM-EDS图谱分析
采用扫描电子显微镜(SEM, JSM-7600F, JEOL, Tokyo)和能谱仪(EDS, JED-3200 Series, JEOL)观察溶出试验前和溶出过程中Mg在片剂表面的分布。待溶出5 min后,将试片从介质中取出并烘干。Mg检测的加速电压为15 kV,放大比为x100,测量时间为10 h。
2.2.4 ATR-FTIR分析
采用傅里叶变换红外光谱(FTIR)对片剂进行表面测量。扫描范围4000 ~ 400cm -1,分辨率4cm -1,扫描次数为4次。采用衰减全反射(ATR)模式,晶体材料为金刚石/KRS-5,样品入射角约为45°,在100rpm篮法溶出研究前和2 min后获得片剂表面红外光谱。片剂溶出过程与桨法相同,均为溶蚀性溶出。采用FTIR仪(IRTracer-100, Shimazu, Kyoto, Japan)获得硬脂酸和Mg-St的参考红外光谱。所用测量参数同上。还获得了Mg-St在介质中过夜的光谱。
2.2.5 Noyes-Whitney方程
药物的溶出度可以用Noyes-Whitney方程表示:
dC/dt = kS(CS- C)
其中:CS 为药物的溶解度或饱和溶液的浓度,C为t时刻溶解药物的浓度,S为药物的暴露表面积,k为溶出速度常数;;
如果CS 远大于C(如溶解初期),则方程为:
dC/dt = kSCS
3.结果与讨论
3.1盐酸二甲双胍片溶出度的pH依赖性
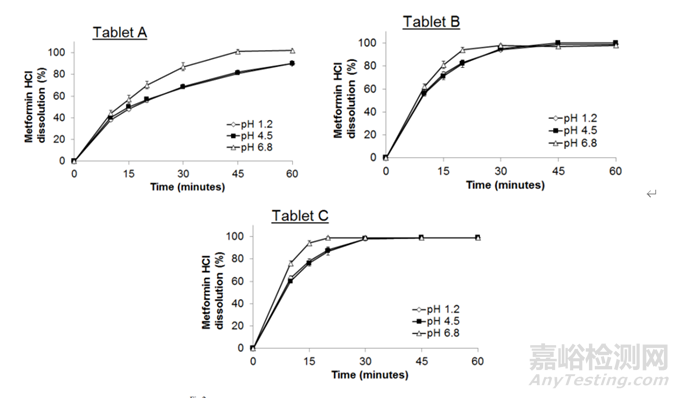
为了研究盐酸二甲双胍片的pH依赖性溶出度,我们对三种不同国家销售的盐酸二甲双胍500mg规格片进行了体外溶出度试验。溶出试验是根据指南中描述的试验条件进行的,采用100 rpm的篮法溶出装置,溶出介质为不含胃蛋白酶的模拟胃液(SGF, c.a. pH 1.2)、醋酸缓冲液(c.a. pH 4.5)和磷酸盐缓冲液(c.a. pH 6.8)。得到的溶出结果如图2所示:3种片剂的溶出度排序相同(pH 1.2 = pH 4.5 < pH 6.8),溶出现象相同,均为溶蚀性。
盐酸二甲双胍是一种广泛用于治疗2型糖尿病的药物。日本橙皮书的数据表明,其水溶液的溶解度在生理pH范围内始终较高,且与pH无关(pH 1.2为333 mg/mL, pH 4.0为353 mg/mL, pH 6.8为355 mg/mL, 37℃水为346 mg/mL), pKa为12.4。这种持续的高溶解度满足溶出试验的漏槽条件,如图2所示。因此,观察到的盐酸二甲双胍在不同pH介质中溶出率的差异,不应该是由盐酸二甲双胍本身的性质造成的。每个片剂配方组成均由盐酸二甲双胍、聚维酮、Mg-St和羟丙甲纤维素组成,但配方之间的成分略有不同。聚维酮和羟丙甲纤维素都是水溶性化合物,只有Mg-St是难溶的。
在pH为1.2或pH为4.5的缓冲液中添加Mg-St时,Mg-St倾向于漂浮在介质表面。但在pH为6.8的缓冲液中分散。Mg-St分散度的变化趋势可以解释pH 1.2 = pH 4.5 < pH 6.8的溶出度顺序。结果表明,盐酸二甲双胍片在不同pH介质中溶出率的差异可能与Mg-St的性质有关。
在接下来的实验中,采用制备的二甲双胍模型片考察片中Mg-St的行为,并以JP 1、2液(pH1.2、pH6.8)进行溶出试验,研究Mg-St及其片剂在酸性和中性介质中的溶出行为。
3.2含Mg-St片剂药物溶出的延缓作用
片剂的溶出速度不仅取决于片剂成分的理化性质如溶解度和扩散系数,还取决于片剂在溶出介质中的暴露表面积,通常用Noyes-Whitney方程(式1)表示。以盐酸二甲双胍模型片为例,由于盐酸二甲双胍的溶解度(Cs)是漏槽条件下的一千倍以上,因此可将方程简化为式2。通过溶出度的研究,片剂的表面积会发生变化。例如,在溶蚀片的情况下,随着溶解,表面积随着片剂尺寸的减小而减小;而在崩解片的情况下,表面积随着片剂崩解成颗粒而增加。二甲双胍市售片和模型片的溶出机制均为表面有限溶蚀而不崩解。
为消除表面积变化的影响,考察给定表面积下的固有溶出度,在pH为1.2和pH为6.8的介质中,采用固定圆盘法测定了所制模型片的初始药物溶出度。所得溶出曲线如图3所示。在两种介质中,Mg-St(+)片的药物溶解速度都比Mg-St(-)片慢,这是由于Mg-St的疏水性,尽管二甲双胍的溶解度很高。Mg-St在pH 1.2介质中的溶出延缓作用大于pH 6.8介质;本文将在后面讨论这一问题,并在后面讨论Mg-St在两种介质中溶出延缓的共同机理。
3.3 Mg-St溶出对片剂溶出的限制
由于片剂中Mg-St的存在导致药物溶出延迟,提示Mg-St本身的溶出限制了片剂的溶出。Mg-St是一种水溶性较差的化合物,在25℃时,其在水中的溶解度为4mg / 100ml。因此,在片剂表面附近区域,Mg-St解离成Mg2+离子和硬脂酸离子时,应考虑Mg-St的溶度积。如果溶解介质被Mg2+离子饱和,则会抑制Mg-St的解离和溶解。
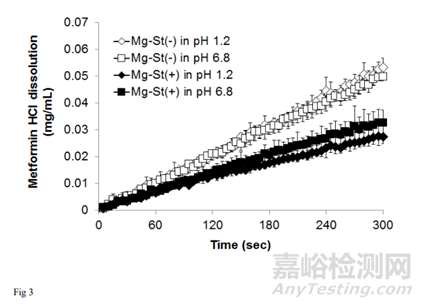
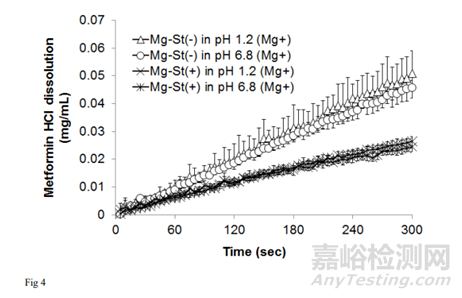
为考察Mg-St溶出度对片剂溶出度的影响,在含0.01% MgSO4 (w/v)(约1 mmol/L)的介质中进行了Mg2 +离子溶出研究,所得到的溶解速率分布如图4所示。
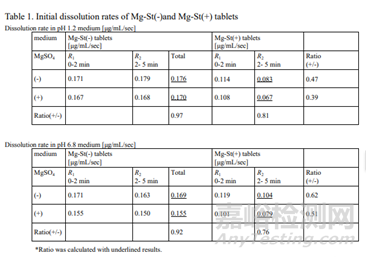
根据图3和图4的溶出图计算初始溶出速率。结果表明,Mg-St(-)片在5 min内溶出率基本恒定;因此,Mg-St(-)片的溶出速率是根据最初5min的曲线来计算的。相反,Mg-St(+)片的溶出速率在溶出后期出现下降。对于Mg-St(+)片,分别计算最初2min和2 ~ 5min的溶出率。得到的溶出率如表1所示。
计算每片药在含MgSO4介质和不含MgSO4介质中溶出率的比值。Mg-St(-)片与Mg-St(+)片在pH1.2介质中的比值分别为0.97和0.81, pH 6.8介质分别为0.92和0.76。两种介质中Mg-St(-)片的比例均接近于1,说明Mg2+离子的存在对Mg-St(-)片的溶出影响不大。Mg-St(+)片的比例小于Mg-St(-)片。这些结果表明,Mg2+离子的存在延缓了Mg-St(+)片的溶出,表明Mg-St的溶出限制了片的溶出。
3.4片剂表面镁元素图谱分析
为了研究Mg- st(+)片的表面状态,采用扫描电镜能谱仪(SEM-EDS)检测Mg- st(+)片溶出前和溶出过程中Mg在片表面的分布,这是观察样品表面Mg的一般方法。如图5所示,在pH为1.2和pH为6.8的介质中,溶解5min后Mg的含量均比溶解前增加;因此,图中显示了Mg- st(+)片剂溶解过程中表面未溶解和残留的Mg。
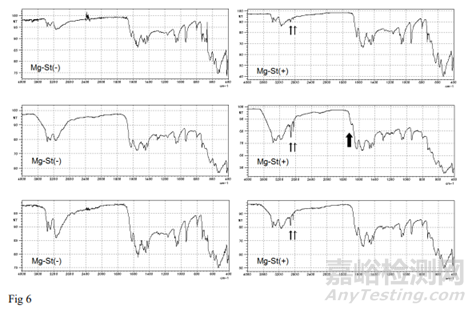
由于Mg-St的SEM-EDS观察是基于Mg-St衍生的镁,因此通过ATR-FTIR测定片表面的Mg-St是基于Mg-St衍生的硬脂基(CH3(CH2)16COO-) 或棕榈基(CH3(CH2)14COO-)。采用ATR-FTIR对Mg-St(-)片和Mg-St(+)片溶出前后2 min的表面进行分析,检测片剂表面成分的化学变化。FTIR光谱如图6所示:Mg-St(+)片的光谱在2920和2850 cm处均有两个特征峰,而Mg-St(-)片没有。这些峰来自于Mg-St的硬脂基或棕榈碱的脂肪族CH。与溶出前的光谱相比,溶出后这些峰相对增加,说明Mg-St在片剂表面的相对比例增加。这些数据也支持溶出后Mg-St暴露在片剂表面的量增加。由于Mg- st溶解速度慢,Mg残留量增加;因此,Mg-St的溶解是片剂溶出度的限速步骤。
这些Mg-St(+)片剂表面Mg-St通过溶出而相对增加的观察结果也与Mg-St(+)片剂在溶出后期(2-5 min)初始溶出速率降低的结果一致,如初始溶出速率结果所讨论的那样。随着Mg-St(+)片表面溶出率的增加,Mg-St(+)片的药物溶出率比初始溶出率降低幅度更大。
3.5. Mg-St延缓片剂溶出时间与溶出介质pH的关系
本文前一部分讨论了Mg-St延缓片剂溶出的问题。下面讨论了其在不同pH介质中的不同行为。
将Mg-St(+)片剂在pH 1.2介质中的初始溶出速度与pH 6.8介质中的初始溶出速度进行比较,如图3所示,发现pH 1.2中的溶出速度比pH 6.8中的慢。由表1可知,在pH为1.2和6.8的介质中加入Mg-St后,药物的溶出率分别降至47%和62%。这些结果表明,Mg-St在pH 1.2中对延迟的贡献可能大于pH 6.8。
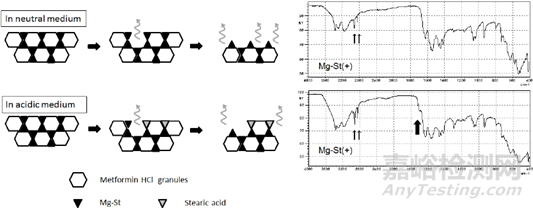
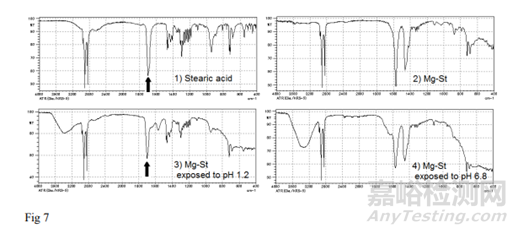
在图6中,Mg-St(+)片在pH为1.2的介质中溶解2min后,在1700 em'左右出现一个特征峰。这个峰可以归属为羧基。图7显示了硬脂酸和Mg-St的红外光谱,通过与片剂测量相同的程序获得。虽然两个光谱的主要部分是相似的,但在1700 em'左右的峰只观察到硬脂酸,它可能来自羧酸C=O。此外,将Mg-St分散在pH为1.2和pH为6.8的介质表面过夜,获得Mg-St的红外光谱(图7)。结果表明,只有Mg-St暴露在pH为1.2的介质中,在1700 em处出现峰值,表明向硬脂酸转化。该峰与Mg-St(+)片在pH 1.2介质中溶出后的峰一致。由此推测,在pH为1.2的介质中,片剂表面的Mg-St可能解离成其离子,并发生氢化反应生成硬脂酸。正如之前的研究所报道的那样,这种变化是可能发生的,尽管它们的溶解机制与本研究不同。
硬脂酸在20℃的水中溶解度为3mg /L,约为Mg-St溶解度的十分之一。因此,由于硬脂酸在酸性介质中的溶解度较低,在片剂表面生成硬脂酸会对片剂溶出产生额外的抑制作用。考虑到硬脂酸的pKa(4.95),可能是靠近片剂表面的Mg-St在pH为1.2的介质中首先溶解并立即氢化为硬脂酸,从而进一步延缓片剂的溶出。虽然Mg-St不仅含有硬脂酸镁,还含有棕榈酸镁,基本可认定棕榈酸镁的溶出行为和硬脂酸镁是相同的,因为这两种物质相似,只是碳数不同。棕榈酸表现出与硬脂酸相似的红外光谱,特征峰在1700 cm左右。棕榈酸在水中的溶解度与硬脂酸一样低,这可能会以同样的方式导致片剂溶解的延迟。
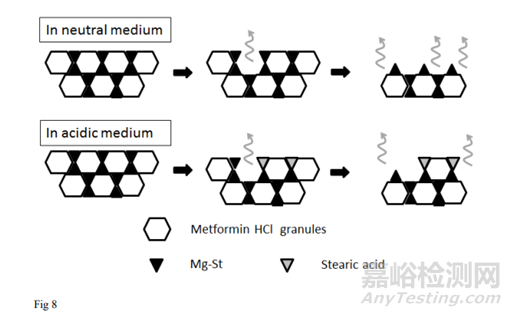
3.6. Mg-St在酸性和中性介质中延缓片剂溶出的机理
根据研究结果,Mg-St对片剂溶出的抑制机制如图8所示。
当Mg-St(+)片剂暴露在溶出介质中时,盐酸二甲双胍颗粒溶解速度比Mg-St快,这是因为Mg-St的水溶性不及盐酸二甲双胍和聚维酮。SEM-EDS和ATR-FTIR研究证实,Mg-St覆盖的面积增加(Step 1)。用固定圆盘法测定初始溶出度的结果可得到药物的有效表面积。初始溶出率测量结果对应式(2)中的kSCs, k和Cs取决于药物和溶出介质的组合。因此,初始溶出率的比值代表了Mg-St(+)片剂的S(药物暴露表面积)与Mg-St(-)片剂的S在各介质中的比值。在pH为6.8的介质中,该比值为0.62,表明Mg-St覆盖了38%的药物表面,使有效表面积减少38%。
Mg- St的溶出限制了片剂的溶出(Step 2),如添加Mg离子的溶出研究所示。在抑制Mg-St解离和溶出的条件下,Mg-St(+)片的溶出率降低。在中性介质中溶解时,延迟机制只能用步骤1和步骤2来解释。
如果片剂在酸性介质中溶解,还有一个步骤有助于延迟溶解:Mg-St在片剂表面转化为难溶硬脂酸(Step 3),经ATR-FTIR研究已经证实。与在pH 6.8介质中的溶出度计算方法相同,Mg-St(+)片的初始溶出率与Mg-St(-)片的初始溶出率之比为0.47,表明在pH 1.2介质中,Mg-St和硬脂酸覆盖了53%的药物表面。相比在pH为6.8的介质中,硬脂酸可使有效表面积进一步降低15%。
4. 结论
Mg-St是一种众所周知且常用的口服固体制剂的润滑剂。因此,有许多研究考察了Mg-St对片剂药物溶出率的定量影响。这些研究使用含有不同量的由Mg-St制备的片剂,并确定在酸性和中性介质中延迟机制的差异。采用不同的工艺参数制备Mg-St或片剂,从而对其进行了研究潜在的批次间差异。本研究旨在探讨延迟产生的机制,并确定酸性和中性介质中延迟机制的差异。
本研究所用的模型片不是快速崩解型,而是表面溶蚀型。在前一种类型的片剂中,可能不会观察到本研究中报道的现象,因为Mg-St的溶出不会是片剂溶出的限速过程。在后一种类型的片剂中,可能会出现本研究中描述的相同现象。然而,这也取决于除了Mg-St之外的其他成分的性质。如果药物的溶解度低于Mg-St,则其溶解将成为一个限速过程。在本研究中,片剂的其他成分(盐酸二甲双胍和聚维酮)是可溶的,其溶出度不依赖于介质的pH。因此,可以在不受其他因素影响的情况下,更清楚地研究Mg-St的特性以及Mg-St延缓片剂溶出的机理。本研究中观察到的现象可能在不同程度上可指导其他片剂的溶出行为差异解释,但需要结合药物产品的自身性质去做进一步研究证实。
注:本文译自Ariyasu, Aoi, Hattori, Yusuke, Otsuka, Makoto, Delay effect of magnesium stearate on tablet dissolution in acidic medium. International Journal of Pharmaceutics http://dx.doi.org/10.1016/j.ijpharm.2016.07.034.