传统化疗药物治疗癌症通常是通过阻断细胞增殖的关键过程实现的。但化疗药物不能选择性在肿瘤部位富集是其使用受限的重要原因。因此,通过偶联靶向肿瘤抗原的抗体为这一问题的解决提供了方案,即大家所熟知的ADC产品(Antibody-drug conjugates)。ADC是抗体与一种细胞毒分子通过合适的连接子连接起来组成的分子。
ADC的主流认识是抗体部分直接结合肿瘤细胞表面的抗原,之后被内吞,细胞毒类药物在细胞内释放,继而发挥抗肿瘤作用。但其实抗体内吞效率在不同靶点间的差别很大,很少能达到100%内吞程度,也就是有一部分ADC并不是在胞内发挥的作用,而是在细胞外的毒素释放发挥的作用。而内吞和非内吞之间,胞内和胞外毒素之间,在抗肿瘤作用中的贡献,很难通过体内实验研究清楚。这也就提出了一个疑问,ADC一定要内吞才能发挥作用吗?ADC的药效主要是内吞后的毒素发挥的作用吗?非内吞型的ADC有开发价值吗?
非内吞ADC产品作用机制
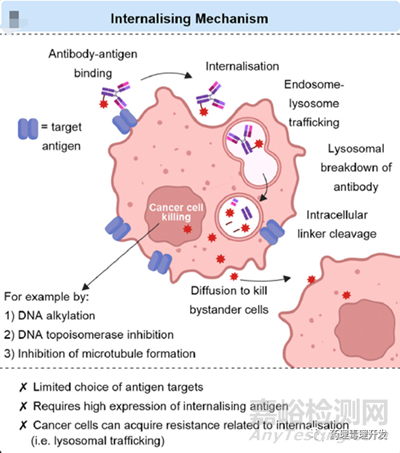
ADC通常被设计为通过内吞发挥作用,抗体首先结合到肿瘤细胞表面的抗原,之后被内吞至细胞内,并在溶酶体内完成蛋白降解,释放出偶联的毒素,杀死所在细胞。而且,毒素在胞内释放杀死靶细胞后,尚未失活的毒素可以被动扩散到旁边的肿瘤细胞,持续发挥杀伤作用,即旁观者效应。旁观者效应不只能消灭肿瘤细胞,对肿瘤基质细胞、粒细胞、肿瘤血管也有杀伤作用。另外,旁观者效应没有太多选择性,无论细胞是否表达目标靶点,只要毒素的扩散能力、透膜能力比较强,所及之处皆带杀伤。内吞型ADC产品的作用机制如下图所示。目前已批准上市的ADC产品基本都是内吞型的。但这类产品也有一定局限性,包括符合内吞且过表达双重要求的抗原有限、抗体的肿瘤穿透能力弱、肿瘤细胞可以通过调节内吞过程中的各个节点实现耐药。
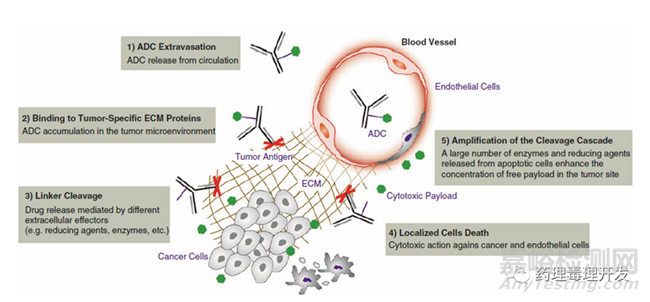
旁观者效应并不是抗体介导的直接内吞导致的,理论上毒素到达肿瘤微环境就有发挥作用的可能。所以,这就出现一种新的策略,采用直接靶向肿瘤特异性细胞外膜抗原、肿瘤基质成分或非内吞/少内吞的膜抗原的抗体,偶联毒素,也有抗肿瘤的潜力。当然,内吞和非内吞抗体在连接子方面还是有区别的,前者可切割或不可切割的连接子都可以,后者只能用可切割的连接子,而且最好是在肿瘤部位选择性切割。如果连接子不稳定,在外周血切割,一是会出现严重的毒性,二是到达肿瘤部位的有效药物浓度会降低。作用机制如下图所示。
靶向膜蛋白的非内吞型ADC
其实,非内吞ADC(或内吞比例非常低的ADC)已经有多个靶点在研,比如CD20、CD21、CAIX和FAP。此外,作用于细胞外基质组分的ADC靶点也有在研,包括fibronectin、tenascin-C、fibrin和collagen IV等。通常非霍奇金淋巴瘤通过化疗和抗体药物联合治疗后效果挺不错的,但复发后的肿瘤是需要新型治疗方式的,ADC是很有潜力的一类产品。尤其对于B细胞来源的非霍奇金淋巴瘤,细胞表面会特异性高表达各种抗原,如CD20、CD21、CD19、CD22。前两个抗原是非内吞型的,后两个则是内吞型抗原。Polson团队采用CD19、CD20、CD21、CD22、CD72、CD79b、CD180等抗原的抗体,采用可切割、不可切割两种连接子,偶联抗微管蛋白毒素分子,在小鼠中考察了抗肿瘤药效。结果显示,所有采用可切割连接子偶联的药物,无论靶点内吞与否,均产生了明显的抗肿瘤作用。采用不可切割连接子的药物,仅内吞型靶点,产生了药效。结论很明显,可切割连接子在胞外(非胞内)被切割后,释放毒素,通过扩散穿过细胞膜,发挥抗肿瘤作用。
碳酸酐酶是一类金属酶,催化二氧化碳水合生成碳酸氢盐。碳酸酐酶Ⅹ(CAIⅩ)是一类跨膜同源二聚酶,在90%以上的肾透明细胞癌中过表达。另外,大部分肿瘤内部是一个缺氧的环境,CAIⅩ是缺氧最好的标记物之一。同时,CAIⅩ在正常器官中的表达又是非常受限的。这就使CAIⅩ成为很有吸引力的ADC靶点之一。起初很长时间,CAIⅩ被视为内吞型抗原。最近已经研究清楚,CAIⅩ是个几乎没有内吞的靶点。Petrul通过将CAIⅩ抗体采用可切割的Val-Cit连接子偶联了MMAE毒素,制备得到ADC分子BAY 79-4620。临床前研究显示,BAY 79-4620在体外可选择杀伤CAIⅩ阳性肿瘤细胞,体内5和10mg/kg剂量下对结肠癌、宫颈癌等肿瘤模型也显示出不错的药效。2014年,这个分子进入Ⅰ期临床剂量爬升阶段,剂量为0.3-4.6 mg/kg。但是,12例患者无PR或CR出现,且高剂量出现心脏骤停和胰腺炎导致的患者死亡。当然,这个分子也就停止推进了。这一悲剧进一步提示,抗原表达分布情况对无论内吞型还是非内吞型ADC产品来讲,都是影响成药的关键因素。
锚定在肿瘤微环境中的抗原或在基质细胞表面的抗原也是非内吞ADC开发的候选靶点。在人体多个实体瘤中发现一个共同现象-纤维蛋白(fibrin)的血管外沉积。动物中也有同样发现,小鼠接种肿瘤后,纤维蛋白沉积往往是最早的形态学变化之一。基于此,Yasunaga团队开发了靶向纤维蛋白的ADC,偶联伊立替康活性代谢产物SN38,DAR值高达24。动物药效试验结果显示,13.3mg/kg,每周给药1次,可明显抑制肿瘤生长,反观伊立替康每天给药组则未见明显药效。毒理学研究未见该产品对肝脏、骨髓、肾脏功能的影响,动物耐受性良好。
成纤维细胞作为重要的基质细胞,在肿瘤转移、侵袭过程中发挥重要作用。成纤维细胞激活蛋白α是成纤维细胞分泌的一种丝氨酸蛋白酶,参与组织重塑和伤口愈合。Sibrotuzumab是一株FAPα抗体,给药后可24-48h可见在肿瘤部位的选择性分布。但是,单独的Sibrotuzumab没有抗肿瘤活性。Ostermann团队通过将FAPα抗体偶联美登素,在胰腺癌、非小细胞肺癌、头颈鳞癌和结肠癌中观察到明显的抗肿瘤作用。
成纤维细胞上还有一个抗原靶点-LRRC15(leucine rich repeat containing 15),在正常组织低表达,多种实体瘤如乳腺癌、骨肉瘤、前列腺癌中高表达。基于此,Abbvie开发了一款LRRC15的ADC产品-ABBV-085,通过ValCit偶联MMAE,已经完成了临床I期研究,27例肉瘤患者中,4例部分缓解,ORR为7.4%,8例疾病稳定。患者耐受性良好。
PD-L1这个靶点比较熟知的是开发成抗体药物,如Merck的avelumab、Roche的atezolizumab、AstraZeneca的duralumab,均已经在多个肿瘤适应症中获批上市。PD-L1这个靶点内吞与否与抗体结合的表位有关,avelumab在MDA-MB-231细胞中只有不到20%被内吞,atezolizumab内吞则达40%,但整体内吞效率都不算高。PD-L1可以作为非内吞ADC潜在靶点之一。
癌胚抗原细胞粘附分子5(CEACAM5)是许多肿瘤的生物标记物之一,同样具备不内吞的特点。Goldenberg开发的CEACAM5抗体ADC,采用的是对酸不稳定的连接子,毒素是SN-38。在人结肠癌、胰腺癌和淋巴瘤中看到了不错的药效。研究人员认为不稳定可切割连接子在酸性条件下使ADC缓慢释放SN-38,导致肿瘤局部游离药物蓄积的非内吞机制是发挥抗肿瘤作用的关键。
靶向肿瘤中经修饰的细胞外基质
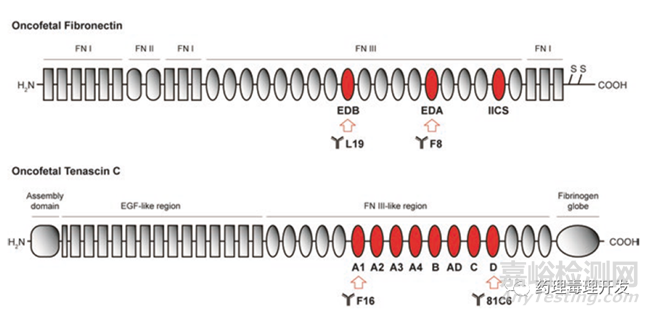
除了膜抗原靶点,细胞外基质也是一类潜在可发成ADC产品的靶点。肿瘤细胞生长迅速,血管不规则,导致氧气供应和利用的不充分,形成缺氧微环境。肿瘤细胞在厌氧条件下会产生诸如CO2,H+-lactate等呼吸终产物,后者是导致肿瘤间质出现酸性环境的重要原因之一(pH从6.5-7变为6左右)。异常的pH值环境会诱导细胞外基质组分产生剪接异变体,如纤连蛋白和tenascin C。纤连蛋白是糖蛋白,是细胞与基质组分之间的桥梁,涉及细胞粘附、迁移、归巢、伤口愈合等功能。纤连蛋白中的EDB和EDA片段选择性在肿瘤中表达,正常组织中的纤连蛋白不含这一片段。Tenascin C是另外一个参与细胞结合的寡聚体糖蛋白,与纤连蛋白类似,也存在肿瘤特异表达的不同剪接体形式。纤连蛋白和tenascin C的结构如下,箭头所示为开发成抗体的区域。
L19、F8、F16、81C6分别是针对纤连蛋白EDB、EDA、tanescin C蛋白A1和D表位的抗体。放射性药物131I-L19和131I-F16已经被用于霍奇金淋巴瘤和头颈癌的临床疗效评估。临床试验中,也有用L19或F16融合细胞因子IL-2或TNF用于黑色素瘤、软组织肉瘤、B细胞淋巴瘤等的治疗。以上两个应用,核心还是利用了纤连蛋白和tenascin C的肿瘤特异性,通过抗体的肿瘤靶向递送能力,将核素、细胞因子直接运送到靶部位。
既然能携带核素、细胞因子,自然也能开发成我们今天的主角-ADC。当然,这些抗原的位置在可溶性蛋白中,自然就不涉及内吞一说了。有研究用EDA抗体F8偶联一种微管蛋白抑制剂cemadotin,采用的是C端半胱氨酸定点偶联,DAR值为2,小鼠中半衰期约为48h。体内抗肿瘤药效也很明显。但是,在剂量高达43mg/kg时,未见动物出现肿瘤消退情况。推测原因或许跟毒素有关,应该偶联活性更强的毒素,比如DM1。采用F8-SS-DM1 ADC产品给予接种F9畸胎瘤的小鼠,7mg/kg的剂量,给药3次,60%的动物出现肿瘤消退。也有团队用F16抗体偶联MMAE,采用蛋白酶敏感型连接子Val-Cit。F16-Val-Cit-MMAE在A431、U87人肿瘤中可引起肿瘤的完全消退。目前进展比较快的是针对EDB的非内吞ADC候选分子PYX-201,已经进入临床Ⅰ期研究阶段,并于2023年5月获得FDA孤儿药认定,用于治疗胰腺癌。
Galectin-3-binding protein(Gal-3-BP)在大多数肿瘤中均可发现大量且持续的分泌。Iacobelli团队制备了针对该靶点的ADC,在异源移植瘤动物模型中观测到不错的抗肿瘤药效,多只动物肿瘤完全消退。
LRG1是在肿瘤微环境中大量存在的糖蛋白之一。Chudasama团队开发了该靶点的ADC,采用了Val-Cit这一被cathepsin切割的连接子,毒素用的是MMAE。体外在LRG1阳性B16F10黑色素瘤细胞中,在cathepsin存在的情况下,显示出很强的肿瘤细胞杀伤作用。进一步体内研究同样显示出明显抑制肿瘤生长的能力,给出了与体外一致的结论。
除了以上靶点外,基质金属蛋白酶9(MMP9)、胶原蛋白、纤维蛋白也是不错的非内吞ADC开发靶点,并有临床前体内外药效学数据支持,不再一一赘述。
改善非内吞ADC产品的活性和选择性
组成ADC的三个组分,抗体、连接子和毒素,对产品的活性和选择性都有影响。对于非内吞型ADC,由于连接子是可切割的,而且是在胞外完成切割,掉落的毒素也是在细胞外,但是毒素需要进入胞内才能发挥作用,故更容易扩散透膜的脂溶性强的毒素是首选。另外,随着ADC连接子结构研究的深入,多聚连接子可以将DAR值提高到10以上,活性自然也随之增强,但带来的是潜在的免疫原性风险。当然,对于如何保障连接子在外周相对稳定,在肿瘤微环境选择性释放毒素是一项需要持续优化的工作。
最后
一直以来,对于一个靶点能不能开发成ADC,除了考量靶点在肿瘤组织中表达的特异性和丰度外,能否内吞也是核心指标之一。内吞型ADC一直是关注和研究的重点。但从过往数据看,非内吞型ADC在临床前的数据其实也已经得到充分验证。尤其纤连蛋白、tenascin-C这两个蛋白,其剪接体在肿瘤中大量存在,丰度很高,而且非常稳定,在大部分正常组织中几乎不表达,是药物递送的理想靶标。相对于研究火热的内吞型ADC,非内吞ADC的研究还比较少,但并不代表此路不通,只是因为内吞型ADC已有前路登顶,脚步可循,风险相对可控。随着研究数据的积累,非内吞型ADC或许也会迎来突破,打破内吞型ADC的垄断,也在某种程度上颠覆大家对ADC的一些认知。目前已经有非内吞型ADC推进到临床阶段,期待带来好的数据。