在自然界中,相同的碳元素构成了性质截然不同的金刚石与石墨。在晶体研究领域中,乙基硫酸钾从溶剂中重结晶,高温呈长羽毛状(α型),而低温下又以叶片状示人(β型),两者具有迥异的溶解度。已经获得上市批准的利托那韦仅仅在一年之后发生“优势晶型”的变更,导致药物溶出度降低,退市后以新的晶型进行制剂工艺的研究又重新上市。同一化合物由于药物分子在结晶时受各种因素的影响,使分子骨架与取代基以及分子中碳原子手性等发生变化,同时药物分子之间,药物分子与溶剂分子之间相互作用力或结合方式发生改变,导致构成晶体的分子或者原子在晶格中的空间排列的不同,从而形成了不同的晶体,同时也造就了药物多晶型的现象。
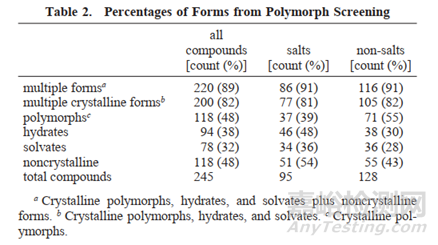
在广泛的化合物种类中,进行化合物晶型筛选,发现89%的化合物存在多晶型现象。
一个原料药的不同多晶型可以有不同的化学和物理特性,包括熔点、化学反应性、表观溶解度、溶解速率、光学和机械性质、蒸气压和密度。这些特性可以直接影响原料药和制剂的处理和/或生产,并且会影响制剂的稳定性、溶解度和生物利用度。所以,多形态可以影响药物制剂的质量、安全性和有效性。
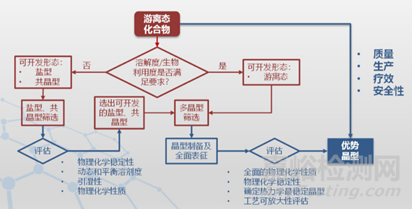
那么,在药物研发中,面对多晶型药物的存在,我们又该如何去决断使用哪个具体晶型去做研究呢?即优势晶型的选择问题。其实,优势晶型可能是单一的晶型药物,也可以按照一定比例选择两种或者多种晶型物质的混和物作为药用晶型。比如,盐酸文拉法辛存在六种晶型,其上市品种原料为晶型1、晶型2或它们与晶型6的混合物。对于难溶性药物,甚至使用亚稳定性晶型或者无定型,同时需要通过一些辅料或者制剂手段保证药物晶型所存在的状态。为了确定药物研发过程中的优势晶型。不仅仅需要考虑与关注药物的理化性质,还要兼顾其有效性,稳定性,安全性以及可生产性。下面我们简单介绍一下各国药监部门以及ICH关于药物研发过程中,对于药物晶型的控制政策与法规条文。
FDA发布的《仿制药晶型研究指导原则》:
a.仿制制剂不要求与原研采用相同的晶型,但是需要证明药物制剂足够稳定,且生物等效;
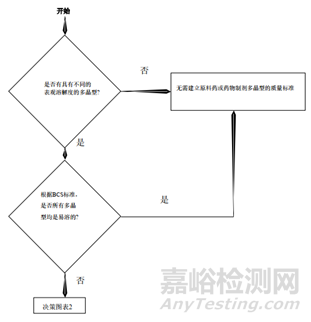
b.对于对多晶型原料药,需要进行溶解度、熔点、稳定性等考察,根据多晶型的表观溶解性和BCS分类决定原料药是否制订晶型控制标准。
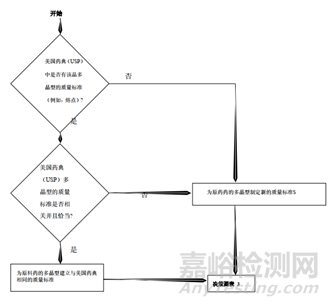
c.对于多晶型药物制剂,需要评估晶型在制粒过程中的稳定性,一般不需要制订晶型控制标准,但是当晶型发生改变、且溶出度测试不能提供足够的控制时,需要建立晶型控制标准。
ICH Q6a中描述多晶型药物:
有些新原料药以不同晶型存在,不同晶型物理性质不同。多晶型也可能包括溶剂化物和水合物(亦称假多晶型和无定型物),在某些情况下,形态不同可能影响新药制剂的质量或功效。如果不同晶型会影响功效、生物利用度或稳定性,就应规定适当的固体晶型。
同时也给出了多晶型检测的方法:物理化学测试和技术常用于测定多种形态是否存在,这些方法举例如下:熔点(包括热层显微镜)、固体形态的红外光谱、粉末X线衍射、热分析法[差热扫描(DSC)、热重分析(TGA)和差热分析(DTA)]、雷曼光谱、电子扫描显微镜、固态 NMR(磁共振光谱)。
测定制剂中多晶型的变化,在技术上通常很困难,一般可用替代方法(如溶出度)来监测生产工艺。多晶含量在无其他替代办法的情况下才作为一个试验项目并列出认可标准。
2020版中国药典:《药品晶型研究及晶型质量控制指导原则》
当固体药物存在多晶型现象,且不同晶型状态对药品的有效性、安全性或质量可产生影响时,应对原料药物、固体制剂、半固体制剂、混悬剂等中的药用晶型物质状态进行定性或定量控制。药品的药用晶型应选择优势晶型,并保持制剂中晶型状态为优势晶型,以保证药品的有效性、安全性与质量可控。
自然界中的固体物质可处于稳定态、亚稳定态、不稳定态三种状态,晶型物质亦如此。化合物晶型物质状态会随着环境条件变化(如温度、湿度、光照、压力等)而从某种晶型物质状态转变为另外一种晶型物质状态,称为转晶现象。共晶物的转晶可以是由两种化学物质中的任意一种或两种发生固体物质状态的晶型转变。由于药用晶型物质的稳定性会影响到药品的临床有效性与安全性,故需要对多晶型药物晶型物质状态的稳定性进行研究。研究内容包括:原料药成分的晶型物质状态的稳定性,原料药晶型物质与制剂处方中各种辅料的相容性,制剂的制粒、成型、干燥等工艺对原料药晶型物质状态的影响等。
通过晶型物质状态的稳定性研究,可为优势药物晶型物质状态选择、药物制剂处方、制备工艺过程控制、药品贮存条件等提供科学依据。
不同药物的不同晶型物质状态对定性鉴别方法或成分含量定量分析方法的特异性可以相同或不同。中国药典详细介绍了晶型种类鉴别一定性方法以及晶型含量分析——定量方法。
晶型药物的溶解性或溶出度评价:本法为体外晶型物质评价的辅助方法。当原料晶型物质状态不同时,晶型原料或固体制剂的溶解或溶出性质可能存在较大差异,所以需要进行晶型物质与溶解或溶出性质的关系研究。以溶解度或溶出度、溶解速率或溶出速率作为评价指标。原料药采用溶解曲线法,固体制剂采用溶出曲线法。
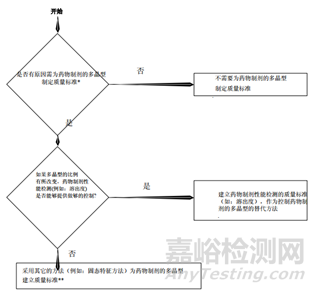
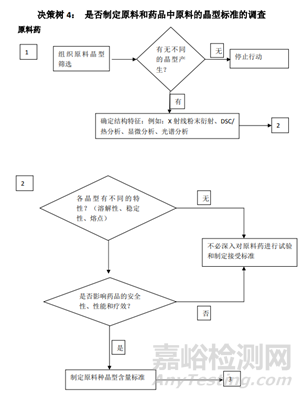
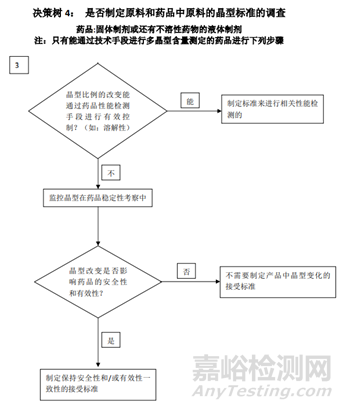
总结:从上面的指导原则,我们可以看到晶型研究的重要性,而且各指导原则虽然有差异但又互相补充,同时也给了我们一个晶型药物的的一个研究思路。首先通过技术手段判定这个药物有无多晶型现象,如果没有,自然不用研究;反之,存在多晶型现象,我们需要进一步研究其理化性质(稳定性,溶解度等)的差异,若差异无或者风险评估后,影响极小,也不用指定标准;反之,各晶型间理化性质差较大,那么,存在的不同是否会影响药物安全性与有效性,无影响需要研究,反之,需要对化合物进行晶型的质量控制。对于制剂的多晶型研究,首先需要研究制剂过程中晶型的稳定性,如粉碎,过筛,制粒,压片,包衣过程中药物晶型的稳定性,不变化无需指定质量标准,反之,需要研究晶型变化会不会对药物理化性质,稳定性等进行影响,没有影响无需研究,反之,就需要制定标准。
药物晶型是连接药物分子与药物制剂的桥梁,在药物基本理化性质研究的基础上,进行晶型研究与控制,并在制剂开发中持续进行晶型研究。明确其重要性与可控性,助力药物开发。当然,我仅仅是整理和罗列了这些指导原则一些比较共性的内容,具体细节还需要大家结合自己的项目进行研究。
如有不妥之处,还请指出。
参考文献
1 2020版中国药典:《药品晶型研究及晶型质量控制指导原则》
2 ICHQ6a
3《仿制药晶型研究指导原则》
4 晶型药物研发的理论与应用
5Diversity in Single- and Multiple-Component Crystals. The Search
for andPrevalence of Polymorphs and Cocrystals
6 新药研发中的关键晶型问题-陈敏华