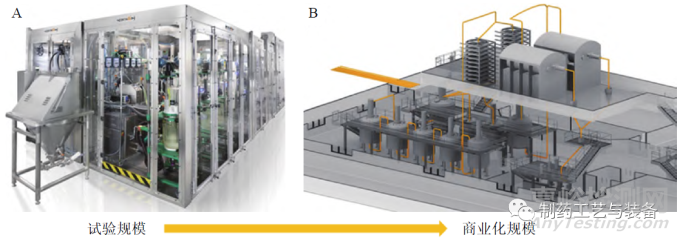
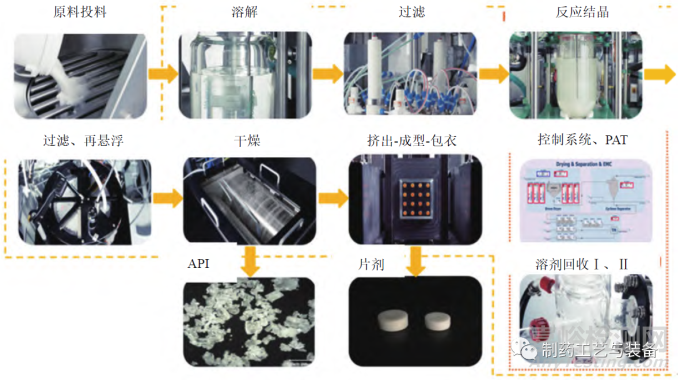
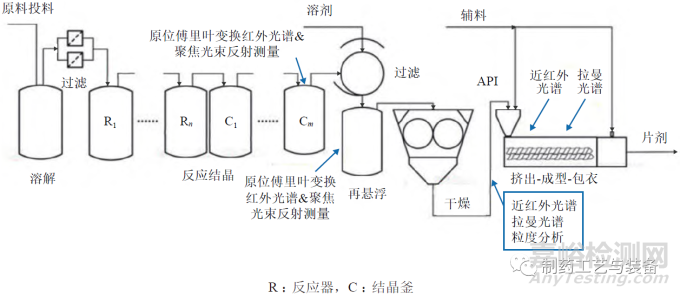
口服固体制剂的生产模式正逐渐由批制造转向连续制造。利用过程分析技术对生产过程中的原材料、中间产品和最终产品的关键质量属性进行在线分析和控制,可实现高效率生产、自动化监控、高产品质量要求,并实现实时放行测试。连续制造集成了连续生产线、过程分析技术和先进反馈控制系统,更加符合制药工业 4.0 理念。本研究综述了连续制药的发展历程和现状、连续制造生产过程和过程分析技术在口服固体制剂连续制造中的应用,以期为口服固体制剂连续制造研究提供参考。
目前,药品生产以批制造为主,即将原材料输送到单个单元操作中,通过离线分析测试中间产品的质量,满足质量要求后,物料才可以被转移到下一个单元操作,整个过程较为烦琐(见表1)。相比于批制造,连续制造(continuous manufacturing,CM) 是将间歇式单元操作整合为连续生产线,结合过程分析技术(process analysis technology,PAT)实时监测和控制原材料、中间产品和最终药品的关键过程参数(critical process parameters,CPPs) 和关键质量属性(critical quality attributes,CQAs),同时借助前馈、反馈系统在线监控以及调整中间体和成品的质量,使原辅料和终产品能以相同的速度进出生产线,生产迅速且产品质量一致性高,可实现实时放行测试,更加符合制药工业4.0理念。
表1 批制造和连续制造的比较
随着科学技术的不断进步,人们对于药品质量的要求也越来越高,需要安全、有效和高质量的药品来满足人民日益增长的健康需求。2017 年,美国FDA发布了促进新兴技术用于制药的行业指南,连续制造是其中位列第一的重要战略方向,通过整合PAT在线监控CQAs,可实现高效率生产、自动化监控、高产品质量要求。口服固体制剂(oral solid dosage forms,OSD) 是药物制剂中的一类,其生产模式正逐渐转向连续制造,需整合多单元操作,过程复杂、难度大。本研究将主要从连续制药发展现状、OSD 连续制造生产过程和PAT 在OSD连续制造中的应用三方面进行综述。
1、连续制药的发展历程及现状
早在20世纪90年代就已有连续制造的雏形。德国有人采用连续制粒和连续干燥以规避工艺方法引入的问题[1];2000年以后,在线技术的应用让药品连续制造得以发展。
美国结构有机颗粒系统工程研究中心(Engineering Research Center for Structured Organic Particulate Systems,C-SOPS)于2006 年成立,在美国国家科学基金会和包括制药企业、设备生产商在内的行业合作伙伴的资助下,建立了连续制药先进制造实验室,致力于药物连续制造的研究。2012年,C-SOPS和杨森制药合作将给料机、搅拌机和压片机集成为一条连续直接压片制造生产线,以取代传统的多阶段批制造[2]。
诺华制药投资6500万美元与麻省理工学院合作开展连续制造的项目研究,于2007年9月成立了诺华- 麻省理工学院连续制造研究中心,希望将工艺步骤减少到最低限度,开发出一个完全集成的连续制造(integrated continuous manufacturing,ICM) 平台[3],并于2012年成立美国CONTINUUS制药公司,目前已建立第一个全自动、端到端可商业化的ICM试验工厂。
随着制造技术的不断发展,很多制药企业和研究机构都在积极推动OSD的连续制造。英国工程和物理科学研究委员会于2011 年成立了连续制造和结晶创新制造中心;2014年,G-CON、GEA 和辉瑞(Pfizer)三家公司合作开发了一种便携式、连续、微型和模块化的系统,集成了G-CON 的模块化设计和GEA的ConsiGmaTM 连续制造平台用于生产OSD[4]。另外,一些新兴技术如热熔挤出(hot-melt extrusion,HME) 技术、3D打印技术等,也被逐渐应用于药物的连续制造中。
2015年7月,由福泰制药(Vertex) 研发的Orkambi 经FDA 批准上市。Orkambi 是由鲁玛卡托(lumacaftor) 和依伐卡托(ivacaftor) 组成的复方药物,用于治疗囊性纤维化,是第一个通过连续制造工艺生产的OSD 产品。截至目前,已有8种采用连续制造生产的药品被FDA、欧洲药品管理局(European Medicines Agency,EMA) 或日本医疗器械审评审批机构(Pharmaceuticals and Medical Devices Agency,PMDA) 批准上市[5—6],如表2 所示。
表2 获批上市的采用连续制造工艺生产的药品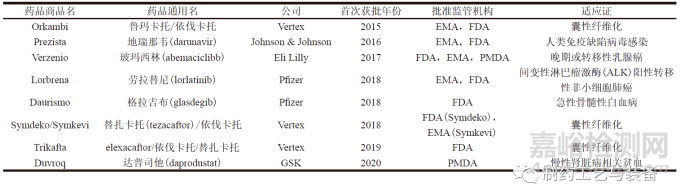
2019年2月26日,FDA 发布了《连续制造的质量考量》行业指南草案[7],列出了对固体口服小分子新药和仿制药连续制造的质量考量相关信息。指南中表示,GMP中关于批次的传统定义适用于连续制造,“批次可以根据生产周期、加工物料量、生产物料量或生产变化( 例如不同批次的原料) 来定义,并且利用在不同时间段连续运行的优势,可灵活地调整以满足不同的市场需求。”同时,“对基于时间(例如生产周期) 定义的批次,必须建立物料可追溯性和批次之间的联系,以确认药品的批量。”
人用药品技术要求国际协调理事会(ICH) 于2021 年7 月27 日正式发布了《Q13 :原料药与制剂的连续制造》指南[8],并公开征询意见。该指南描述了连续制造的开发、实施、操作和生命周期管理的科学监管考虑因素,适用于化学实体和治疗性蛋白质原料药和制剂的连续制造,包括新产品(如新药、仿制药和生物类似药) 的连续制造以及现有产品从批制造转变为连续制造。此外,可能也适用于其他生物/生物技术实体。ICH 专家工作组计划于2021年11月举行面对面会议,讨论收到的反馈意见,并计划于2022年11月签署文件。
在制药行业中,目前还存在因制造技术和设备落后、缺乏有效的质量管理体系等导致的药品召回、药品短缺等诸多问题[9]。连续制造具有能最大限度地提高药品产量、降低生产成本、保证药品质量和实现实时放行测试的优势,已成为未来技术竞争和产业发展的新焦点,各国监管机构、研发机构和制药企业等正积极研究这一新技术,以更加有效地解决医药行业目前面临的问题。
2、口服固体制剂连续制造生产过程
OSD 连续制造生产过程有3种模式,分别是半连续制造、连续制造和端到端连续制造。
2.1半连续制造过程
OSD半连续制造过程是将几个生产单元整合成一个半连续生产线,通过小批量设备改造以推进连续制造发展,下面将主要从连续混合、连续制粒、连续流化床干燥、连续包衣四方面的研究应用来展开介绍。
2.1.1 连续混合
混合是将2种以上组分的物质混匀的操作,以含量均匀一致为目的,是保证制剂产品质量的重要措施之一。PERNENKIL 等认为,连续混合可有效提高产品的质量和生产效率[10]。传统间歇式混合设备(如双锥、V 型、二维、三维、料斗混合机等)需离线取样分析,费时费力;而连续式混合设备,整合了投料机、混合器、在线PAT,可实时分析含量均匀性,大大缩短生产周期。
瑞士Gericke 公司生产的工业连续混合器,集成了该公司GCM 250型水平连续混合器(长0.3 m,直径0.1 m) 和德国Schenck公司生产的失重式(LIW) 投料机。混合器叶轮由12个三角形叶片组成,沿旋转轴等间距排列,叶片与轴的角度可变;另外出口处有1个半圆形的堰用以控制粉量,通过旋转堰可改变粉料在混合器中的填充水平。VANARASE等在该混合设备的出料口配置近红外光谱法(near infrared spectroscopy,NIR) 分析物料的成分含量以表征混合均匀性,又利用停留时间分布(residence time distribution,RTD) 和粉末滞留量来表征混合器中物料的流动特性,以此研究对乙酰氨基酚和微晶纤维素的连续混合过程[11]。
LEE 等设计了一种垂直型连续混合设备,由物料处理、重力式给料机、垂直型连续混合器和在线NIR 组成[12]。垂直型连续混合器由孔径2.1 mm 筛板(用于去除团块) 和锥形区域(用于物料混合)组成,直径为150 mm,底部锥形区域倾角为60°,总体积为3.56 L,上下腔内的叶轮均可独立控制;同时,混合器位于3个测压元件上,可连续测量混合器内的粉末质量;输出物料量由位于混合器底部的电机驱动出口阀控制。在混合器入口流注少量示踪剂后,还可使用NIR 探针在混合器出口流处实时监测RTD 以考察混合性能。研究表明,该垂直型混合器相对于水平式混合器在物料特性和工艺参数发生波动的情况下混合性能更稳定。
2.1.2 连续制粒
制粒是药物制剂生产中重要的操作步骤之一[13—14],在颗粒剂、片剂中应用广泛,可改善物料流动性、调整堆密度。制粒方法有湿法制粒和干法制粒,其中湿法制粒应用较多。目前已有多种类型的连续湿法制粒机,如连续流化床湿法制粒机、连续高剪切湿法制粒机和连续双螺杆湿法制粒机等,其适用性对比见表3。
表3 3种连续湿法制粒机的适用性比较
连续流化床制粒又称沸腾制粒,由容器、筛板、喷嘴、捕集袋、空气进出口、物料进出口等组成,净化空气经加热后通过筛板进入容器,加热物料并使其呈流态化,黏合剂以雾状喷入,使物料粉末聚结成粒子核,进而形成颗粒。连续流化床制粒机根据其腔体形状分为方形床和圆形床2种类型:前者以水平方式工作,粉末混合物在一端投入,当其移动至腔室末端时通过喷射黏合剂发生团聚,随后被干燥移出;而后者由1个单独的腔室构成,其中物料投入、制粒和输出同时进行,但需要另外的流化床用于干燥[15]。
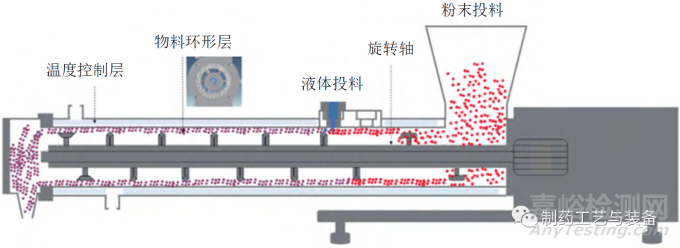
德国Lödige 公司的CoriMix®CM5 型连续高剪切混合制粒机示意图如图1所示[16],由1个水平腔室(长38 cm,直径12 cm) 和旋转轴组成,沿着旋转轴安装不同的叶片可产生颗粒加速/预混合、制粒和成型等不同功能。在高转速(4000 r/min) 下,物料在制粒机内引发同心环状流动,液体成分被蠕动泵泵送,通过单相喷嘴以滴落模式从顶部切向进入物料环形层。环形层内液滴和粉末混合,通过旋转轴和静态室壁之间的高转速差,可瞬间形成颗粒,产量为10 ~ 80 kg/h,适于工业化应用。
图1 CoriMix®CM5型连续高剪切混合制粒机示意图[16]
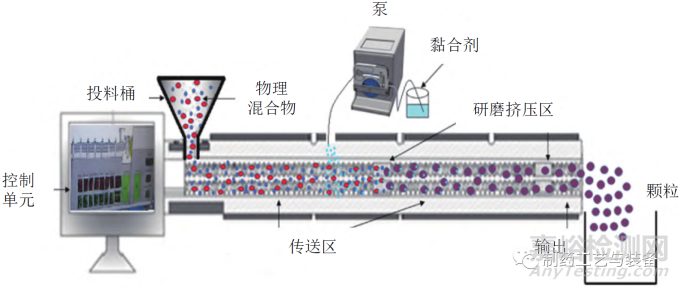
双螺杆制粒(twin-screw granulation,TSG) 是制药行业新兴的一种连续湿法制粒技术。TSG 是将药物和黏合剂投料进桶,通过特定螺杆螺牙和双螺杆同向旋转推动,沿着螺杆长度方向连续混合并与黏合剂均匀研磨挤压,于末端得到颗粒,如图2所示[17—18]。DHENGE 等考察了一系列过程变量对TSG 的影响,以此深入了解颗粒生长动力学及形成机制[19]。
图2 连续双螺杆湿法制粒机示意图[18]
2.1.3 连续流化床干燥
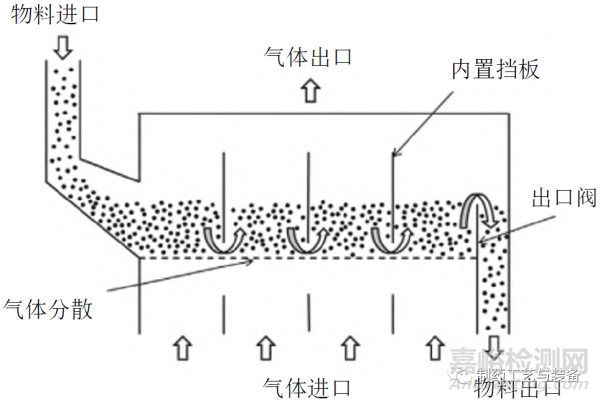
药物中含有的水分是影响最终产品质量的关键因素,含水量过高易导致结块、发霉、变质等,因此干燥也是制药生产中不可或缺的工艺步骤。流化床干燥技术是一种新型干燥技术,其过程是将散状物料置于孔板上,再从下部输送热空气,使物料颗粒在气流中呈悬浮状态,与气体充分接触,进行物料与气体之间的热传递和水分传递,干燥后被排出。与传统干燥技术(烘箱干燥、托盘干燥)相比,连续流化床干燥在制粒、包衣等过程中的适用性更广、传热性能更好,且物料可连续进入和排出。图3为一种常见的水平式连续流化床的原理图[20],由1个狭长的长方体处理室构成,固体药物在水平方向上连续流动,在连续运行时可获得较高收率。
图3 连续流化床干燥示意图[20]
2.1.4 连续包衣
包衣常用于片剂,较少应用于胶囊、颗粒剂、丸剂等,通过包衣可遮盖味道、改善外观、防潮、缓控释等。传统包衣机存在运行过程短、装料和卸料耗费大量人力物力及时间、包衣均匀性差等问题,当涉及功能性包衣时,会导致药物释放特性出现不符合预期的变化,从而影响药品质量[21]。连续式包衣机的主要优势在于可显著提高产品产量,包衣更均匀。目前,连续包衣机主要有美国Thomas 公司的FLEX CTC 型、德国Driam 公司的Driaconti-T Pharma 型(图4) 和加拿大Ohara 公司的FCC 型,其原理基本相似,设备外形结构有些许差异。
图4 Driaconti-T Pharma 连续包衣机外观(A) 和示意图(B)[22]
如图4所示,隔板将系统分隔成多个包衣间,可实现连续循环薄膜包衣。在包衣过程中,将待包衣的素片等输送至进料口,在设定参数控制下持续定量进入第一包衣间后再输送至下一分区,包衣介质经蠕动泵泵送至喷枪喷出,自动喷洒在片芯表面,同时在滚筒上部提供经过滤的热风,快速均匀干燥以形成致密、平整光滑的薄膜包衣[22]。
2.2连续制造过程
将单元或半连续装置与过程分析仪器、先进控制系统等整合,形成连续制造装置,实现CQAs 实时在线检测,可在很大程度上解决单元生产操作之间的分离、物料流动性和产品质量的潜在问题。目前除了连续直接压片过程外,还有其他新兴技术如HME 技术、3D 打印技术等,其制造过程本质上是连续性的,也被应用于OSD 的连续制造。
2.2.1 连续粉末直接压片
C-SOPS 建立的连续粉末直接压片中试工厂由不同高度的三层组成,顶层用于重力给料机放置和粉料储存,中层用于倾倒和连续混合,底层用于压片,每一层都有约1 m2 的工作区域。该试验工厂配置有3种重力给料机用于活性药物成分(API)和辅料等的投料和输送,再集合研磨机用于去除团块、保证物料的充分接触,之后连接连续搅拌机,使所有物料均匀混合,从搅拌机的出口通过旋转式给料装置输送到压片机,粉末混合物填充模具,随后被压缩成片剂[2]。
另外一种连续直接压片生产线集成了德国GEA公司的ConsiGmaTM 连续片剂生产线、西门子的自动化控制系统和SiPAT数据管理系统。ConsiGmaTM连续片剂生产线可以在一条完整生产线上完成原料投料、混合、湿法制粒或干法制粒、干燥、压片、包衣和质量控制,在保证质量和提高生产效率的同时,可显著减少开发时间和API 的使用,节约工艺和能源成本;西门子的SiPAT 能够基于PAT 的质量控制策略,实时监测最终产品的CQAs。这种集成的连续片剂生产线能持续监控产品质量,降低生产成本,允许实时放行测试,减少或消除最终质量检查[23]。
2.2.2 热熔挤出(HME) 技术
HME工艺早已成为制药行业的一项开创性制造技术,与传统间歇式制药工艺相比,HME 具有可连续化操作、低成本、高效益、无需溶剂、可在线监测等优势,可用于提高难溶性药物溶解度、制备缓控释制剂等。
首先将加入挤出机中的API、聚合物载体及各种辅料熔融,进一步混合使API和各种辅料均匀分散于载体中,继续操作将降解的小分子和水分等从物料中脱除,由挤出机螺杆将物料挤出后冷却定型,最后按需进行粉碎、切粒等操作。HME 结合了固体分散技术和机械制备的诸多优势,生产线本质上具备连续性,具有良好的重现性和极高的生产效率。VO等利用HME 连续制造工艺制备了酮洛芬缓释微丸,通过在线NIR 和在线粒径分析实时监测,使药物含量和颗粒粒径在设计空间内得到了良好控制[24]。
2.2.3 3D打印技术
药物3D打印技术是近年来新兴的技术领域,系根据计算机辅助设计(CAD) 或断层扫描(CT)设计三维立体数字模型,在电脑程序控制下采用“分层打印、逐层叠加”的方式,通过金属、高分子、黏液等可黏合材料的堆积,快速而精确地制造具有特殊外形或复杂内部结构的物体,实现个性化给药和按需制造。
1996 年,麻省理工学院CIMA教授首次报道粉末黏结3D打印技术可应用于连续制药。美国Aprecia公司历经10余年,成功开发了可大规模生产的ZipDose技术,并采用此技术研发了第一款采用连续制造3D打印技术制备的抗癫痫药Spritam(左乙拉西坦片),于2015年7月31日获得FDA批准上市。
南京三迭纪医药科技有限公司在全球首创了热熔挤出沉积(melt extrusion deposition,MED)3D打印药物技术,集成了PAT 和反馈控制技术,开发了从药物剂型设计、数字化产品开发到智能制药的全链条技术平台,并于2020年4月在FDA新兴技术组立项。MED 3D打印技术平台基于“剂型源于设计”的理念,制剂生产一次成型,通过PAT实时监测,可实现药物连续化生产、显著提高产品质量、降低生产成本。2021年1月,该公司采用MED 3D打印技术开发的首个药品T19(治疗类风湿性关节炎) 获FDA新药临床试验申请(investigational new drug,IND) 批准,是全球第二款向FDA递交IND的3D打印药物,也是中国首个进入注册申报阶段的3D打印药品。
2.3端到端连续制造过程
端到端连续制造过程指从连续多步合成原料药到最终剂型成型的整个生产过程。第一个以端到端连续制造过程生产的药品是阿利吉仑片,该片剂生产过程集成了原料药的合成(化学合成、分离、结晶、干燥) 和片剂生产过程(混合、双螺杆热熔挤出、包衣),减少了操作单元,大幅降低了生产成本。
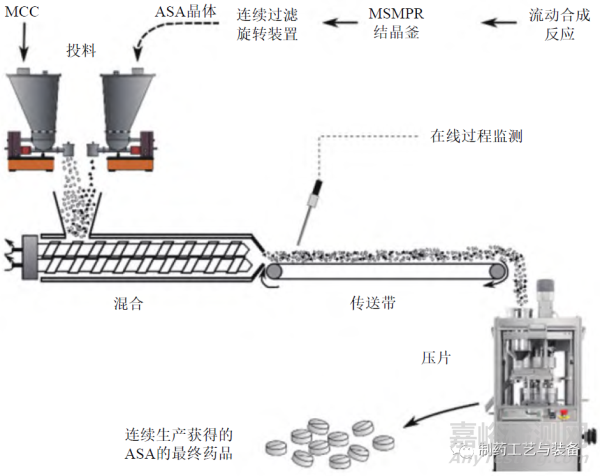
图5 端到端连续制造过程[25]
DOMOKOS 等在概念验证水平上开展了用于常规压片的固体制剂端到端连续制造的研究,如图5所示[25]。首先,乙酰水杨酸(acetylsalicylic acid,ASA) 的流动合成反应混合物在混合悬浮混合排料(mixed suspension mixed product removal,MSMPR)结晶釜中连续结晶,该结晶釜直接与连续过滤旋转装置相连,用于ASA 晶体的过滤和干燥;过滤后的材料通过螺旋给料机和微晶纤维素(MCC) 一起加入连续搅拌机中,通过集成的在线NIR 探头监测粉末混合物的均匀性;随后通过带式输送机将物料送入偏心型压片机中进行片剂的连续制造,通过离线的HPLC 法检测最终片剂中药物的含量及均匀性。
图6 试验工厂(A) 和按比例扩大的商业cGMP 生产线(B) 的布局[26]
美国CONTINUUS 制药公司的ICM试验工厂占地面积约为30.7 m2,如图6所示,其生产工艺总停留时间<30 h,生产量高达每小时约4800片(每年40.3×106片),与批制造相比,成本减少了35%~40%,单元操作次数减少了80%~ 85%,溶剂用量减少了55%,产生的总废物减少了30%,占地面积减少了90%[26]。
图7 试验工厂工艺流程图[26]
该工厂包括以下操作:溶解和过滤、反应结晶、过滤、干燥、挤出成型包衣(extrusion-moldingcoating,EMC)、溶剂回收以及相关的过程控制系统(DeltaV) 和PAT(如图7所示)。DeltaV 过程控制系统的交互式、可调整、灵活的图形用户界面可用于过程监控操作,通过实时调整过程参数来确保产品质量。该试验工厂的另一重要组成是PAT(如图8所示),可允许实时在线监测CQAs 和关键物料属性(critical material attributes,CMAs),以激活前馈和反馈控制;存在偏差时,控制系统可根据参数选择是否保留或转移物料,防止不合格物料进入下游制造过程,从而确保最终API 或药品的质量,实现实时放行测试。
图8 试验工厂相关PAT设计[26]
目前,越来越多的制药公司投入高额资金开发研究端到端的连续制造工艺,目的是希望能掌握显著节约成本、提高生产效率的工艺方法,为高质量和高安全性药品生产带来巨大的应用价值,从而实现药品连续制造的目标。
3、PAT在口服固体制剂连续制造中的应用
传统OSD批制造过程主要是采用离线方法对中间体或最终产品的质量进行分析检测,耗时较长且具有破坏性;而连续制造过程结合PAT可以对生产过程进行在线分析和控制,依据生产过程中的周期性检测、CQAs控制、原材料和中间产品的质量控制,大幅提高生产自动化水平,降低成本和减少人为错误,从而确保最终产品质量达到认可标准。
2004 年,FDA颁布了关于PAT的工业指南,积极推动在生产过程中引进自动化控制技术和手段,提高药品的质量和安全性;此外ICH在药物开发指南中规定了实时放行测试原则,即“中间产品和最终产品的质量,需要根据过程数据评估和确保。”因此,PAT在充分理解制药过程和严格控制生产流程方面发挥着重要的作用。
目前,PAT 常用检测分析技术主要有NIR和拉曼光谱(Raman spectroscopy,RS),其他包括太赫兹脉冲成像(terahertz pulsed imaging,TPI)、空间滤波技术(spatial filtering technology,SFT)、聚焦光束反射测量( focused beam reflectance measurement,FBRM)、微波共振技术(microwave resonance technology,MRT)、声发射(acoustic emission,AE) 和激光诱导荧光光谱(laser induced fluorescence spectroscopy,LIFS)等[24]。
3.1近红外光谱
NIR 的光谱吸收带是有机物中能量较高的化学键(主要是CH、OH、NH) 在中红外光谱区即700 ~ 2500 nm(波数14300 ~ 4000 cm-1)基频吸收的倍频、合频和差频吸收带叠加而成的。
目前,NIR 已越来越多地用于药品连续制造中的CPPs 和CQAs 的实时监测,可在无需制备样品的情况下进行快速、无损测量,提供包括药物定性、定量的多元化信息。NIR 监测药物生产过程中产生的大量光谱数据,可先经过光谱预处理(包括平滑、求导、多元散射校正、标准正态变换等方法)以消除噪声、排除基线或背景等干扰,从而得到有效的光谱信息,最后经过化学计量学方法如偏最小二乘法(partial least squares,PLS)、主成分分析法(principal component analysis,PCA) 等进行数据分析和建模,从而精准监测药物连续生产中的CQAs,如混合均匀性、粒度分布、水分含量等。
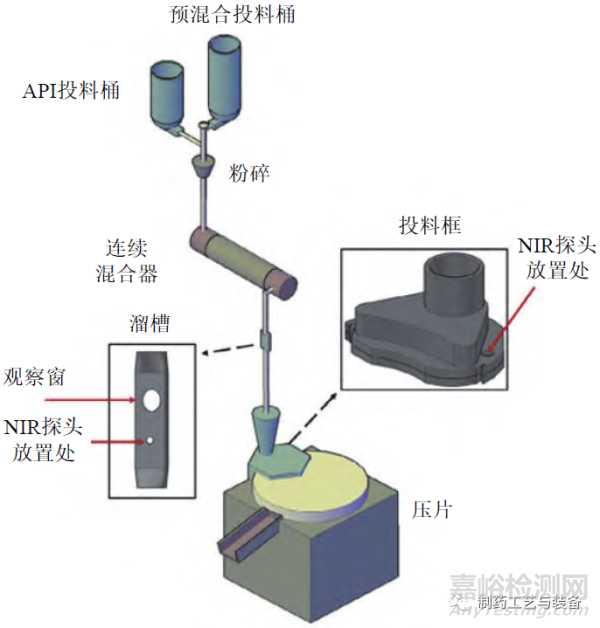
图9 NIR在连续直接压片的实时监测应用中探头位置示意图示[28]
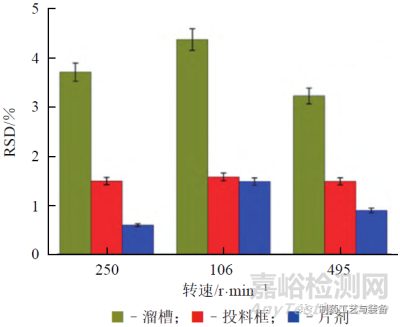
粉末混合均匀性是保证含量均匀性的首道工序[27]。SIERRA-VEGA 等开展了在连续混合器后的溜槽处和连续直接压片投料框中同时使用NIR探头监测粉末混合物均匀性的研究,具体如图9所示[28]。通过不同搅拌转速下溜槽内、投料框内和片剂中药物含量的相对标准偏差(RSD) 的比较结果可见,溜槽处是药物粉末混合均匀性测量和监测的最佳工艺位置(见图10)。
图10 不同搅拌转速下溜槽、投料框内和片剂中药物浓度RSD的比较(对乙酰氨基酚质量分数为10%)[28]
颗粒粒径分布(particle size distribution,PSD)在连续制粒中也发挥着重要的作用,过大的颗粒会导致压片过程中充模不足,细小颗粒过多会导致压片机黏冲或对最终质量特性产生影响。PAULI等通过PLS开发建立了3 种分析粒径分布特征值d(0.1)、d(0.5) 和d(0.9)的在线NIR 方法,来监测连续TSG 和流化床干燥过程中颗粒PSD 的变化,结果表明开发的模型具有可接受的准确性和精密度,可用于观察连续TSG和流化床干燥后颗粒PSD的突变和趋势[29]。ALCALÀ等利用光谱数据建立了基于PCA的定性多元模型和基于PLS 的定量标定模型,用于预测水分含量、PSD和堆密度等相关参数,得到了较好的结果[30]。VO等研究了傅里叶变换近红外光谱(Fourier transform near infrared spectroscopy,FT-NIR) 与化学计量法建模于在线热熔挤出过程监测中的应用,结果表明,在线FT-NIR分析是监测API含量和工艺参数的一种可行的工艺分析工具[31]。
3.2拉曼光谱(RS)分析
RS分析法是基于拉曼散射效应,对与入射光频率不同的散射光谱进行分析以得到分子振动、转动方面信息,并应用于分子结构研究的一种分析方法。RS可通过分析样品在532 ~ 1064 nm 波长范围内的单色光照射下的能量吸收能级差来定性鉴别药物种类,也可用于混合物、颗粒和片剂的混合均匀性、包衣厚度、粒度大小等CQAs的在线分析监测;RS与NIR一样都是能无损、快速检测且无需样品预处理的药物定量高度精确和灵敏的技术。
DE BEER等采用RS证明了混合速度、搅拌机负载和API浓度对达到设定混合均匀性所需的时间有显著影响,同时,利用NIR对结论的正确性进行了验证[32]。MENG 等在连续TSG过程中,采用3种在线PAT(EyeconTM3D 成像系统、NIR 和RS)实时监测和预测制粒过程中的CQAs,对3个关键工艺参数(液固比、桶温和输送量) 进行了30次全析因设计,用以评估每种分析技术的适用性[33]。最终结果证明EyeconTM 3D成像系统能成功捕获不同试验条件下的颗粒尺寸和形状变化,并对粒径参数d(0.1) 的波动表现出足够的灵敏性;基于NIR建立的PLS模型,对大部分颗粒物理性质的预测值具有较小的RSD(<5%);利用RS 预测药物含量并监测其固态转变,发现加水量和桶温对水化过程有相反的影响,尽管预测的咖啡因平均浓度略高于理论值,但整个制粒过程仍在控制限度之内。
3.3其他PAT工具
TPI已在医药领域广泛应用,因无损在线检测的优点,可用于药物的定性和定量分析。汪景荣等结合TPI和PLS等多元分析方法对不同产地的大黄进行了定性鉴别[34];DOHI等利用TPI无损分析了包衣片包衣层的特性,结果显示包衣表面反射率的RSD与表面粗糙度有良好的相关性,通过TPI测出的包衣层密度和界面密度差可以预测拉伸强度[35]。
HUANG等利用FBRM对高剪切湿法制粒过程中的粒子进行在线表征,基于质量源于设计(QbD)和PAT的理论, 增强了对制粒过程的理解[36]。FBRM® C35探针包含刮擦机制,可通过保持探针窗口洁净来确保每批测量结果一致;用以研究制粒过程中不同的含水量和湿法制粒时间对颗粒尺寸和数量的影响,结果显示FBRM能实时监测颗粒尺寸和数量变化的速率和程度,是一种有潜力的颗粒终点监测技术。
REIMERS等研究了基于PAT的流化床制粒反馈控制系统,采用在线SFT实时测量颗粒尺寸,在喷洒一定量黏合剂溶液后,确定了合适的目标颗粒尺寸控制变量,建立了合适的反馈控制策略用以调整颗粒的最终目标粒径在规定的范围内;进一步研究表明,该系统能够通过改变工艺和配方参数来实现预定义的目标粒径,为流化床制粒质量保证提供了一种新的途径[37]。
PETERS等将MRT 应用于特异性药物盐酸多奈哌齐的生产,设置不同工艺参数建立良好的水分含量预测模型,验证了MRT作为监测制粒过程中水分含量变化的PAT工具的可行性[38]。POUTIAINEN 等采用AE法测定了流化床制粒过程中的PSD,AE法对微小的扰动(如空气湍流) 非常灵敏,因而很适合稳定的制粒过程[39]。LIFS尤其适用于低浓度的成分,GUAY等验证了多变量LIFS分析仪在工业环境中监测颗粒粉末共混物的适用性[40]。
4、总结与展望
OSD的连续制造与批制造相比,具有可大幅降低成本和提高质量的优势,已经被制药行业广泛认可,并成为制药生产的热点话题,然而至今只有有限数量的药品被批准采用连续制造工艺。因而,在连续制造方面仍需加快创新的步伐。
目前在开展连续制造研究时仍需解决很多问题,如还需要开发更多、更精确的PAT工具用于在线监测;PAT检测器位置的选择和探头易污染的问题仍需继续研究解决;目前能够实时反馈调控、整合在完整连续制造过程的先进控制系统仍处于初步发展阶段。不过,随着科技的不断进步、新的在线分析检测仪器和先进的反馈控制系统与连续制造生产线的发展融合,中间产品和最终药品质量将会得到更精准的监测和控制,实现制药行业的转型升级。
参考文献
[1] 袁春平, 时 晔, 王 健, 等.口服固体制剂连续制造的研究进展[J].中国医药工业杂志, 2016, 47(11): 1457-1463.
[2] SINGH R, SAHAY A, KARRY K M, et al.Implementation of an advanced hybrid MPC-PID control system using PAT tools into a direct compaction continuous pharmaceutical tablet manufacturing pilot plant [J].Int J Pharm, 2014,473(1/2): 38-54.
[3] ARNUM P, WHITWORTH R.Continuous progress in continuous manufacturing [J].Pharm Technol, 2011, 35:44-47.
[4] VANHOORNE V, BEKAERT B, PEETERS E, et al.Improved tabletability after a polymorphic transition of deltamannitol during twin screw granulation [J].Int J Pharm,2016, 506(1/2): 13-24.
[5] BURCHAM C L, FLORENCE A J, JOHNSON M D.Continuous manufacturing in pharmaceutical process development and manufacturing [J].Annu Rev Chem Biomol Eng, 2018, 9: 253-281.
[6] 邹文博, 周桂勤, 罗苏秦, 等.过程分析技术在制药连续制造的质量控制策略[J].中国新药杂志, 2021, 30(10):937-946.
[7] U.S.Food a n d Drug A d i m i s t r a t i o n.Q u a l i t y considerations for continuous manufacturing - draft guidance[EB/OL].[2019-02-27].https://www.fda.gov/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/default.htm.
[8] The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use.Continuous manufacturing of drug substances and drug products [EB/OL].[2021-07-27].https://database.ich.org/sites/default/files/ICH_Q13_Step2_DraftGuideline_%202021_072.pdf.
[9] O'CONNOR T F, YU L X, LEE S L.Emerging technology:a key enabler for modernizing pharmaceutical manufacturing and advancing product quality [J].Int J Pharm, 2016,509(1/2): 492-498.
[10] PERNENKIL L, COONEY C L.A review on the continuous blending of powders [J].Chem Eng Sci, 2006, 61(2): 720-742.
[11] VANARASE A U, MUZZIO F J.Effect of operating conditions and design parameters in a continuous powder mixer [J].Powder Technol, 2011, 208(1): 26-36.
[12] LEE K T, KIMBER J A, COGONI G, et al.Continuous mixing technology: characterization of a vertical mixer using residence time distribution [J].J Pharm Sci, 2021, 110(7):2694-2702.
[13] ZHAO J, LI W L, QU H B, et al.Application of definitive screening design to quantify the effects of process parameters on key granule characteristics and optimize operating parameters in pulsed-spray fluid-bed granulation [J].Particuology, 2019, 43: 56-65.
[14] NARANG A S, STEVENS T, HUBERT M, et al.Resolution and sensitivity of inline focused beam reflectance measurement during wet granulation in pharmaceutically relevant particle size ranges [J].J Pharm Sci, 2016,105(12): 3594-3602.
[15] BYRN S, FUTRAN M, THOMAS H, et al.Achieving continuous manufacturing for final dosage formation:challenges and how to meet them.May 20-21, 2014Continuous Manufacturing Symposium [J].J Pharm Sci,2015, 104(3): 792-802.
[16] MENG W, KOTAMARTHY L, PANIKAR S, et al.Statistical analysis and comparison of a continuous high shear granulator with a twin screw granulator: effect of processparameters on critical granule attributes and granulation mechanisms [J].Int J Pharm, 2016, 513(1/2): 357-375.
[17] WILLECKE N, SZEPES A, WUNDERLICH M, et al.Identifying overarching excipient properties towards an indepth understanding of process and product performance for continuous twin-screw wet granulation [J].Int J Pharm,2017, 522(1/2): 234-247.
[18] BANDARI S, NYAVANANDI D, KALLAKUNTAV R, et al.Continuous twin screw granulation - an advanced alternative granulation technology for use in the pharmaceutical industry [J].Int J Pharm, 2020, 580:119215.
[19] DHENGE R M, CARTWRIGHT J J, DOUGHTY D G, et al.Twin screw wet granulation: effect of powder feed rate[J].Adv Powder Technol, 2011, 22(2): 162-166.
[20] CHEN K, BACHMANN P, BÜCK A, et al.Experimental study and modeling of particle drying in a continuouslyoperated horizontal fluidized bed [J].Particuology, 2017,34: 134-146.
[21] TEŻYK M, MILANOWSKI B, ERNST A, et al.Recent progress in continuous and semi-continuous processing of solid oral dosage forms: a review [J].Drug Dev Ind Pharm,2016, 42(8): 1195-1214.
[22] 梅庆胜.连续式包衣机的结构分析与工艺探讨[J].机电信息, 2018, (20): 10-14.
[23] Anon.Siemens and GEA partner to deliver solid-dosage continuous manufacturing [EB/OL].(2017-01-09)[2021-08-26].https://www.pharmtech.com/view/siemens-and-gea-partner-deliver-solid-dosage-continuousmanufacturing.
[24] VO A Q, KUTZ G, HE H, et al.Continuous manufacturing of ketoprofen delayed release pellets using melt extrusion technology: application of QbD design space, inline near infrared, and inline pellet size analysis [J].J Pharm Sci,2020, 109(12): 3598-3607.
[25] DOMOKOS A, NAGY B, GYÜRKÉS M, et al.End-toend continuous manufacturing of conventional compressed tablets: from flow synthesis to tableting through integrated crystallization and filtration [J].Int J Pharm, 2020, 581:119297.
[26] TESTA C J, HU C T, SHVEDOVA K, et al.Design and commercialization of an end-to-end continuous pharmaceutical production process: a pilot plant case study[J].Org Process Res Dev, 2020, 24(12): 2874-2889.
[27] ESBENSEN K H, ROMÁN-OSPINO A D, SANCHEZA, et al.Adequacy and verifiability of pharmaceutical mixtures and dose units by variographic analysis(Theory of Sampling) - a call for a regulatory paradigm shift [J].Int J Pharm, 2016, 499(1/2): 156-174.
[28] SIERRA-VEGA N O, ROMÁN-OSPINO A, SCICOLONE J,et al.Assessment of blend uniformity in a continuous tablet manufacturing process [J].Int J Pharm, 2019, 560: 322-333.
[29] PAULI V, ROGGO Y, KLEINEBUDDE P, et al.Realtime monitoring of particle size distribution in a continuous granulation and drying process by near infrared spectroscopy[J].Eur J Pharm Biopharm, 2019, 141: 90-99.
[30] ALCALÀ M, BLANCO M, BAUTISTA M, et al.On-line monitoring of a granulation process by NIR spectroscopy[J].J Pharm Sci, 2010, 99(1): 336-345.
[31] VO A Q, HE H, ZHANG J, et al.Application of FTNIR analysis for in-line and real-time monitoring of pharmaceutical hot melt extrusion: a technical note [J].AAPS PharmSciTech, 2018, 19(8): 3425-3429.
[32] DE BEER T R, VERCRUYSSE P, BURGGRAEVE A, et al.In-line and real-time process monitoring of a freeze drying process using Raman and NIR spectroscopy as complementary process analytical technology (PAT) tools[J].J Pharm Sci, 2009, 98(9): 3430-3446.
[33] MENG W, ROMÁN-OSPINO A D, PANIKAR S S, et al.Advanced process design and understanding of continuous twin-screw granulation via implementation of in-line process analytical technologies [J].Adv Powder Technol, 2019,30(4): 879-894.
[34] 汪景荣, 张卓勇, 张振伟, 等.偏最小二乘法和THz-TDS在正品大黄鉴别中的应用[J].光谱学与光谱分析, 2016,36(2): 316-321.
[35] DOHI M, MOMOSE W, YOSHINO H, et al.Application of terahertz pulse imaging as PAT tool for non-destructive evaluation of film-coated tablets under different manufacturing conditions [J].J Pharm Biomed Anal, 2016,119: 104-113.
[36] HUANG J, KAUL G, UTZ J, et al.A PAT approach to improve process understanding of high shear wet granulation through in-line particle measurement using FBRM C35[J].J Pharm Sci, 2010, 99(7): 3205-3212.
[37] REIMERS T, THIES J, STÖCKEL P, et al.Implementation of real-time and in-line feedback control for a fluid bed granulation process [J].Int J Pharm, 2019, 567: 118452.
[38] PETERS J, TAUTE W, DÖSCHER C, et al.Moisture monitoring in fluid-bed granulation by multi-resonance microwave sensor: applicability on crystal-water containing donepezil granules [J].AAPS PharmSciTech, 2018, 20(1): 6.
[39] POUTIAINEN S, MATERO S, HÄMÄLÄINEN T, et al.Predicting granule size distribution of a fluidized bed spray granulation process by regime based PLS modeling of acoustic emission data [J].Powder Technol, 2012, 228:149-157.
[40] GUAY J M, LAPOINTE-GARANT P P, GOSSELINR, et al.Development of a multivariate light-induced fluorescence (LIF) PAT tool for in-line quantitative analysis of pharmaceutical granules in a V-blender [J].Eur J Pharm Biopharm, 2014, 86(3): 524-531.
本文作者唐艺菲、吴闻哲、王健,中国医药工业研究总院药物制剂国家工程研究中心,来源于中国医药工业杂志,仅供交流学习。