今日头条
百济神州HPK1抑制剂报IND。百济神州1类化药BGB-26808片的临床试验申请获CDE受理。BGB-26808是新一代HPK1抑制剂,已于今年8月在Clinicaltrials.gov网站上注册一项Ⅰ期临床试验,拟评估与替雷利珠单抗联合治疗晚期实体瘤的安全性与有效性。HPK1是T细胞受体(TCR)信号通路下游的一种激酶,被认为在激活T细胞的过程中起到关键作用。值得一提的是,百济神州第一款HPK1抑制剂BGB-15025已处于Ⅰ期临床阶段。
国内药讯
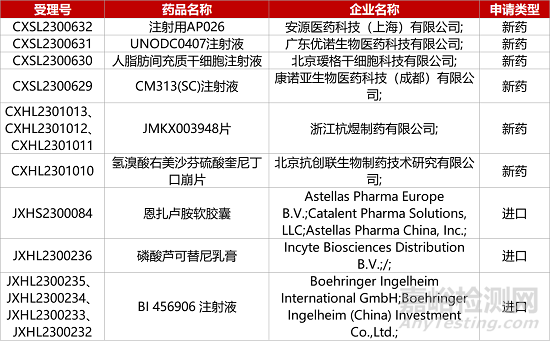
1.安斯泰来「恩扎卢胺」新适应症报产。安斯泰来雄激素受体信号抑制剂恩扎卢胺(商品名:Xtandi、安可坦)新适应症上市申请获CDE受理,治疗转移性激素敏感性前列腺癌(mHSPC)。在III期ARCHES研究中,与安慰剂和雄激素剥夺疗法(ADT)联用相比,Xtandi与ADT联用将患者出现放射学进展或死亡的风险降低61%。此前,该新药已获批用于治疗非转移性去势抵抗性前列腺癌(nmCRPC),以及转移性去势抵抗性前列腺癌(mCRPC)。
2.辉瑞JAK1抑制剂拟纳入优先审评。辉瑞口服JAK1抑制剂阿布昔替尼片(abrocitinib)的新适应症上市申请获CDE拟纳入优先审评,用于治疗难治性、中重度特应性皮炎12岁及以上青少年患者。在III期JADE TEEN研究中,与安慰剂组相比,阿布昔替尼组(100mg和200mg)患者实现IGA为0/1的比例更多(41.6%和46.2%,vs24.5%),达到EASI-75应答的患者比例也更多(68.5%和72.0%,vs41.5%)。此前,该产品已获批用于治疗难治性、中重度特应性皮炎成人患者。
3.恒瑞VEGFR2靶向TKI国际Ⅱ期临床积极。恒瑞医药选择性靶向VEGFR2的TKI创新药阿帕替尼治疗复发或转移性腺样囊性癌的国际Ⅱ期临床结果积极。数据显示,研究者及独立审查委员会(BIRC)评估的ORR分别为15.3%和9.7%;疾病控制率(DCR)分别为65.3%和66.7%;中位DOR分别为14.9个月和7.2个月;mPFS分别为9.0个月和9.0个月。mOS未达到。阿帕替尼单药方案安全性可控。详细数据已发表于Clinical Cancer Research(CCR)。
4.甘李口服GLP-1R激动剂报IND。甘李药业1类生物制品GZR18片的临床试验申请获CDE受理。GZR18是每周注射一次的长效GLP-1R激动剂肽类药物,拟开发用于成年患者的2型糖尿病(T2DM)的治疗或肥胖/超重患者的体重管理。GZR18注射液目前正在国内开展头对头II期临床,评估与司美格鲁肽(诺和泰)对比,治疗2型糖尿病患者的有效性和安全性。
5.康宁杰瑞联手远大蜀阳开发TFPI单抗。远大生命科学全资子公司远大蜀阳与苏州康宁杰瑞就后者临床后期、组织因子途径抑制物(TFPI)单抗药物KN057达成合作许可协议,将负责KN057在大中华区的市场推广和商业化销售。根据协议,康宁杰瑞将获得累计最高5亿元人民币的首付款和里程碑款,以及产品分级销售提成。康宁杰瑞将继续负责KN057针对血友病A和血友病B的后续临床研究、上市注册申请及产品供应。
国际药讯
1.DNA质粒疫苗黑色素瘤Ⅱ期临床积极。Scancell公司脱氧核糖核酸(DNA)质粒疫苗SCIB1联合检查点抑制剂(CPIs)治疗晚期黑色素瘤的Ⅱ期SCOPE试验结果积极。在可评估的11例患者中达到82%的客观缓解率(ORR),优于试验预定疗效目标70%的ORR;患者肿瘤体积减少31%-94%。在现实世界中,仅接受该CPI双药治疗患者报告的ORR为50%,无进展生存期为11.5个月。
2.创新微生物组合疗法结肠炎Ⅱa期临床积极。MRM Health公司微生物组联合疗法MH002治疗轻中度溃疡性结肠炎(UC)Ⅱa期临床达到主要终点。8周治疗期间,药物安全且耐受性良好;MH002治疗组患者达到Mayo内窥镜检查严重程度评分显著改善的患者比例高于安慰剂组;粪便钙卫蛋白(肠道炎症标志物)中位数降低42%(vs18%)。完整数据预计年底公布。
3.默沙东HIF-2α抑制剂获肾癌优先审评资格。默沙东“first-in-class” 缺氧诱导因子-2α(HIF-2α)抑制剂Welireg(belzutifan)的补充新药申请(sNDA)获FDA受理,用于治疗晚期肾细胞癌(RCC)经治患者。FDA同时授予其优先审评资格,PDUFA日期为2024年1月17日。2021年8月,FDA已加速批准Welireg上市,成为首个HIF-2α抑制剂,用于治疗包括肾细胞癌(RCC)等von Hippel-Lindau(VHL)疾病相关癌症。
4.马斯克“脑机接口”启动临床。马斯克脑机接口公司Neuralink开发的完全可植入的无线脑机接口(BCI)的新型医疗器械设备已获得独立机构审查委员会的批准,开始首次人体临床试验(PRIME研究)受试者招募。该项研究旨在评估BCI用于完全植入人脑的安全性和有效性,以帮助人类能够通过思想控制电子设备,使瘫痪患者再次行走。
5.基因药物公司ReCode完成2.6亿美元融资。基因药物公司ReCode Therapeutics宣布完成5000万美元的B轮扩展融资,使B轮融资金额累计已达到2.6亿美元。ReCode专有的选择性器官靶向(SORT)脂质纳米颗粒(LNP)平台是新一代的基因药物技术,能够精确递送到肝脏以外的目标器官和细胞,包括肺靶向、脾靶向、肝靶向等。目前,该公司开发的肺靶向治疗原发性纤毛运动不良症(PCD)的DNAl1 mRNA已进入临床阶段。
6.基因泰克入局多肽放射性偶联物赛道。罗氏基因泰克与PeptiDream将利用后者专有的多肽发现平台(PDPS),针对基因泰克选定靶点,合作开发多肽-放射性同位素(peptide-RI)偶联物。根据协议,PeptiDream将获得4000万美元的预付款,最高可达10亿美元的开发、监管和商业里程碑潜在付款,以及产品的销售分成。PeptiDream将保留合作产品在日本开发和商业化权利。
7.GSK研发部门人员调整。根据外媒报道,在高级副总裁兼研发主管John Lepore离任后,GSK将其研发部门划分为三个团队:呼吸和免疫学、疫苗和传染病以及肿瘤学。高级副总裁兼疫苗全球主管Phil Dormitzer将领导疫苗和传染病研发团队,高级副总裁兼肿瘤学发展全球主管Hesham Abdullah将领导肿瘤学研发团队,新加入GSK的Kaivan Khavandi将领导重组后的呼吸免疫团队。这三个团队将致力于初步发现和早期临床开发至II期临床研究。
医药热点
1.川大华西张本出任海南省人民医院院长。9月19日,海南省人民医院官方网站“领导团队”栏目更新信息显示,此前系四川大学华西公共卫生学院(华西第四医院)的张本院长已经出任海南省人民医院院长。根据公开信息,张本,男,汉族,1977年1月生,研究生,医学博士,中共党员。张本教授长期从事公共卫生与预防医学教育和研究及医院管理工作,主要研究方向为流行病学、职业卫生与职业医学、主动健康精准预防医学。
2.第二批罕见病目录公布。为进一步加强我国罕见病管理,提高罕见病诊疗水平,国家卫健委等六部门联合发布《第二批罕见病目录》。第二批罕见病目录中纳入发作性睡病、神经母细胞瘤、黑色素瘤、软骨发育不全、获得性血友病、肢端肥大症等86种罕见病;涉及血液科、皮肤科、风湿免疫科、儿科、神经内科、内分泌科等17个学科。截至目前,我国第一、第二批罕见病目录已纳入207种罕见病。
3.复旦大学变态反应及疾病研究中心成立。9月18日,由复旦大学附属华山医院牵头,附属眼耳鼻喉科医院、附属儿科医院、附属中山医院共同组建成立的“复旦大学变态反应及疾病研究中心”举行揭牌仪式。复旦大学和各家附属医院的优势学科强强联合,未来将重点开展变态反应及相关疾病的基础研究和临床研究,实现学科共建新理念,加快推动我国变态反应学科高速健康发展。
评审动态
1. CDE新药受理情况(09月19日)
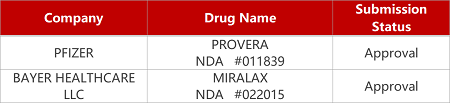
2. FDA新药获批情况(北美09月18日)