改良型新药从有效性、安全性和依从性三方面进行改良假设,此改良假设也是立题依据,最重要的是怎么获得改良假设的证据,证明临床优势。本文的思路为通过分析在2016年-2022年期间受理的,并最终获得批准的改良型品种的临床开发路径,以期为开发改良型新药提供借鉴。
首先明确一点,2.4类为新增适应症,严格意义上不属于改良型新药,新增适应症主要有两类,一是原研本身新增适应症,这其实是原研企业开发新药的一个基本路径策略,另外是非原研企业新增适应症。
所以本文统计未将2.4类列入。
1、提高安全性
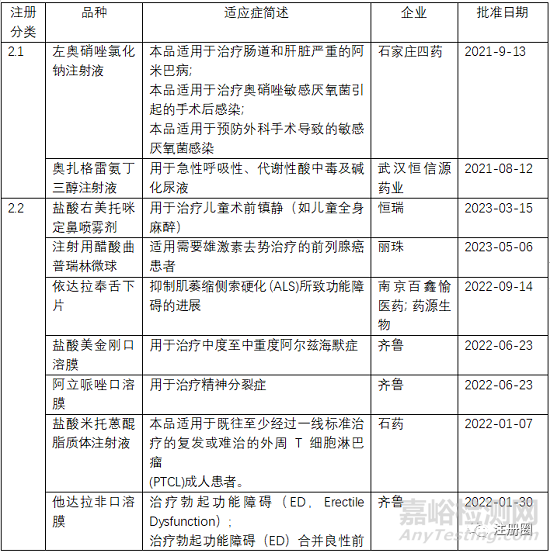
左奥硝唑氯化钠注射液
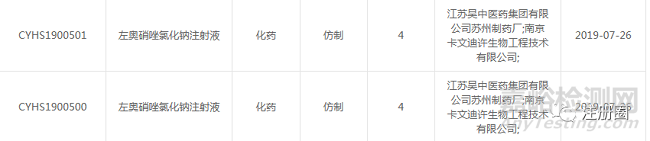
石家庄四药的左奥硝唑氯化钠注射液2018年7月获得CDE的受理承办,于2021年9月16日获得批准。
关于左奥硝唑氯化钠注射液最先申报的是南京圣和药业,2006年以1.3类申请临床,2009年批准100ml:左奥硝唑0.5g/氯化钠0.83g规格,2019年批准100ml:左奥硝唑0.25g/氯化钠0.87g规格。但是南京圣和的左奥硝唑氯化钠注射液的上市并没有给石家庄四药的注册申报带来任何影响,2018年以2.1类申报。而且南京圣和获批两个规格再次进行补充申请提交,于2019年获得批准。2019年之后国内企业则以4类进行申报。所以推测南京圣和2009年获批的技术审评要求不符合新的注册分类改革下的要求。
左奥硝唑是第三代硝基咪唑抗厌氧菌、抗原虫药物奥硝唑的左旋体。奥硝唑有左奥硝唑和右奥硝唑两种异构体,但是右奥硝唑会产生神经毒性的安全性问题,现已上市的的奥硝唑的安全性问题即是由于右奥硝唑的原因,所以开发单一的左奥硝唑,会提高安全性。
所以根据立题依据,临床试验证明有效性非劣效的情况下,能够提高安全性即可批准上市。
2、提高有效性,同时提高安全性
盐酸米托蒽醌脂质体注射液、注射用紫杉醇聚合物胶束
米托蒽醌和紫杉醇都是属于毒性很大的细胞毒药物,所以通过改变递送系统,增强靶向性,进一步提高安全性和有效性。
盐酸米托蒽醌脂质体注射液做了临床前的毒理试验,共进行了小鼠和犬单次给药毒性试验、大鼠静脉注射4次间隔4周毒性试验、犬静脉滴注4次间隔4周毒性试验,犬重复静脉输注本品 36 周(每 4 周 1 次)毒性试验。
PK药代动力学试验
关键II期临床试验(单臂多中心)有效性评价
13项安全性临床研究,共计307名患者
注射用紫杉醇聚合物胶束由于已有白蛋白、脂质体上市,本品仅需要I期药代动力学和耐受性研究和一项确证性临床进行安全性和有效性评价即可。
3、提高依从性
依达拉奉舌下片
依达拉奉注射液已被开发用于ALS,原研日本三菱田边的依达拉奉注射液2019年4月年申报进口,2019年7月批准进口。
ALS 需要长期治疗,本品是静脉注射剂改为舌下给药固体制剂,考虑到注射剂需长期住院输液治疗,舌下片剂能便捷、自主给药,可以极大提高用药的便利性和病人的依从性,从而保障患者获得充分的治疗和更好的疗效。所以该改良为提高依从性。
注射用醋酸曲普瑞林微球
醋酸曲普瑞林国内外已上市多年,现国产有4家醋酸曲普瑞林注射液,均为水针。法国Ipsen公司的曲普瑞林微球制剂于2003年进入中国,商品名达菲林。相比普通注射剂,注射用醋酸曲普瑞林微球为一个月注射一次的长效剂型,显著提高用药依从性。但是在已有微球制剂上市的情况下,丽珠是利用自己的技术平台以2.2类进行开发,并未按照原研的工艺等进行仿制。
临床开发路径是,开展PK试验,比较与达菲林的生物等效性,开展确证性临床证明有效性与安全性。
注射用利培酮微球
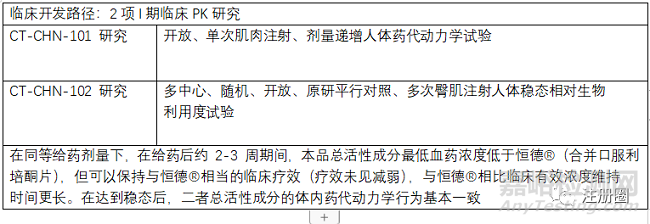
原研注射用利培酮微球(恒德)已经上市。但是原研在首次注射后有约 3 周的释药延迟期,患者需在 3 周释药延迟期内持续口服利培酮制剂,以保持临床有效血药浓度的稳定。本品注射用利培酮微球(II)通过释药方式的改良,缩短释药延迟期,不再需要首次注射后的口服制剂补充,提高临床治疗过程的便利性。
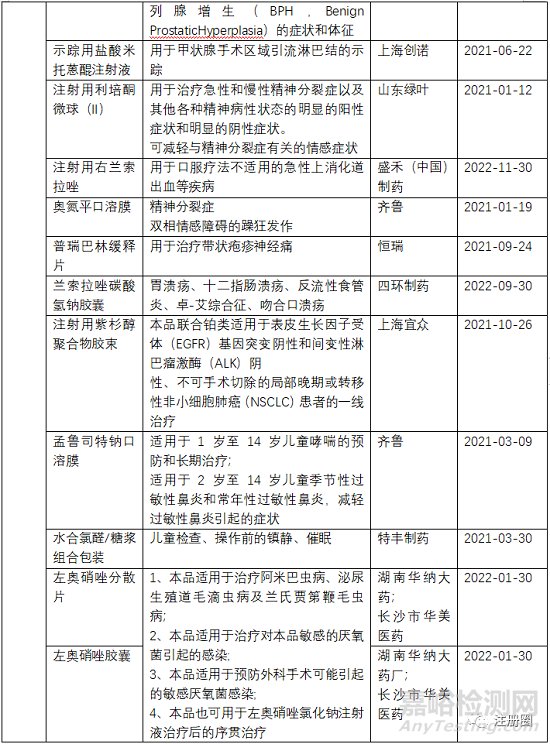
盐酸美金刚口溶膜、阿立哌唑口溶膜、他达拉非口溶膜、奥氮平口溶膜、孟鲁司特钠口溶膜
盐酸美金刚口溶膜和孟鲁司特钠口溶膜针对吞咽困难、不适宜吞咽药片的人群,提高该类人群的用药依从性。所以在已有盐酸美金刚口服溶液和孟鲁司特钠咀嚼片上市的情况下,仅需与口服溶液和咀嚼片做生物等效性试验,在生物等效的情况下,即可证明依从性优势。
阿立哌唑口溶膜和奥氮平口溶膜是为了解决精神分裂症患者的藏药行为,所以临床开发策略仅需与口崩片做生物等效性试验即可。
他达拉非口溶膜用于男性勃起功能障碍,相对于普通片剂,他达拉非口溶膜服用更便利,该口溶膜设计为薄薄的一片,类似口香糖,直接放入口腔,无需用水吞服,具有便利隐蔽性,保护隐私。证明与他达拉非片具有生物等效性即可。
盐酸右美托咪定鼻喷雾剂
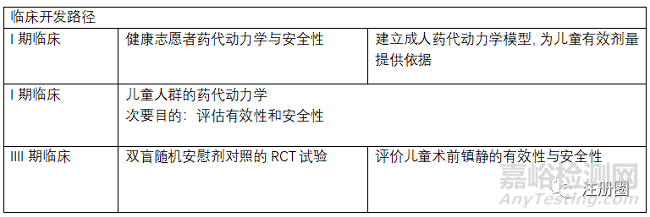
盐酸右美托咪定注射液于1999年首次获得FDA的批准,用于(1)行全身麻醉的手术患者气管插管和机械通气时的镇静;(2)重病监护治疗期间开始插管和使用呼吸机病人的镇静。恒瑞于2009年获得首仿批准上市,目前国内已有10+企业拥有该品种批文,另外恒瑞的盐酸右美托咪定氯化钠注射液于2021年获得批准,为国内独家。恒瑞再进一步,开发盐酸右美托咪定鼻喷剂,用于治疗儿童术前镇静(如儿童全身麻醉)。本品为开发用于专门人群的改良型剂量,相比注射剂,鼻喷雾剂对于儿童具有更好的用药便利性。
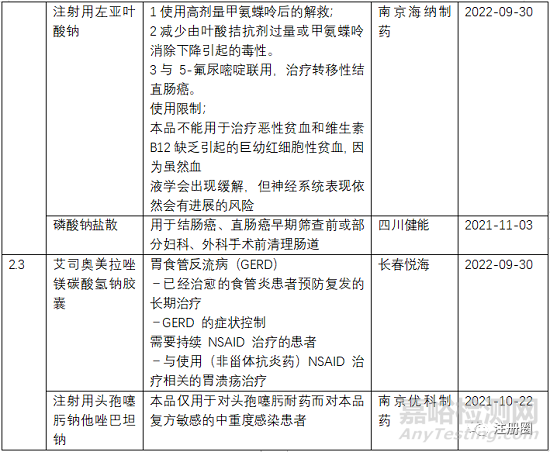
4、其他:减少耐药
注射用头孢噻肟钠他唑巴坦钠
注射用头孢噻肟钠他唑巴坦钠用于下呼吸道和泌尿系统的抗感染治疗,但是在抗感染药物的临床使用和研发中,一个突出的问题就是抗菌药滥用导致诱导耐药和细菌选择性压力日益严重,因此开发为固定剂量的联用复方可以降低单药的使用量,减少耐药问题。
临床开发路径:
(1)进行了单次和多次给药的药代动力学和耐受性研究。
(2)进行了两种药物的相互作用研究
(3)III期确证性临床进行有效性和安全性的评价
总结
创新药和仿制药的开发路径相对比较固定,而改良型新药的临床开发路径是最具灵活多变的,改良型新药基于风险获益等评估可以进行原研或者文献的数据借用。但是万变不离其宗,所有的变化都是基于风险获益评估。
提高安全性方面的逻辑,比如左奥硝唑氯化钠注射液,这是一个新的化学成分,新的化学成分一般要做非临床研究的安全性研究,但是因为现在已上市的奥硝唑中含有左奥硝唑,已经应用临床多年,所以不需要进行毒理研究。在证明提高安全性的情况下,仅需证明有效性非劣效,提高安全性。所以需要做个PK、然后做一个确证性临床。
提高有效性,像细胞毒药物,通过剂型改良,提高有效性,提高有效性就需要开展确证性临床,在确证性临床之前再开展PK研究,但是像米托蒽醌脂质体,因为脂质体的工艺相对普通注射液有很大不同,处方、辅料等有很大区别,风险未知,在开展临床之前,需要进行非临床的安全性评价。而像紫杉醇胶束,之前已经有同属高端注射剂的白蛋白和脂质体上市,已有临床应用数据,所以不需要开展非临床的毒理研究,仅需要PK和确证性临床(与紫杉醇普通注射液对照)。
提高依从性,提高依从性一般需要从两面证明一是证明与原型药物相比具有生物等效(改良型新药的生物等效与仿制药的生物等效是有所区别的);二是证明在改良后的更具依从性的给药途径与原型药物非劣效,即可证明依从性优势。但是关于非劣效下的依从性优势笔者多说一点,更好的改良应该通过提高依从性,进而提高有效性和减少医疗支出(这更有利于改良型新药的支付端定价),这是后话了。
总之,改良型新药开发虽然变化多端,但本质不变。就像药品注册分类的划分一样,不要硬背几类几类,划分的本质依据是基于风险获益评估的,这个方法论应用于改良型新药开发同样适用。