一、 前言
化学药品5.1类为境外上市的原研药品或和改良型药品,申请在境内上市。
目前关于境外已上市药品在国内申报上市,对临床数据的要求,已发布的指导原则包括:《接受药品境外临床试验数据的技术指导原则》、《境外已上市境内未上市药品临床技术要求》、《境外已上市境内未上市经口吸入制剂仿制药临床试验技术指导原则(试行)》。但以上指导原则仅阐述了一般性的原则,无法涵盖项目的多样化背景及对临床数据的要求。
本文中,笔者尝试梳理了5.1类化药在我国申请上市许可对临床试验的要求,供注册同仁参考。
二、 境外药品申请在境内上市的考虑要点
对于境外药品申请在境内上市,我们主要从以下四个维度考虑:中国患者临床需求、临床有效性和安全性、种族敏感性、中国患者获益和风险评估。
1)对于中国患者临床需求,从以下几点考虑:适应症在我国的流行病学现状、疾病严重程度和预后、现有治疗手段及其局限性、与国内现有治疗手段的比较优势。
2)对于临床有效性和安全性,从以下几点考虑:明确临床数据来源、评估境外临床试验数据质量、了解临床药理学特征、评估总体有效性和安全性。
3)对于种族敏感性,应参照ICH E5,关注中国患者人群与境外人群的PK、PD特征的差异,可能带来的有效性和安全性的影响,关注国内外疾病和医疗实践的差异。
4)基于以上几点,充分评估中国患者的获益和风险,是否支持上市。
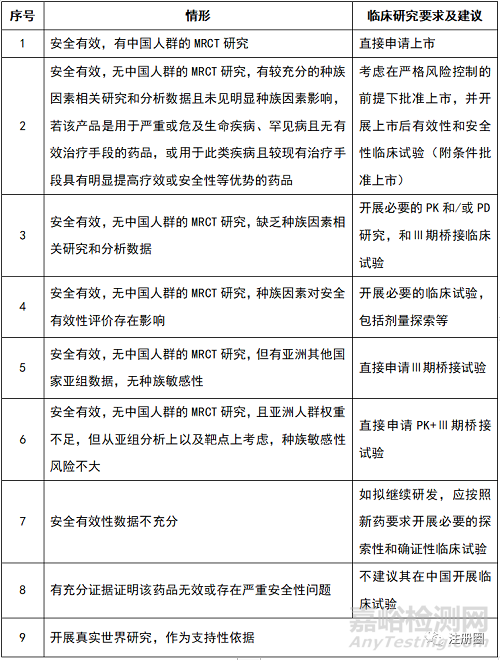
三、 5.1类化药在我国申请上市许可对临床试验的要求梳理【1~5】
▲表1- 5.1类化药在我国申请上市许可对临床试验的要求
对于上表中“Ⅲ期桥接试验”,可考虑采用替代终点,或者从统计学角度适当简化中国人群的临床试验。
对于上表中的第二种情况,“用于严重或危及生命疾病、罕见病且无有效治疗手段的药品”的范围包括:“关于公布第一批罕见病目录的通知(国卫医发〔2018〕10号)”,及CDE先后三次发布的“临床急需境外新药名单”(共81个品种)。
另外,上表中未包括境内已上市药品增加境外已批准境内未批准的新剂型(有临床优势的)、新给药途径、新用法用量、新适应症的情形。
对于境外药品持有人来说,如在临床研究早期即纳入中国受试者开展MRCT临床试验,则可以减少在中国人群中的探索性和确证性临床试验,加快全球同步上市的进程。
四、 结语
虽然我国已发布《境外已上市境内未上市药品临床技术要求》等指导性法规,但大家对法规/培训的理解不尽相同,且各项目的背景存在多样化的情形。笔者总结梳理了各家之言,以期助力5.1类化药在我国审批上市。
参考资料:
1)《接受药品境外临床试验数据的技术指导原则》。
2)《境外已上市境内未上市药品临床技术要求》。
3)CDE宣讲会“沟通交流申请中临床常见技术问题的考虑”。
4)由DIA中国RA社群主办、泰格医药和研发客支持的“新法规下3类药和5类化药临床研究和注册策略研讨会”资料,网址如下:https://xueqiu.com/4376152234/170795196
5)注册圈公开课“不同注册分类对临床试验的要求”。