今日头条
尚健抗肿瘤1类新药获批临床。尚健生物1类生物制品注射用SG1827获国家药监局临床试验默示许可,拟开发用于治疗晚期恶性实体瘤。SG1827可以在TCR刺激信号存在的情况下,特异性介导共刺激信号,激活T淋巴细胞。临床前研究显示,SG1827单药在多种肿瘤模型中显示出积极抗肿瘤活性;与PD-1抗体等免疫检查点抑制剂联用,协同发挥抗肿瘤活性。
国内药讯
1.强生BCMA/CD3双抗中国报产。强生旗下杨森BCMA/CD3双特异性抗体特立妥单抗注射液(teclistamab)的上市申请获CDE受理,用于治疗复发或难治性多发性骨髓瘤(r/rMM)。特立妥单抗旨在将CD3阳性T细胞募集到表达BCMA的骨髓瘤细胞附近,并且激活T细胞对肿瘤细胞进行攻击。去年8月,该新药首次获欧盟批准上市,用于治疗接受至少三种前期疗法的r/rMM患者,成为全球首款BCMA/CD3双抗。
2.天境长效生长激素III期临床成功。天境生物在2023年H1财报中透露,该公司引进的新型伊坦生长激素(TJ101,eftansomatropin alfa)在治疗儿童生长激素缺乏症的III期研究达到主要终点。与Norditropin(诺泽)相比,TJ101组第52周患者年化身高生长速率(AHV)达到非劣效性(10.76cm/年vs10.28cm/年,P<0.0001)。天境生物计划明年提交伊坦生长激素的上市申请。
3.和黄MET抑制剂拟纳入胃癌突破性品种。和黄医药口服小分子MET-TKI沃利替尼片(savolitinib)获CDE拟纳入突破性治疗品种,用于治疗既往至少二线标准治疗失败的MET基因扩增的局部晚期或转移性胃癌或胃食道连接部腺癌。savolitinib可阻断因突变(例如外显子14跳跃突变或其它点突变)、基因扩增或蛋白质过表达而导致的MET受体酪氨酸激酶信号通路的异常激活。此前,该新药已获批用于治疗MET外显子14跳跃突变的非小细胞肺癌患者。
4.石药CLDN6/CD137双抗获批实体瘤临床。石药集团旗下公司Novarock开发的CLDN6/CD137双抗NBL-028获FDA批准,即将开展用于治疗CLDN6表达晚期肿瘤患者的临床试验。NBL-028在与TME中的肿瘤细胞表面CLDN6结合的同时,选择性地激活T细胞及其他免疫细胞中的CD137共激通路,从而达到选择性杀伤肿瘤细胞的作用。该新药有望为睾丸癌、卵巢癌、非小细胞肺癌及子宫内膜癌等肿瘤患者提供新的治疗选择。
5.恒瑞上半年创新药营收50亿元。恒瑞医药公布2023年上半年业绩报告,上半年营收111.68亿元,同比增长9.19%;归属于上市公司股东的净利润23.08亿元,同比增长8.91%;研发投入23.31亿元,同比增长6.73%。目前,恒瑞医药已有13款自研创新药、2款引进创新药在国内获批上市,报告期内公司创新药收入达到49.62亿元(含税)。
国际药讯
1.再生元新一代C5单抗获批上市。再生元补体因子C5靶向单抗Veopoz(pozelimab)获FDA批准上市,成为针对CD55缺陷型蛋白丢失性肠病(CHAPLE)的首款疗法。这是一种由编码CD55蛋白的基因突变而无法调节补体活动导致的罕见遗传免疫疾病。在Ⅱ/Ⅲ期临床中,24周治疗结果显示,100%患者的血清白蛋白快速且持续恢复正常,且临床症状改善或无恶化。
2.VMAT2抑制剂获批治疗亨廷顿式病。Neurocrine公司VMAT2抑制剂Ingrezza(缬苯那嗪,Valbenazine)获FDA批准新适应症,用于治疗亨廷顿式病成人患者的舞蹈症状。III期研究结果显示,与安慰剂相比,Valbenazine治疗组患者16周时疾病评定量表(UHDRS)最大舞蹈症(TMC)评分显著降低(-4.6 vs. -1.4分;P<0.0001)。2017年4月,FDA已批准INGREZZA上市,用于治疗迟发性运动障碍(tardive dyskinesia)。
3.再生元CD3/CD20双抗向EMA报MAA。欧洲药品管理局(EMA)受理再生元CD3/CD20双抗odronextamab(REGN1979)上市许可申请(MAA),用于治疗复发/难治性滤泡性淋巴瘤(FL)和弥漫性大B细胞淋巴瘤(DLBCL)。在II期试验中,随访为17.1个月时,该新药在DLBCL患者中ORR和CR分别为53%和37%;在FL患者中,odronextamab的ORR和CR分别为82%和75%。再鼎医药拥有该产品的中国开发和商业化权益。
4.默沙东HIF-2α抑制剂肾癌Ⅲ期临床积极。默沙东“first-in-class” 缺氧诱导因子-2α(HIF-2α)抑制剂Welireg,在治疗经治晚期肾细胞癌的Ⅲ期临床LITESPARK-005达到主要终点。与活性对照相比,Welireg显著改善患者的无进展生存期(PFS);总生存期(OS)也呈改善趋势,但未达到统计学显著性。2021年8月,FDA已加速批准Welireg上市,成为首个HIF-2α抑制剂,用于治疗包括肾细胞癌(RCC)等von Hippel-Lindau(VHL)疾病相关癌症。
5.UGT1A1靶向基因疗法肝病早期临床积极。Généthon实验室靶向UGT1A1的AAV8基因疗法GNT0003治疗Crigler-Najjar综合征的Ⅰ/Ⅱ期临床结果发表在《新英格兰医学杂志》上。Généthon旨在通过一次性治疗,恢复患者的肝脏细胞生成UGT1A1的功能,降低胆红素的水平。试验结果显示,最高剂量组的3例患者的血清胆红素水平显著下降,且疗效可维持长达80周。此外,临床中没有发现严重副作用。
6.神经疾病口服肠菌疗法获罕见儿科疾病认定。Bloom Science公司口服肠道微生物治疗产品BL-001获FDA授予罕见儿科疾病认定,用于治疗Dravet综合征神经疾病。BL-001旨在复制生酮饮食的抗癫痫作用,调节γ-氨基丁酸(GABA)和其他关键的生物能量途径。在Ⅰ期临床中,BL-001在所有4个剂量组中均表现出良好的安全性和耐受性,支持比动物模型中的有效剂量水平高出10倍的用药剂量。
医药热点
1.2023年国家医保目录调整结果公布。8月18日,国家医保局发布《关于公示2023年国家基本医疗保险、工伤保险和生育保险药品目录调整通过初步形式审查的药品及相关信息的公告》,公示时间为:2023年8月18日-8月24日(一周)。此轮参与医保目录调整的申报信息共计629份,涉及药品570个,申报药品数目较去年有一定增加。经初步审查,390个药品通过初步形式审查。通过形式审查不等于纳入国家医保药品目录,后续还有专家评审、谈判竞价,预计11月公布新版目录。
2.湖南省乡村医生等级评定试点方案出台。近日,湖南省卫健委印发《湖南省乡村医生等级评定试点工作方案》,旨在通过分级评定、分类保障,绩效考核、安排入编等指标来加强基层人才队伍建设,保障乡村医生合理收入。根据《方案》补贴政策:一级村医每月补贴不低于800元;二级村医不低于500元;三级村医补贴标准是不低于300元。
3.中南大学湘雅医院揭示二甲双胍新药效。近日,中南大学湘雅医院大型研究团队使用小鼠模型来确定二甲双胍在骨质疏松和正常骨折愈合中的骨再生潜力的研究论文最新发表在《Bone Research》上。研究发现,在骨折愈合过程中,二甲双胍增加了H型血管和骨形成。其机制可能是二甲双胍通过抑制内皮细胞YAP1/TAZ,增加HIF-1α表达,从而促进体内外血管生成。
评审动态
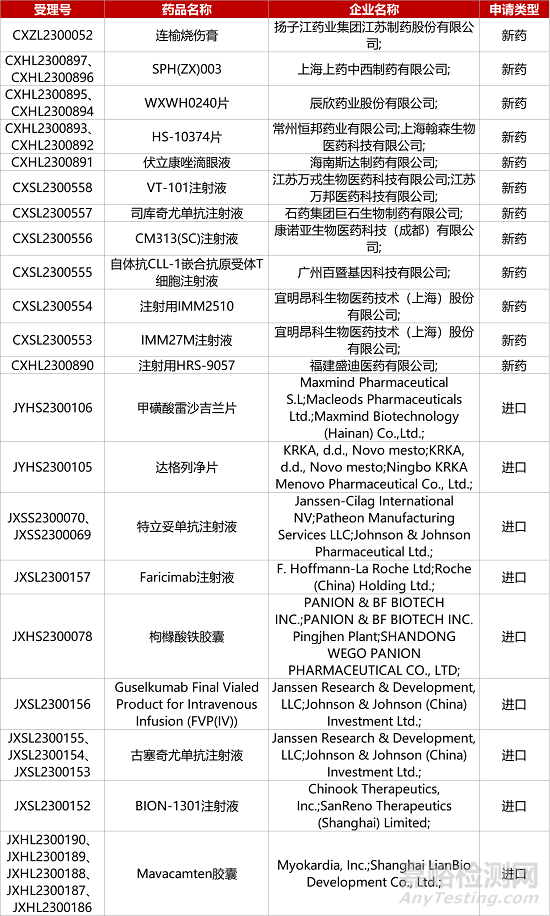
1. CDE新药受理情况(08月19日)
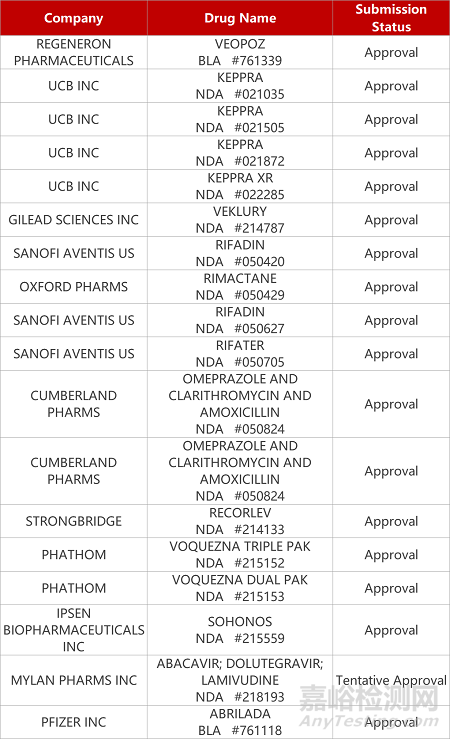
2. FDA新药获批情况(北美08月20日)