消毒产品相关证件审核是感控专职人员监管工作内容之一,随着国家“放管服”改革、消毒产品卫生安全评价规定、消毒产品卫生监督工作规范等标准的颁布与实施,感控专职人员如何对消毒产品进行监督管理、证件审核?在SIFIC 2022“全国感控与耐药感染” 联合大会上,国家卫健委消毒专业卫生监督专家、江苏省疾控中心顾健教授为大家答疑解惑。
一、消毒产品有关概念
消毒产品:包含消毒剂、消毒器械(含生物指示物、化学指示物和带有灭菌标识的灭菌物品包装物)和卫生用品。其中,纳入消毒产品生产类别分类目录的消毒剂、消毒器械、指示物和卫生用品等与人体健康相关的产品属于国家卫健委依法监督的消毒产品。
新消毒产品:利用新材料、新工艺技术和新杀菌原理生产的消毒剂和消毒器械。不包括抗(抑)菌制剂等卫生产品。其中新材料判定需依据GB 38850-2020 国家规范判定(季铵盐类消毒剂除外),同时可参考《季铵盐类消毒剂卫生要求》(GB/T 26369-2020)。
新工艺技术是指生产技术参数和/或工艺流程的改变,导致消毒剂和消毒器械的有效性、安全性和环境适应性等同或优于常规产品的生产加工技术。
新杀菌原理是指未列入新消毒产品判定依据中,消毒因子及其相应消毒器械清单、指示物清单的,以物理、化学、生物消毒因子或相互协同作用产生的杀菌原理及其指示物。
消毒产品卫生安全评价是对消毒产品有效性和卫生安全性进行的综合评价,评价内容包括以下内容:产品标签(铭牌)、说明书;产品检验报告(含结论) ;企业标准或质量标准;生产企业卫生许可证(境外允许生产销售的证明文件及报关单) ;消毒剂、指示物和抗(抑)菌制剂的产品配方、消毒器械的结构图等。
载体消毒剂是将消毒剂(液体、固体)通过一定方式与特定载体包括非织造布、织物、医用脱脂纱布、医用脱脂棉、医用海绵等结合的一次性使用产品。包括消毒湿巾、消毒干巾、消毒海绵、消毒棉球(签)等。
消毒湿巾是指以非织造布、织物、无尘纸或其他原料为载体,纯化水为生产用水,适量添加消毒剂等原材料,制成的具有清洁与消毒作用的产品,适用于人体完整皮肤(外科手消毒除外)、一般物体表面、中低医疗器械表面及其他物体表面。普通物体表面是指各种场所如学校、托幼机构、医疗卫生机构、公共场所、家庭等物品、用品、器械和设施的表面,以及墙面和地面(普通物体表面消毒剂通用要求GB 27952-2020 )。
二、消毒产品行业监管现状
1.纳入国家卫健委监督管理的消毒产品
第一类消毒产品是具有是具有较高风险,需要严格管理以保证安全、有效的消毒产品,包括用于医疗器械的高水平消毒剂和消毒器械、灭菌剂和灭菌器械、皮肤黏膜消毒剂(不包括手消毒剂)、生物指示物、灭菌化学指示物(特指灭菌效果指示物,不包括灭菌过程指示物)。
第二类消毒产品是具有中度风险,需要加强管理以保证安全、有效的消毒产品,包括除第一类产品外的消毒剂、消毒器械、化学指示物,以及带有灭菌标识的灭菌物品包装物、抗(抑)菌制剂。
第三类消毒产品是风险程度较低,实行常规管理可以保证安全、有效的除抗(抑)菌制剂外的卫生用品。包括隐形眼镜护理用品(含隐形眼镜护理液、隐形眼镜保存液、隐形眼镜消毒剂)、湿巾、卫生湿巾和其他卫生用品。
2.纳入国家药监局监督管理的消毒产品(医疗器械消毒灭菌器械)
参考国家食品药品监督管理总局修订文件《医疗器械分类目录》(2017年第104号)之医疗器械消毒灭菌器械说明。
1) 范围
本子目录包括非接触人体的、用于医疗器械消毒灭菌的医疗器械,不包括以“无源医疗器械或部件+化学消毒剂”组合形式的专用消毒器械。
2) 框架结构
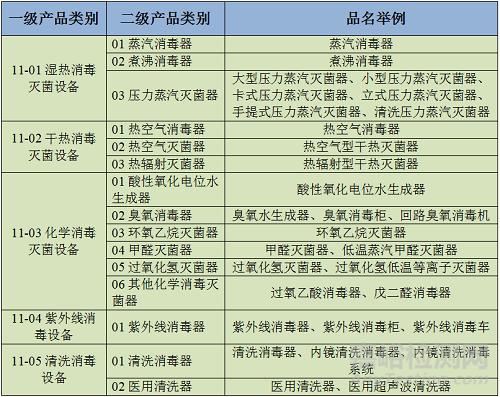
本子目录按照消毒和灭菌的原理、方式,即根据消毒技术特点建立框架。按照消毒和灭菌的原理、方式分为5个一级产品类别;按照产品特性分为15个二级产品类别,并列举30个品名举例。
在本子目录的一级、二级产品类别中,采用狭义的消毒和灭菌概念,从而把消毒器和灭菌器区别开来。按照先消毒器、后灭菌器顺序排序。该子目录中包括2002版分类目录中的《6857消毒和灭菌设备及器具》。
该子目录中一级产品类别与2002版分类目录产品类别的对应关系如下:
表1 与2002版分类目录的对应关系
表2 一二级产品类别及举例
3.未纳入卫健委、药监局监管的消毒产品(载体消毒剂、婴儿奶瓶消毒机等)
1) 载体消毒剂 T/WSJD 001-2019 《载体消毒剂卫生要求》(中国卫生监督协会)
a. 消毒湿巾、消毒干巾;
b. 碘伏消毒棉球、棉签、棉棒、海绵等,用于破损皮肤或粘膜消毒的消毒产品;
c. 酒精、碘酊或碘伏以外的皮肤或黏膜消毒液制成的消毒棉球、棉签、棉棒、海绵等,用于皮肤或黏膜或物表消毒的消毒产品;
2) 婴儿奶瓶消毒机;
3) 功能性湿巾、厨房湿巾、柔巾等。
三、卫健委依法监管的消毒产品医疗机构索证要求
《消毒管理办法》第七条规定,医疗卫生机构购进消毒产品,必须建立并执行进货检查验收制度。
《消毒管理办法》第四十一条规定,医疗卫生机构违反本办法第四条、第五条、第六条、第七条、第八条、第九条规定的,由县级以上地方卫生计生行政部门责令限期改正,可以处5000元以下罚款;造成感染性疾病暴发的,可以处5000元以上20000元以下罚款。
《医院感染管理办法》第八条规定,医院感染管理部门、分管部门及医院感染管理专(兼)职人员,具体负责医院感染预防与控制方面的管理和业务工作。对消毒药械和一次性使用医疗器械、器具的相关证明进行审核。
《消毒产品卫生安全评价规定》第十五条产品经营、使用单位在经营、使用第一、第二类消毒产品前,应当索取卫生安全评价报告和备案凭证复印件,其中卫生安全评价报告的附件包括检验报告结论、标签(铭牌)、说明书,进口产品报关单复印件。复印件应由产品责任单位加盖。
国卫监督发[2015] 90号:取消消毒产品卫生安全评价报告备案凭证,不要求索取。
《消毒产品卫生安全评价技术要求》WS 628-2018:规定了医疗机构索取卫生安全评价报告,包括基本情况表、 产品标签(铭牌)说明书、产品检验报告结论、国内消毒产品生产企业卫生许可证或进口消毒产品境外允许生产销售的证明文件及报关单。
《消毒产品卫生监督工作规范》第3 节消毒产品经营、使用单位的监督内容和方法,监督检查内容如下。
1) 建立消毒产品进货检查验收制度情况;
2) 索取国产消毒产品生产企业卫生许可证、消毒产品卫生许可批件或卫生安全评价报告和备案凭证情况;核对消毒产品名称、生产企业或在华责任单位名称以及消毒产品标签(铭牌)、说明书;
3) 检查消毒产品使用情况;
4) 消毒产品卫生监督抽检情况。
不同消毒产品要求索取证明文件要求不同,新消毒产品需生产企业卫生许可证复印件、产品卫生许可批件复印件;需要安全评价消毒产品,需卫生安全评价报告复印件,包含产品标签(铭牌)、说明书、产品检验报告结论、国产产品生产企业卫生许可资质、进口产品生产国(地区)允许生产销售的证明文件及报关单、其他卫生用品需企业卫生许可证复印件。
属于国家卫健委监督管理的消毒产品(如定制消毒器械、三新消毒产品、卫生湿巾等抗(抑)菌制剂以外的卫生产品)、以及不属于国家卫健委监督管理的消毒产品(如消毒湿巾、消毒干巾、消毒棉球等载体消毒剂、煮沸消毒器、婴儿奶瓶消毒器等)不需要卫生安全评价。
5) 消毒产品卫生安全评价主体及上市要求。
产品评价的主体为产品责任单位,上市需满足以下三点:产品责任单位应当在第一类、第二类消毒产品首次上市前自行或者委托第三方进行卫生安全评价,并对评价结果负责。国产消毒产品责任单位为生产企业,委托生产加工时特指委托方;进口消毒产品的责任单位为在华责任单位。卫生安全评价合格的消毒产品方可上市销售。
四、医疗机构查验消毒产品卫生安全评价报告要求
卫生安全评价报告需含有以下信息:基本情况表;产品标签(铭牌)、说明书;产品检验报告结论;国内消毒产品生产企业卫生许可证;进口消毒产品境外允许生产销售的证明文件及报关单。产品标签(铭牌)、说明书应符合《消毒产品标签说明书管理规范》(2005年版)以及GB 38598-2020《消毒产品标签说明书通用要求》。
医疗机构查验卫生安全评价报告需满足以下要求:
产品检验报告:检验项目应符合WS 628- -2018标准的要求;检验方法应符合相关标准和规范的要求;检验结果应符合相关标准和规范的要求----强制性标准检验结论应合格。
未经计量认证的检验方法,应提供两家检测机构的检验报告。
所有检验项目,应使用同一个批次产品完成,补做检验项目的,可使用不同批次,并重新测定有效成分含量、PH值,其中有效成分为非单纯化学成分的产品,应重新测定1项抗力最强的微生物杀灭试验和pH值。
国产消毒产品生产企业卫生许可证应在许可有效期内,生产项目及生产类别应与所评价产品相符,生产地址及法定代表人(负责人)信息应与卫生安全评价报告中基本情况表相应内容一致。
进口消毒产品境外允许生产销售的证明文件及报关单应符合原产国(地区)法律法规的规定。
总 结
顾健教授对国家放管服新形势下消毒产品监管新规进行了权威解读,使我们认识到医疗卫生机构购进消毒产品时,必须建立并执行进货检查验收制度,作为感控专职人员应熟悉、掌握国家相关法律法规、规范标准,杜绝不合格的消毒产品流入医院,切实保障医疗安全,做好保障医疗质量和患者安全的守门人。