今日头条
深圳翰宇司美格鲁肽原料药美国报DMF。深圳翰宇药业宣布其递交的司美格鲁肽原料药Type II DMF申请已获得FDA受理。司美格鲁肽是诺和诺德原研的一种GLP-1激动剂。根据诺和诺德2022年年度报告,司美格鲁肽注射液(Ozempic,降糖适应症)、司美格鲁肽口服制剂(Rybelsus,降糖适应症)和司美格鲁肽注射液(Wegovy,减肥适应症)2022年全球销售额分别约为593.32、112.2、61.45亿元人民币。目前,全球司美格鲁肽尚无仿制药获批上市。
国内药讯
1.诺华PNH新药中国报产。诺华潜在“first-in-class”口服补体途径因子B的抑制剂盐酸伊普可泮胶囊(iptacopan)上市申请获CDE受理,用于成人阵发性睡眠性血红蛋白尿症(PNH)患者的治疗。在关键Ⅲ期APPOINT-PNH研究中,iptacopan治疗24周后,约92.2%的患者在不需要输血的情况下血红蛋白水平提高2 g/dL以上;估计97.6%的患者实现了不需要红细胞输注。目前,该新药已被CDE纳入优先审评。
2.甘李「门冬胰岛素」生物类似药美国报BLA。甘李药业生物类似药门冬胰岛素注射液的生物制品许可申请(BLA)获FDA受理。门冬胰岛素注射液是一种速效胰岛素类似物,又称餐时胰岛素,皮下注射后10~20分钟内起效,可有效地控制餐后血糖。该药原研产品NovoRapid由诺和诺德开发。2022年,NovoRapid全球销售额为154.6亿丹麦克朗(约22.16亿美元),其中美国市场销售额为56.41亿丹麦克朗(约8.09亿美元)。
3.百济神州3款抗体药物获批临床。百济神州申报的3款新药分别获得CDE临床试验默示许可,分别为:抗TIM-3抗体BGB-A425注射液、抗LAG-3抗体LBL-007注射液以及抗PD-1单抗替雷利珠单抗。这3款新药获批临床的适应症均为:复发性或转移性头颈部鳞状细胞癌。根据ClinicalTrials官网信息,百济神州正在海外开展一项Ⅰ/Ⅱ期临床,评估BGB-A425联合替雷利珠单抗联合/不联合LBL-007治疗晚期实体瘤的安全性、耐受性和初步抗肿瘤活性。
4.济民可信GARP/TGF-β1单抗国内获批临床。济民可信1类生物制品注射用JYB1907获国家药监局批准开展Ⅰ期临床试验,评估用于治疗晚期恶性实体瘤的安全性、耐受性和药代动力学特征以及初步疗效。JYB1907通过特异性结合GARP/TGF-β1,阻断GARP介导的TGF-β1的释放,逆转肿瘤微环境中的免疫抑制效应,提高抗肿瘤免疫应答。今年1月,该新药已在美国获批IND申请。
5.苏州拓创创新三抗国内报IND。拓创生物靶向EGFR、cMET和VEGF的新型多特异性抗体TAVO412注射液的临床试验申请获CDE受理。TAVO412旨在肿瘤微环境条件下通过多靶点的协同效应提高抗肿瘤疗效。临床前多项动物模型数据已表明,TAVO412在众多实体瘤领域包括肺癌、胰腺癌、三阴乳腺癌、胃癌等表现出良好的疗效及安全性。去年11月,该新药已获FDA临床批件。
6.苏州映恩创新ADC国内报IND。映恩生物基于拓扑异构酶-1抑制剂开发的第三代ADC产品注射用DB-1311的临床试验获CDE受理。在临床前研究中,DB-1311已在多种癌症类型肿瘤模型中显示出强大的抗肿瘤活性,并且在临床前安全评估中展现出良好的耐受性和良好的药代动力学特征。今年4月,映恩生物已授予BioNTech公司在大中华区外全球开发、生产及商业化DB-1303和DB-1311的权利。
7.安斯泰来与睿跃生物合作开发蛋白降解疗法。安斯泰来与睿跃生物将利用后者具有新型E3配体的靶向蛋白降解平台uSMITE,合作开发多个创新型蛋白降解候选药物。uSMITE平台能够让药物设计范式超越功能位点抑制,让“难以靶向”的酶和蛋白质调控成为可能。根据协议,睿跃生物将获得3500万美元的预付款,总金额可能超19亿美元的进一步开发和商业化里程碑后期付款等。
8.歌礼制药终止两款产品开发。歌礼制药日前在企业公告中透露,歌礼制药将终止治疗肝癌的候选药物ASC06以及HIV蛋白酶抑制剂ASC09的开发。歌礼制药表示,ASC06采用的RNA干扰递送技术已成为早期技术且已过时,该药物无法展现如先前预测的市场竞争优势;与ASC09相同适应症的HIV融合抑制剂药物已在中国获批上市,并成为治疗HIV 1型感染的主流药物,ASC09已失去竞争优势。
国际药讯
1.FDA咨询委员会将审查渐冻症干细胞疗法BLA。Brainstorm Cell公司宣布FDA将于今年9月27日召开细胞、组织和基因疗法咨询委员会 (ADCOM) 审查其间充质干细胞疗法NurOwn的生物制品许可申请(BLA),针对的适应症为肌萎缩侧索硬化症 (ALS)。在Ⅲ期临床中,NurOwn与安慰剂相比,达到临床缓解的患者比例(31%vs28%)不具有统计学意义;但在症状较轻的患者亚群中,NurOwn显著改善患者ALSFRS-R评分(p=0.050)。
2.默沙东NASH新药Ⅱ期临床积极。默沙东GLP-1R/GCGR双重激动剂efinopegdutide将在EASL年会上公布治疗非酒精性脂肪性肝病的Ⅱa期临床积极结果。与司美格鲁肽活性对照组相比,efinopegdutide治疗组24周后患者的肝脏脂肪水平减幅更大(72.7%vs42.3%),两组患者体重平均减轻8.5%和7.1%(p=0.085)。目前,该新药已获得FDA授予的快速通道资格,用于治疗非酒精性脂肪性肝炎(NASH)患者。
3.Inventiva公司泛PPAR激动剂Ⅱ期试验积极。Inventiva公司口服泛PPAR激动剂lanifibranor治疗非酒精性脂肪肝病(NAFLD)和2型糖尿病(T2D)的Ⅱ期临床达到主要终点。与安慰剂相比,lanifibranor治疗24周后显著减少患者肝内甘油三酯(IHTG)水平(44%vs12%),两组患者肝脂肪减少30%以上的比例分别为65%vs22%(p=0.008),NAFLD缓解率分别为25%vs0%(p=0.048)。药物耐受性良好,没有发现安全性问题。正大天晴拥有该产品在大中华区开发和商业化的权益。
4.STAT3靶向蛋白降解剂早期临床积极。Kymera公司靶向STAT3的潜在“first-in-class”蛋白降解剂KT-333治疗实体瘤以及周边和皮肤T细胞淋巴瘤的Ⅰa期临床结果积极。KT-333显示出剂量依赖性的STAT3降解,在外周血单核细胞(PBMCs)中平均最大降解水平达88%,并有STAT3通路受抑制和外周血中炎症生物标记物下调的迹象。研究中未观察到剂量限制性毒性(DLTs)。详细数据将在2023年的国际恶性淋巴瘤大会(ICML)上公布。
5.二甲双胍或可降低长新冠发病率。由帕萨默斯基金会支持、明尼苏达大学等研究人员开展评估二甲双胍、伊维菌素和氟伏沙明用于治疗新冠感染患者的COVID-OUT研究成果发表在《柳叶刀·传染病》杂志上。试验发现,在新冠症状出现后7天内服用二甲双胍的患者患长期新冠的可能性比服用安慰剂的人低41%,如果在4天内开始服用二甲双胍,则可能性降低了63%。
6.CD33靶向CAR-T暂停临床研究。2seventy bio公司靶向CD33的CAR-T疗法SC-DARIC33在治疗急性髓系白血病(AML) 的I期PLAT-08研究已被合作伙伴西雅图儿童医院暂停。在该试验中,接受第二剂量水平治疗的首例患者因发生5级(致命)严重不良事件(SAE)而死亡。目前,2seventy bio公司正在调查该SAE的根本原因以及其与研究药物的潜在关联,并与FDA沟通该研究的潜在后续步骤。
医药热点
1.邓旭亮任北京大学口腔医院院长。2023年6月14日下午,北京大学口腔医院新一届行政班子任命宣布会在教学楼报告厅召开。会上宣布了北京大学口腔医院新一届行政领导班子人选,邓旭亮接替郭传瑸担任北京大学口腔医院(口腔医学院)院长,蔡志刚、江泳、胡文杰任副院长。邓旭亮代表新一届行政领导班子发言并做出承诺,未来新一届班子成员将全面落实党委领导下的院长负责制,全力以赴地带领全院师生员工跑好北大口腔创新发展的新征程。
2.16项辅助生殖项目7月起纳入北京医保。6月15日,北京市医保局发布通知,自7月1日起,16项治疗性辅助生殖技术项目将纳入本市基本医疗保险报销范围。16项治疗性辅助生殖技术项目具体包括:促排卵检查、精子优选处理、精子优选处理-密度梯度离心法、宫腔内人工授精术、精液冷冻复苏、经阴道穿刺采卵术、胚胎形态学评估、囊胚培养、体外受精胚胎培养、胚胎移植术、卵母细胞胞浆内单精子注射、胚胎单基因病诊断、染色体疾病的植入前胚胎遗传学检测、囊胚/卵裂球/极体活检术、睾丸/附睾精子分离、冷冻胚胎复苏等。
3.诺和诺德投资新工厂扩大产能。诺和诺德日前宣布今年将投资159亿丹麦克朗(约23亿美元)扩大丹麦希勒勒现有的活性药物成分(API)生产设施,以保证未来严重慢性病领域临床后期产品组合的产能并满足市场需求。新的生产工厂面积约65000平方米,生产流水线将覆盖多个产品。新工厂将于2029年投入使用,建成后将产生340个新的工作岗位。
4.恒瑞医药入选全球医药研发TOP 25。Informa Pharma Intelligence按照临床研发规模评选的“全球医药企业研发管线规模TOP25”榜单显示,恒瑞医药因近年来研发管线数量大幅增加,排名从第16位上升至第13位。据悉,该公司近十年其累计研发投入292亿元,目前已有瑞维鲁胺、卡瑞利珠单抗等12款自研创新药和一款引进创新药在中国上市,另有80多个自主创新产品正在临床开发,260多项临床试验在海内外开展。
评审动态
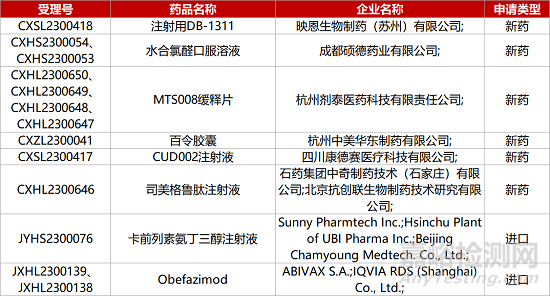
1. CDE新药受理情况(06月15日)
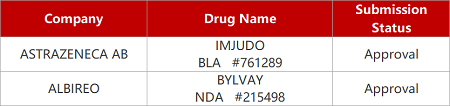
2. FDA新药获批情况(北美06月14日)