背景
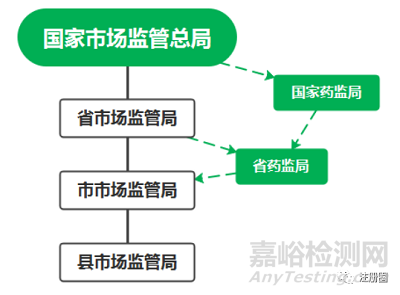
2018年药品监管体系发生重大变革,这个变革的大背景就是国务院机构改革,5年一次的机构改革和全国人大时间同步。本次改革有关药品监管有个重要的调整,组建国家市场监督管理总局,不再保留国家工商行政管理总局、国家质量监督检验检疫总局、国家食品药品监督管理总局。将国家工商行政管理总局、国家质量监督检验检疫总局、国家食品药品监督管理总局、国家发改委价格监督检查与反垄断执法、商务部经营者集中反垄断执法以及国务院反垄断委员会办公室等职责整合,组建国家市场监督管理总局,作为国务院直属机构,行政级别为正部级。但是,由于药品监管专业性强,为了保证药品监管的相对独立性,专门组建了国家药品监督管理局,隶属国家市场监督管理总局,所以国家药品监督管理局在行政级别上为副部级。
此次机构改革使得药品的监管和法规体系同时发生一定的变化和调整。
一、 药品法律法规体系
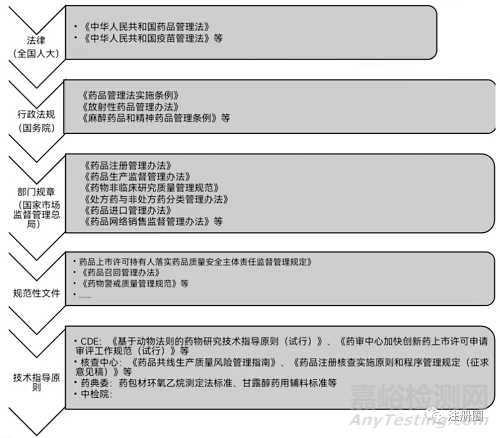
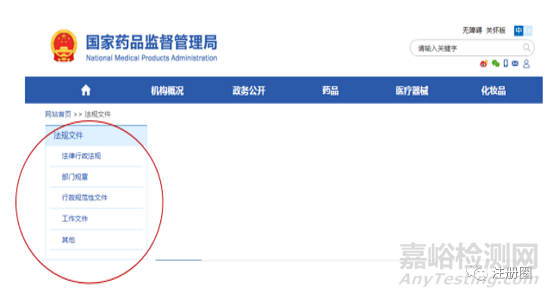
不同的行政级别以及机构划分作为制定有关法律法规和部门规章时的依据。我国的法律体系是以宪法为统帅,以法律为主干,以行政法规和地方性法规为重要组成部分。具体到立法形式有6种,(1)法律;(2)行政法规;(3)地方性法规;(4)自治条例和单行条例;(5)国务院部门规章;(6)地方政府规章。
具体到药品领域的立法形式基本只包括法律;行政法规;部门规章。
2.1 法律
法律,由全国人大(常委会)审议通过并颁布,一般以中华人民共和国开头,比如<<中华人民共和国药品管理法>>。在药品监管法律体系里,属于最高效力的上位法。另外像<<中华人民共和国疫苗管理法>>也是由全国人大(常委会)审议颁布,与药品管理法具有同级别的法律地位。
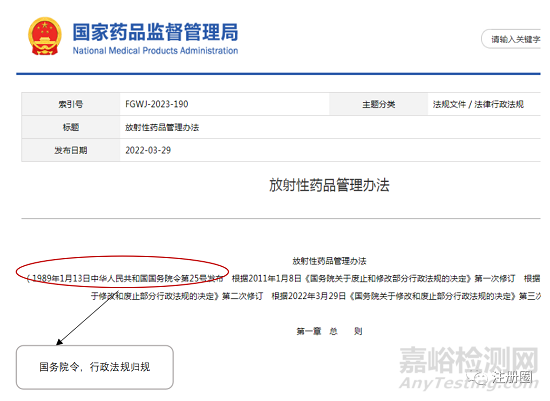
2.2 行政法规
行政法规,由国务院,常以实施条例、管理办法等作结尾,如<<药品管理法实施条例>>、《放射性药品管理办法》
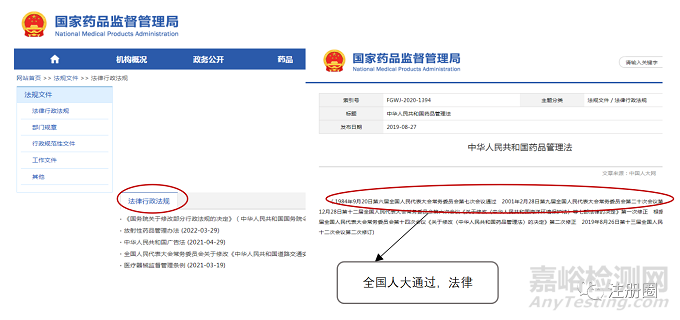
2.3 部门规章
部门规章,由国务院的部委、直属机构等制定发布实施,具体到药品领域,就是由国家市场监督管理总局制定发布,因为国家市场监督管理总局是国务院的直属机构,属于正部级,国家药品监督管理局为副部级。如《药品注册管理办法》。
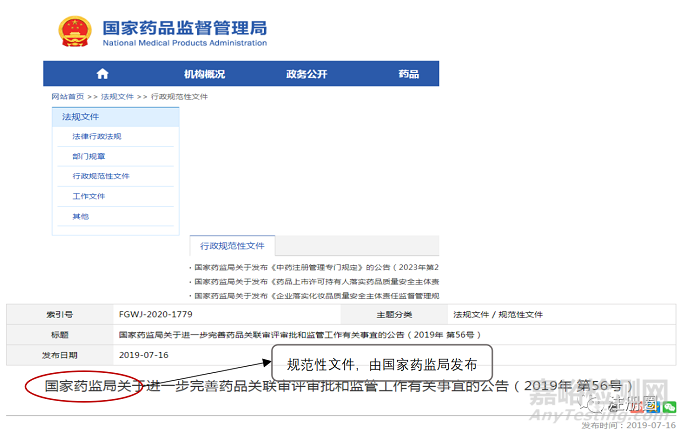
2.4 规范性文件和技术指导原则
像药品监管领域中的规范性文件、技术指导原则等虽不是立法形式的范畴,但是在药品法律法规监管体系中是非常重要的组成部分。确切地说,大量具体的细化的规定都在规范性文件和技术指导原则中,该部门的文件由国家药监局和其直属机构(如审评中心、核查中心等技术支持部门)制定发布,常以“规范”、“规定”等结尾。如《药品上市许可持有人落实药品质量安全主体责任监督管理规定》、《药品召回管理办法》、《药物警戒质量管理规范》。
以上的法律法规文件,难免疏漏,但是最重要的是学会查询以及分清法律法规文件的层级关系,从底层逻辑上把握,避免被大量的法律法规文件弄得无头绪。特别是规范性文件和指导原则,数量很多,这里只是挑选几个做示例展示,重点是掌握查询方法。
二、 药品监管组织体系
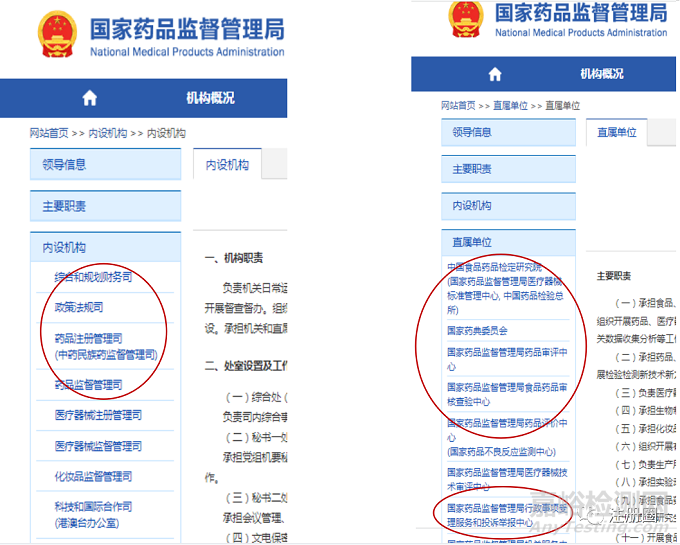
国家药监局和地方药监局共同组成我国的药品监管组织体系,下文将详细介绍国家药监局与地方的关系,本部分详细介绍国家药监局的构成。概括的说国家药监局由内设机构和直属机构组成。
直属机构是作为国家药监局的技术支持机构来运行,其中与药品研发注册生产等关系最为密切的有中国食品药品检定研究院、国家药典委员会、国家药品监督管理局药品审评中心、国家药品监督管理局食品药品审核查验中心、国家药品监督管理局药品评价中心和国家药品监督管理局行政事项受理服务和投诉举报中心。
中国食品药品检定研究院,承担药品、药用辅料和药包材等的检验检测;承担药品的质量标准、技术要求、检验检测方法制定。
国家药品监督管理局药品审评中心,负责药物临床试验、药品上市许可申请的受理和技术审评;负责仿制药质量和疗效一致性评价的技术审评。
国家药品监督管理局食品药品审核查验中心,承担药物临床试验、非临床研究机构资格认定(认证)和研制现场检查。承担药品注册现场检查。承担药品生产环节的有因检查。承担药品境外检查。
另外药品注册中的“三合一”,即是中检院的注册样品检查+审评中心的技术审评+核查中心的注册现场检查。
国家药典委员会,国家药品标准的制定;《中国药典》收载品种遴选;药品通用名称命名。
国家药品监督管理局药品评价中心,组织开展药品不良反应监测;开展药品上市后安全评价;拟定调整非处方药目录。
国家药品监督管理局行政事项受理服务和投诉举报中心,药品行政事项的受理;审批结果相关文书的制作、送达;注册费用的收费。
但是,需要说明的是,《国家食品药品监督管理总局关于调整部分药品行政审批事项审批程序的决定》2017年5月1日起施行,药物临床试验、药品补充申请、进口药品再注册行政审批事项由审评中心作出。《关于调整药品注册受理工作的公告》(2017年第134号)2017年12月1日起,由国家局审评审批的注册申请均由国家局受理,如新药临床试验申请、新药生产申请、仿制药申请,国家局审批的补充申请以及与国产药品注册申请关联申报的药包材、药用辅料申请等。由省级食品药品监管部门审批的药品注册申请仍由省级食品药品监管部门受理。
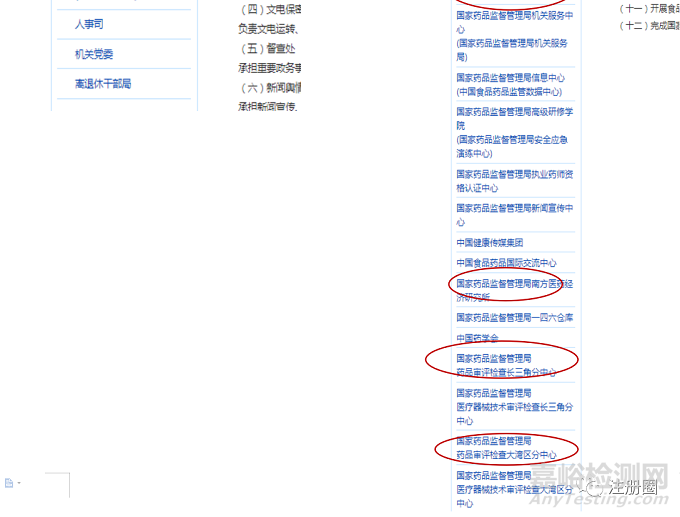
2020年新成立的药品审评检查长三角分中心、药品审评检查大湾区分中心均属于国家药监局的直属机构,不是地方机构。
三、 国家药监局与地方药监局(省局)的关系
省级药监局在药品监管中主要的职责在于生产环节,具体为生产许可的审批监管(现在分为A证、B证、C证);上市前的GMP检查(该环节常与注册现场核查同步进行);上市后的日常生产检查。另外,省局还有一个职能是境内药品生产再注册的受理审批;药品上市后变更的备案。
|
省局的职责 |
|
|
1 |
生产许可的审批监管(A证、B证、C证) |
|
2 |
上市前的GMP检查 |
|
3 |
境内药品生产再注册的受理审批 |
|
4 |
药品上市后变更的备案 |
|
5 |
上市后的日常生产检查 |
另外,2018年机构改革后,新的监管模式从纵向上体现“省以上单列+省以下综合”的机构设置。即省以上药品监管机构单列,如国家药监局和省药监局,国家药监局是国家市场监管总局的二级局,同样地,省药监局是省市场监管局的二级局,而在市县层面,并没有将药监局单列,药品监管职责统一交由市场监管局承担。这是因为市县监管的重点在药品流通和使用环节,管理的特征体现市场规律和价格机制,因此交由市场监管局管理而不用设立专业的药监局。