今日头条
和誉CSF-1R抑制剂获欧盟PRIME。和誉医药创新CSF-1R抑制剂pimicotinib(ABSK021)获欧洲药品管理局(EMA)授予优先药物资格(PRIME),用于治疗不可手术的腱鞘巨细胞瘤(TGCT)。ABSK021通过阻断CSF1/CSF-1R信号通路来调节和改变巨噬细胞功能,在多种巨噬细胞相关疾病中发挥作用。公布于ASCO2023年会上的Ⅰb期临床数据显示,Pimicotinib(50mg QD)剂量组达到77.4%的客观缓解率,有87.5%患者维持客观缓解长达25周。
国内药讯
1.瓴路CD19靶向ADC拟纳入优先审评。瓴路药业注射用loncastuximab tesirine获CDE拟纳入优先审评,用于治疗二线或多线系统治疗后复发或难治性大B细胞淋巴瘤(DLBCL)成年患者。loncastuximab tesirine是首款获得FDA批准的靶向CD19的抗体偶联药物(ADC),瓴路药业与ADC Therapeutics成立的合资公司瓴路爱迪思拥有该药在大中华区和新加坡的权益。在中国II期注册临床OL-ADCT-402-001中,该新药的有效性与安全性数据与全球关键临床试验ADCT-402-201结果一致。
2.泽布替尼新适应症拟纳入优先审评。百济神州BTK抑制剂泽布替尼获CDE拟纳入优先审评,联合CD20单抗奥妥珠单抗用于既往接受过至少二线治疗的复发/难治滤泡性淋巴瘤(FL)。公布于ASCO2023年会上的全球Ⅱ期ROSEWOOD临床更新数据显示,中位随访为20.2个月时,联合疗法ORR为69.0%(vs45.8%),完全缓解率为39.3%(vs19.4%),18个月持续缓解时间为69.3%(vs41.9%),中位无进展生存期为28.0个月(vs10.4个月)。
3.迪哲JAK1抑制剂PTCL国际临床积极。迪哲医药在ASCO2023年会上公布JAK1抑制剂戈利昔替尼治疗复发/难治外周T细胞淋巴瘤(r/r PTCL)的国际临床(JACKPORT8 Part B)积极数据。独立评审委员会(IRC)评估的ORR达44.3%(39/88),完全缓解率为23.9%;中位缓解持续时间(mDoR)尚未达到,最长DoR达16.8个月且仍持续缓解。药物总体安全可控。2022年,FDA已授予戈利昔替尼治疗r/r PTCL的快速通道资格。
4.易慕峰EpCAM靶向CAR-T胃肠癌临床积极。易慕峰宣布在ASCO2023年会上公布其靶向EpCAM的CAR-T产品IMC001用于晚期结直肠癌和胃癌末线治疗的最新临床积极结果。数据显示,在低剂量和中剂量下,6例晚期胃癌患者中有2例患者被评定为部分缓解(PR),3例患者仍为疾病稳定(SD)。中剂量组3例患者的存活时间均已超过7个月,其中1例PR患者在IMC001输注后28周成功进行了胃癌根治手术。
5.优替济生CAR-T获批实体瘤临床。上海优替济生创新CAR-T细胞治疗产品UCMYM802获国家药监局临床许可,拟开发用于治疗MSLN阳性晚期实体肿瘤。MSLN(间皮素)是一种细胞表面糖蛋白,在恶性间皮瘤、胰腺癌、卵巢癌和肺癌等多种肿瘤中过表达。MSLN高表达调控了多种细胞信号通路,并与肿瘤增殖、侵袭和不良预后有密切联系。值得一提的是,该公司还开发了一款靶向BCMA的CAR-T候选产品,针对多发性骨髓瘤(MM)。
6.中源协和干细胞疗法获批两项临床。中源协和旗下武汉光谷中源1类生物制品“VUM02注射液”获国家药监局两项临床试验默示许可,适应症分别为慢加急性(亚急性)肝衰竭患者和急性呼吸窘迫综合征。VUM02是一款冷冻保存型干细胞制剂,是由健康新生儿脐带组织经体外分离、筛选、扩增后制备的人脐带源间充质干细胞 (UC-MSC) 悬液。目前,全球尚无用于上述两种适应症的同类细胞药物获批上市。
国际药讯
1.低浓度阿托品在美报儿童近视NDA。Vyluma公司0.01%低浓度阿托品眼药水NVK002用于治疗儿童近视的上市申请获FDA受理,PDUFA日期为2024年1月31日。在III期CHAMP研究中,与安慰剂组相比,NVK002组患者在包括应答者分析(Responder Analysis)、平均等效球面度数(SER)、与基线相较的平均眼轴长度等疗效指标上,均具有统计学意义的改善。兆科眼科拥有NVK002在中国、韩国和部分东南亚国家的开发和商业化授权。
2.葛兰素史克PD-1抗体组合获FDA优先审评。葛兰素史克(GSK)开发的PD-1抗体Jemperli(dostarlimab)的补充生物制品许可申请(sBLA)获FDA受理,与化疗联用一线治疗DNA错配修复缺陷(dMMR)和高微卫星不稳定性(MSI-H)的原发性晚期或复发性子宫内膜癌。FDA同时授予其优先审评资格,PDUFA日期为今年9月23日。今年1月,FDA已批准dostarlimab从加速批准转变为完全批准,用于治疗含铂化疗后进展、携带dMMR的复发或晚期子宫内膜癌患者。
3.NO疗法纤维化间质性肺病III期临床失败。Bellerophon公司评估通过药物-器械联合疗法INOpulse将吸入式一氧化氮(iNO)直接送到纤维化间质性肺病(fILD)患者的肺部,用于帮助血管(动脉)扩张降低肺部血压的III期REBUILD研究未达到主要终点。与安慰剂相比,INOpulse(剂量iNO45,45μg/kg IBW/hr)组患者16周时通过活动记录仪测量的中度至剧烈体力活动(MVPA)变化每天相差5.49分钟(p=0.2646);INOpulse耐受性良好,未发现新的安全性信号。
4.心血管药物公司融资开发CD47靶向药。Bitterroot Bio公司宣布完成由ARCH Venture Partners和Deerfield Management共同领投的1.45亿美元的A轮融资,以支持其靶向CD47/SIRPα途径的先导项目BRB-002的开发,用于治疗动脉粥样硬化等心血管疾病。CD47蛋白可与表达在免疫细胞表面的SIRPα蛋白相互作用,传递“别吃我”信号来抑制免疫细胞对癌细胞的吞噬。与同类产品治疗肿瘤相比,BRB-002无需穿透肿瘤,只需要进入血管壁,少量的药物就能发挥治疗效果。
5.博迪生物TLR7/8激动剂授权Eikon公司。Seven and Eight Biopharmaceuticals(博迪生物)与Eikon Therapeutics就其临床早期新型免疫调节剂Toll样受体7和8(TLR7/8)激动剂达成授权许可协议,授权后者在全球范围内开发并商业化该产品用于治疗红斑狼疮等免疫疾病。抑制TLR7/8有望广泛抑制狼疮相关效应因子,同时保持对非ssRNA微生物病原体的先天性免疫反应。在Ⅰ期临床中,该新药单药或与PD-1/L1抗体联合治疗均显示出良好的安全性以及初步疗效。
6.加州眼科公司完成1.5亿美元B轮融资。Alkeus公司宣布完成1.5亿美元B轮融资。本轮融资将用于支持其核心候选管线--维生素A衍生药物gildeuretinol(ALK-001)用于治疗常染色体隐性遗传的眼底黄色斑点症(又名Stargardt病,STGD1)的注册和上市工作,以及团队规模的扩张。该公司还宣布Vertex Pharmaceuticals(福泰医药)创始人Joshua Boger博士已加入Alkeus公司并担任执行主席。
医药热点
1.第二十三届吴杨奖揭晓。第二十三届吴阶平-保罗·杨森医学药学奖正式揭晓,中国医学科学院北京协和医院钟守先教授获吴杨奖特殊贡献奖,以表彰其对我国腹部外科疾病领域,特别是肝胆胰外科的开拓性贡献。军事科学院军事医学研究院微生物流行病研究所秦成峰教授、北京大学生命科学学院魏文胜研究员等14位中国医药卫生领域的优秀工作者荣获吴杨奖。
2.广东17部门发布鼓励生育18项举措。6月7日,广东省卫健委等17个部门联合发布《关于进一步完善和落实积极生育支持措施的实施意见》提出,加快建设生育友好省,稳妥有序实施一对夫妻可以生育三个子女政策及配套支持措施,不断深化优生优育及妇女儿童健康服务,完善托育、财政、税收、保险、教育、住房、就业等十八方面的生育支持措施。
3.上海启动医保经办服务直通车活动。为优化营商环境,积极服务和促进上海市生物医药产业发展,上海市医保中心6月8日首次举办“医保经办服务直通车”活动,介绍本市医保药品目录经办工作、可另行收费一次性使用医疗器械和新增医疗服务项目医保编码申报流程。上海市医保中心表示,目前,上海市已将“达芬奇手术机器人”等76个新增医疗服务项目纳入医保支付范围,今年将继续采取有力举措,扩大条件成熟的新项目、新医疗器械(耗材)条目纳入医保支付范围。
评审动态
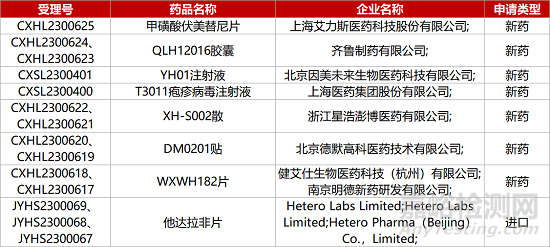
1. CDE新药受理情况(06月08日)
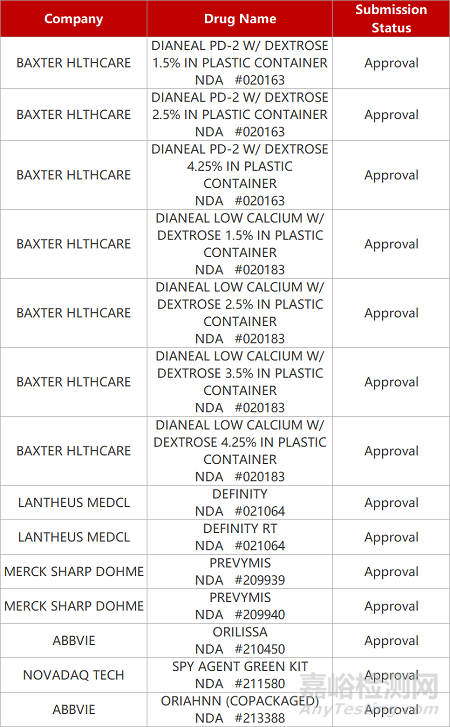
2. FDA新药获批情况(北美06月07日)