亚硝胺杂质是FDA和其它主要监管机构在过去几年重点关注的内容,自从沙坦类药物因NDMA (二甲基亚硝胺)污染事件而导致大面积召回之后,受监管的制药公司和CDMO就收到了FDA等监管机构要求彻查工艺,以及进行亚硝胺风险评估的指令。FDA和EMA也修订了各自在亚硝胺杂质控制与管理方面的监管指南,并且制定了相当严苛的不同类的亚硝胺杂质最高上限。
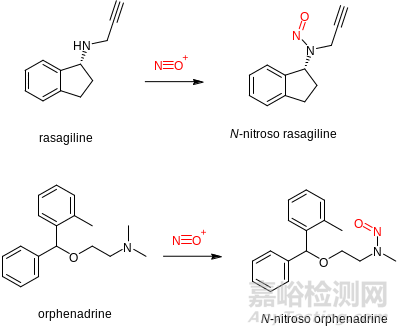
尽管生产过程中产生的亚硝胺可以通过计算Purge Ratio和Purge Factor的方式进行评估和管理,但对于那些药物分子本身导致的亚硝胺杂质(例如药物分子中包含二级氨基)的情况,亚硝胺的问题就相当棘手了。生产工艺中产生的亚硝胺杂质可以通过后续的反应或者workup步骤去除,但如果亚硝胺来自于“堡垒内部”的药物降解,这就有些“不可为之”的意味了。而监管机构为这些药物为基质的亚硝胺物质(NDSRI, nitrosamine drug substance related impurities ) 设定的ADI (Acceptable Daily Intake)极低的阈值令受到波及的药物开发与生产举步维艰。例如帕金森病药物雷沙吉兰(Rasagiline)中发现的N-亚硝基雷沙吉兰;以及在治疗动脉硬化、自发的和脑炎性的帕金森病的药物奥芬那君(Orphenadrine)中发现的N-亚硝基奥芬那君。后者引发了Sandoz多批次的药品召回。
图1.雷沙吉兰和奥芬那君以及它们的N-亚硝基杂质
EMA发布的针对特定药品的亚硝酸杂质NDSRI限制指南,其中囊括了许多易感药物。该指南对这些易感药物的亚硝胺杂质NDSRI上限提出了建议。指南规定,如果某种药物已形成亚硝胺类杂质NDSRI,但具体限值没有在此份指南中限定的话,将统一采取18 ng/天的ADI。18ng/天的标准对于那些的确产生NDSRI的药物,尤其是那些剂量相对较大的制剂来说,无疑是极度艰巨的挑战。NDSRI有些类似于“周处除三害”的例子,最终竟然发现自己竟然是祸害之一(含二级氨基的药物的存在,为NDSRI杂质提供了可能)。
2、NDSRI阈值,难以承受之重
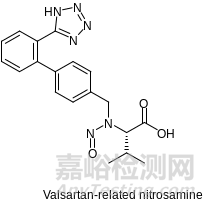
涉及NDSRI的API通常是仲胺,但叔胺也并不能完全置身度外,图1中显示的Orphenadrine就是一个很好的证明叔胺同样可以导致NDSRI亚硝胺杂质的例子。在酸性条件下,这些含有二级或三级氨基的原料药,可以与赋形剂中的亚硝酸盐1反应形成NDSRI。2相对于诸如二甲基亚硝胺(NDMA)和二乙基亚硝胺(NDEA)这样的小分子致癌物,NDSRI因为增加的分子大小、电子和空间因素等影响,倾向于使这些较大的N-亚硝胺丧失一部分致癌性和诱变性,因此这些NDSRI预计比小烷基N-亚硝胺(即NDMA 或NDEA等)的致癌性和诱变性低得多。3N-亚硝胺在自然界中往往非常多样化,并非所有亚硝胺分子都是致变的,近20% 是非诱变性的,例如Valsartan相关的亚硝胺(图2)。4在这种背景下,监管机构不分良莠地一刀切式的NDSRI阈值设定就有些过于严苛了。
图2. Valsartan相关亚硝胺杂质结构,非诱变性分子。
FDA指定的临时 ADI为26.5 ng/天;而EMA更为激进,为新的NDSRI 设定了18 ng/天的临时ADI。然而,EMA随后引入了 178 ng/天的临时ADI,直到数据可以证明其确切的ADI。这种临时ADI的使用时间不超过12 个月。5目前尚不清楚 FDA是否会采用类似的临时ADI。
3、如此低NDSRI阈值的由来
监管机构目前并没有发布关于如何根据交叉参照(read-across)方法分配整个生命周期ADI的明确指导,这些交叉参照方法使用具有相似结构的N-亚硝胺的化合物特定数据。6在Lhasa Cancer Potency Database (LCPD)中数量有限的N-亚硝胺里面,只有不到4% 的亚硝胺分子是NDSRI。7因此,人们只有利用这4%的NDSRI中的N-亚硝胺部分相邻的相关结构域,来指导交叉阅读方法。再加上参考诱变剂是小分子量的N-亚硝胺。这些桎梏将降低NDSRI在整个生命周期ADI值(因为参考诱变剂比相应的NDSRI 更小,更具致癌性和致变形)。
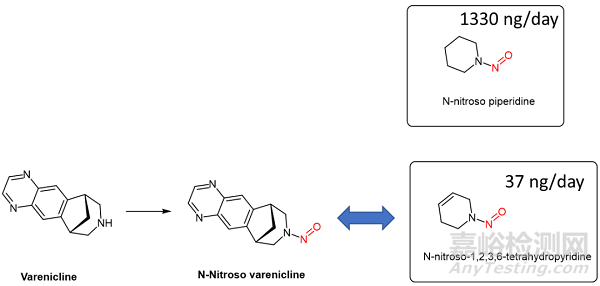
图3. N-nitroso varenicline与N-nitroso piperidine化学结构对比。
以N-nitroso varenicline (NNV) 为例,最接近的已知ADI数据的参考诱变剂是N-亚硝基哌啶(ADI为 1300 ng/天),但监管机构却选择N-亚硝基-1,2,3,6-四氢吡啶作为参考诱变剂(ADI为 37 ng/天)。然而,NNV的桥接双环是饱和的,没有双键特征,并且将双键引入参考诱变剂(N-亚硝基-1,2,3,6-四氢吡啶)中的做法,会显著增加所得诱变剂的毒性。8此外,NNV的 Ames测试曲线并不显示其为有效的诱变剂。这强烈表明设定给NNV的ADI 被大大高估了(即阈值过低)。
另一个令人担忧的因素是,监管机构拒绝接受Ames试验阴性作为可解除致突变性风险的证据。5这与ICH M7指南相悖。9监管机构已强制要求,必须应用额外的体外/体内测试来支持阴性Ames 测试结果。
4、亚硝胺分析方法建立的挑战
为这些新发现的 NDSRI建立合适的特异性和高灵敏度分析方法也是一项重大挑战。最灵敏的方法是美国药典(USP) 程序4(GC-MS/MS triple quad),它具有5 ppb的LOQ (Limit of Quantification)。10该方法已经过验证,但仅限于特定的API。在成品药中,辅料的存在意味着如果没有额外的提取/富集策略,该方法将难以达到5ppb的LOQ标准。对于最大日剂量(MDD) > 2000 mg/天,且ADI 为 18 ng/天的药品,亚硝胺杂质的浓度限值应为0.009 ppm 或 9 ppb。EMA要求杂质的限值应小于ADI 的 10%,相当于0.9 ppb。因此,USP程序 4对这种情况就不具有所需的灵敏度。对此EMA指出,“预计每日高剂量使用的医药产品会有例外情况(ADI可能低于该检测方法的技术可行性),或者在给定医药产品中预计或鉴定出超过一种亚硝胺的情况。”6
5、两害相权取其轻:MutaMind
监管机构已经意识到了困扰NDSRI 评估的许多问题。在欧盟内部,已经对此启动了EMA-MutaMind 项目来尝试解决这些问题。11其涵盖以下四点内容:
a.在胃肠道不同部位中,API 和亚硝酸盐反应形成内源性NDSRI。ICH M7指出,“当人类从其他来源(例如食物或内源性代谢)接触到的杂质要多得多时,更高的可接受的NDSRI摄入量可能是合理的。”9
b.NDSRIs 的代谢激活和相关酶系统的鉴定;
c.DNA 加合物的类型、动力学和修复机制;
d.优化体外致突变性试验,例如 Ames 试验。
总 结
总之,短链烷基N-亚硝胺(即API中的NDMA,NDEA等)的ADI和控制策略相对容易建立。相比之下,NDSRIs已被证明是极具挑战性的,因为缺少有意义的参考诱变剂来充分反映它们的分子大小和复杂性。使用小分子诱变剂参考会产生过于苛刻的ADI,而且常用的分析方法达不到如此高的要求,无法准确定量和控制NDSRI。Ames试验是诱变毒理学的基石,尽管可用信息(虽然有限)表明阴性Ames 试验已通过其他体内诱变方法(即MutaMice)验证,但Ames的可靠性依然受到监管机构的挑战。然而,如果这些相同的分子在体内以内源性的方式以百分之几的级别产生,那么最大的挑战可能是如何证明原料药或者成品药中的NDSRI的 ppb限制是合理的。监管机构仍然需要在安全性和可操作性之间权衡,以确保患者的安全,同时也要确保相关药物不会因为不合理的NDSRI限值设定而出现供应短缺的问题,那就是一种“皮之不存, 毛将焉附”的逻辑问题了。
参考资料:
[1] Boetzel R, Schlingemann J, Hickert S, et al. A Nitrite Excipient Database: A useful Tool to Support N-Nitrosamine Risk Assessments for Drug Products. J Pharm Sci. 2022; S0022-3549(22)00168-X.
[2] López-Rodríguez, R. et al. Pathways for N-Nitroso Compound Formation: Secondary Amines and Beyond. Org Proc Res Dev. 2020, 24, 1558–1585.
[3] (a) Cross, K. P. et al. Developing structure-activity relationships for N-nitrosamine activity. Comput Toxicol. 2021, 20, 100186; (b) Thomas, R. et al. Utilisation of parametric methods to improve percentile-based estimates for the carcinogenic potency of nitrosamines. Regul Toxicol Pharmacol. 2021, 121, 104875; (c) Thomas, R. et al. What Makes a Potent Nitrosamine? Statistical Validation of Expert-Derived Structure–Activity Relationships. Chem Res Toxicol. 2022, 35, 1997–2013; (d) Thresher, A. et al. Are all nitrosamines concerning? A review of mutagenicity and carcinogenicity data. Regul Toxicol Pharmacol. 2020, 116, 104749.
[4] Glowienke, S. et al. Genotoxicity evaluation of a valsartan-related complex N-nitroso-impurity. Reg Toxicol Pharmacol. 2022, 134, 105245.
[5] EMA. Questions and Answers for marketing authorisation holders/applicants on the CHMP Opinion for the Article 5(3) of Regulation (EC) No 726/2004 referral on nitrosamine impurities in human medicinal products. EMA/409815/2020 Rev.13.
[6] Elder, D. P. et al. Tolerability of risk: A commentary on the nitrosamine contamination
issue. J Pharm Sci. 2021, 110, 2311-2328.
[7] Schlingemann, J. et al. The landscape of potential small and drug substance related nitrosamines in pharmaceuticals. J Pharm Sci. 2022.
[8] Ponting, D. J. et al. On the carcinogenic potential of noval N-nitrosamine impurities derived from active pharmaceutical ingredients. J Med. Chem. 2022, 65, 15584–15607.
[9] ICH M7 Guideline on Assessment and Control of DNA Reactive (Mutagenic) Impurities in Pharmaceuticals to Limit Potential Carcinogenic Risk. EMA. 2014. [cited Apr.2023]
[10] Biba E. GENERAL CHAPTER <1469> NITROSAMINE IMPURITIES. Stakeholder Forum. November 19, 2020. [cited Apr. 2023].
[11] Cross, K. P. et al. N-nitrosamine impurities in drugs, introducing EMA-Mutamind project. [Internet] Instem. 03 November 2022. [cited Apr. 2023].
[General] Elder, D. Nitrosamine. Where Now? European Pharmaceutical Review. 2023, 28, 32-34.