一、 目的
多晶型现象是指同一化合物因存在多种不同的排列形式和分子构象而形成不同晶型的现象。原料药的不同晶型可能具有不同的物理和化学性质,可能对原料药及制剂的稳定性、 制剂的生产工艺、溶出度及生物利用度等产生影响,进而可能影响药物的安全性、有效性和质量可控性,所以研究原料药的多晶型现象以及晶型可能对药物全生命周期各环节产生的影响,是保证药物质量的核心内容和关键环节,对化学仿制药的研发具有重大意义,尤其对于化学仿制药一致性评价研究,如与原研药晶型有差别,有可能导致药品的质量不同。
二、 研究思路
化学仿制药晶型研究主要的参考指南有CDE发布的《化学仿制药晶型研究技术指导原则(试行)》(2021年第61号)和FDA于2007年7月发布的《仿制药晶型研究技术指导原则》。根据以上两部指南的描述,晶型研究思路如下:
2.1 整体考虑
不同的剂型,晶型研究的侧重点有所不同:对于固体制剂、半固体制剂和混悬剂,应主要考虑晶型对原料药及制剂工艺和稳定性的影响, 以及对制剂溶出和生物利用度/生物等效性的影响;对于液体制剂(如口服液、注射液等),应重点关注原料药的不同晶型对制剂工艺过程可能产生的影响。
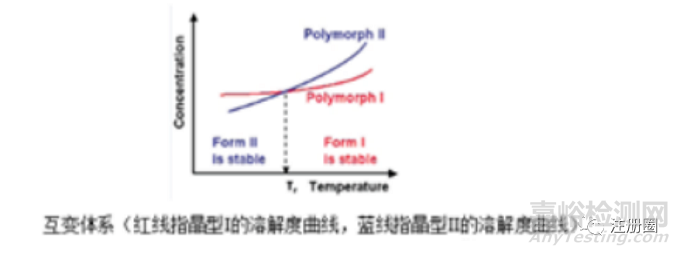
原料药晶型不同也会影响到析晶工艺的选择,如选择合适的析晶溶剂、析晶温度、析晶时间和析晶操作条件。在单变体系下,不同的晶型在同一温度下溶解度差异较大,此时若目标晶型为稳态晶型,则需要在结晶工艺中采取措施使亚稳态晶型向稳态晶型转变,具体措施包括结晶后期增加循环升降温打浆或适当延长结晶操作时间;若目标晶型为亚稳态晶型,则需要加入足够量的晶种,因晶种能提供足够的生长面供晶体生长,避免“自发成核”从而生成混晶。另外,制备亚稳晶型,需要考察溶剂介导转晶的影响。质量合格的情况下,尽量减少结晶时间,若结晶时间较长,亚稳态晶型易向稳态晶型转变;在互变体系下,晶型可以在一定条件下相互转变。此时温度是结晶工艺的关键参数,如下图,在温度小于晶型转变温度(Tr)时,晶型II是稳定晶型(溶解度更低),晶型I是亚稳晶型,此时制备晶型II更容易;反之,在温度T>Tr,晶型I是稳定晶型,晶型II是亚稳晶型,此时制备晶型I更容易。
2.2 仿制药晶型选择
通常情况下仿制药应选择与参比制剂一致的晶型。因此首先需要确定参比制剂的晶型,方法是查找与原研药直接相关的专利或通过化合物专利查找晶型专利等等。
若有足够的稳定性研究数据支持且其他晶型制备的仿制药与参比制剂生物等效,也可选择与参比制剂不同的晶型。无论选择何种晶型,均应对所选择晶型进行充分的理化性质和稳定性研究。
2.3 晶型对生物利用度/生物等效性的影响
晶型的不同可能导致溶解度和溶解速率的差异,进而影响制剂生物利用度/生物等效性。原料药不同晶型的表观溶解度差异是否会影响制剂生物利用度/生物等效性,取决于影响药物吸收速度和程度的各种生理学因素, 包括胃肠道蠕动、药物的溶出、药物的渗透性等。生物药剂学分类(BCS)目前是作为科学评价多晶型现象对制剂生物利用度/生物等效性影响程度主流方法。对于体内吸收仅受溶出速度限制的高渗透性药物, 若不同晶型之间表观溶解度差异较大,就很可能影响生物利用度/生物等效性;反之,对于吸收仅受肠道渗透性限制的低渗透性、 高溶解性药物,各晶型之间的表观溶解度的差异对生物利用度/生物等效性的影响相对较小。另外,即使证明仿制药与参比制剂体内生物等效,也应考虑非稳态晶型转变是否影响制剂的生物利用度或生物等效性,此时体外溶出试验可作为评价方法。
2.4 晶型对制剂工艺影响
原料药的不同晶型可呈现不同的物理和机械性质, 包括吸湿性、颗粒形状和大小、密度、流动性和耐压性等, 进而可影响原料药的纯化工艺和制剂的生产。原料药多晶型对制剂工艺的影响差异在于:对于粉末直压的工艺, 尤其是当原料药在处方中所占的比例较大时, 原料药的固态特征是制剂生产的关键影响因素;而对于湿法制粒工艺,原料药的固态特征通常被制粒过程所改变或掩盖,其固态特征对生产的影响可能就比较小。原料药多晶型对制剂工艺的影响,需要考虑的关键问题是能否持续稳定地生产出符合过程控制和符合标准的制剂。
2.5 晶型稳定性
原料药经干燥、粉碎、制粒、球磨和压片等制剂工艺步骤,在温度、湿度、光照等环境因素的作用下,可能出现转晶现象,晶型转变的条件、程度以及是否会影响药物质量需进行充分研究。为了降低转晶的可能性,以及得到更好的化学稳定性,通常选择热力学最稳定的晶型,但在某些特殊情况下(如需要提高难溶性药物生物利用度),需选择亚稳态晶型或无定型作为开发晶型, 应证明所选择晶型在生产和贮存过程中具有足够的物理和化学稳定性并采取适当的措施(如适当的处方、生产工艺、包装、严格的贮存条件等)以避免在贮存期间亚稳态晶型向稳定型晶型转变。
2.6 晶型分析方法
常用的晶型分析方法包括:单晶X射线衍射法( SXRD)、 粉末X射线衍射法(PXRD)、红外光谱法(IR)、拉曼光谱法(Raman)、差示扫描量热法(DSC)、热重分析法(TGA)、热台显微镜法(TPM)、毛细管熔点法(MP)、偏光显微法(PM)、 固体核磁共振波谱法(ssNMR) 等。其中,SXRD和PXRD是目前常用方法。热分析方法(如DSC、TGA和热台显微镜法等) 和光谱法(如 IR、Raman和ssNMR等) 均可作为辅助手段进一步支持不同晶型的确证。各种分析方法的用途如下表:
|
分析方法 |
用途 |
|
单晶X射线衍射法( SXRD) |
(1)通过测定晶胞参数来确定结晶构型和分子排列 |
|
(2)测定结晶溶剂或结晶水 |
|
(3)确认成盐药物碱基、酸根间成键关 |
|
粉末X射线衍射法(PXRD) |
研究药物多晶型最常用方法,专属性最强,可获得晶型变化、结晶度、晶构状态、是否有混晶等信息 |
|
红外光谱法(IR) |
通过峰形、峰位和峰强判断是否存在晶型差异,进行晶型鉴别 |
|
拉曼光谱法(Raman) |
通过峰形、峰位和峰强判断是否存在晶型差异,进行晶型鉴别,与IR法互补 |
|
差示扫描量热法(DSC) |
分析晶型物质的熔融分解状况;判断是否有转晶、混晶现象 |
|
热重分析法(TGA) |
检查晶型物质中是否含有结晶溶剂或结晶水;检查样品升华、分解过程和量值 |
|
毛细管熔点法(MP) |
测定晶型物质熔点 |
|
热台显微镜法(TPM) |
观察晶型物质相变过程,测定熔点和转晶点 |
|
偏光显微法(PM) |
测定消光角,鉴定所属晶系 |
|
固体核磁共振波谱法(ssNMR) |
不同晶型结构会产生13C-NMR的差异,可通过13C-NMR的差异判断是否存在多晶现象,也可与已知晶型的13C-NMR对比获得具体晶型 |
具体的晶型分析方法建议优选X射线衍射法,并根据分析目的辅以其他方法进行支持、佐证。
三、 是否订入质量标准
申请人可参考决策树 1~3 进行仿制药晶型的评估与控制策略的制订,并决定是否将多晶型检查项订入质量标准。
3.1 制订晶型检查项的必要性
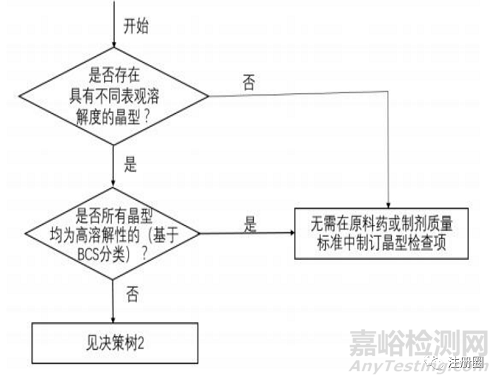
决策树1为原料药和/或制剂标准中制订晶型检查项的建议。是否应在原料药和/或制剂标准中制订晶型检查项关键在于原料药各种晶型表观溶解度是否存在差异,以及表观溶解度差异是否对生物利用度/生物等效性产生显著影响。
▲ 决策树1-制订晶型检查项的必要性
3.2 原料药晶型检查项的制订
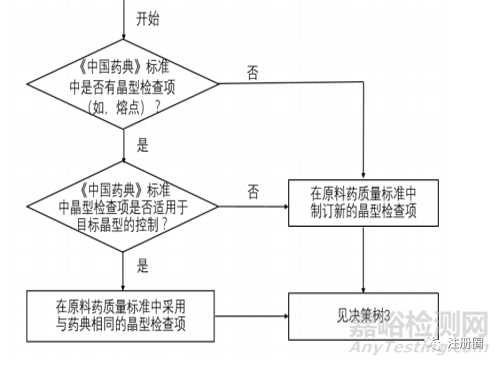
按照BCS分类系统对药物的溶解性进行区分,当原料药的至少一种晶型属于低溶解性时, 可参考决策树2制订该原料药晶型检查项。若中国药典或其他申请国药典中收载了晶型检查项,且该项适用于目标晶型的控制,可在原料药质量标准中采用与药典相同的晶型检查项;若中国药典或其他申请国药典中没有收载晶型检查项,或该项不适用于目标晶型的控制,申请人应参考相关文献(如除申请国的其他国家药典)并在充分研究的基础上制订新的晶型检查项。
▲ 决策树2-原料药晶型检查项的制订
3.3 制剂晶型检查项的制订
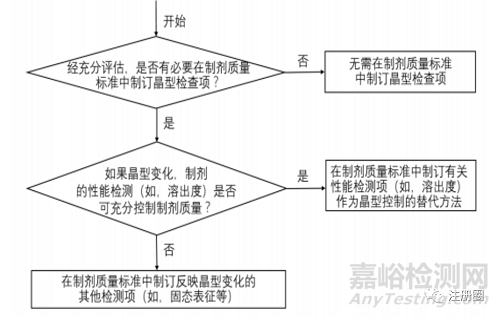
可参考决策树3选择制剂中晶型的控制策略。若选择的晶型是热力学最稳定的晶型,或者选择与参比制剂相同的晶型, 通常情况下无需在制剂质量标准中制订晶型检查项;若选择的是亚稳态晶型,考虑到亚稳态晶型可能在制剂工艺和贮存过程中发生晶型转变,此时需要进行进一步研究决定是否在制剂质量标准中制订晶型检查项。如果晶型变化对生物利用度/生物等效性的影响可通过制剂的其他性能检测(如溶出度)进行控制时,可通过溶出度等性能检测项替代晶型检查项。反之,若已有的性能检测项且难以与晶型之间关联,应在制剂质量标准中制订反映晶型变化的其他检测项(如固态表征等)。
▲ 决策树3-制剂晶型检查项的制订
四、 总结
本文笔者通过梳理仿制药晶型研究目的、研究思路和分析方法,并从注册申报角度考虑,论述了是否应建立多晶型质量标准,总结了一套仿制药晶型研究要点,旨在为广大同行进行仿制药研究,尤其是一致性评价研究助力,不足之处还望批评指正!