今日头条
开拓PROTAC新药美国I期临床积极。开拓药业自研、靶向雄激素受体(AR)的蛋白降解嵌合体(PROTAC)新药GT20029在治疗雄激素性脱发和痤疮的美国I期临床结果积极。数据显示,GT20029在所有剂量组的安全性和耐受性均良好。在单剂给药剂量递增阶段,未发生治疗期间的不良事件。在多剂给药剂量递增阶段,常见的不良事件均为轻度。研究期间未发生严重不良事件。去年11月,该新药在中国的I期临床也取得积极结果。
国内药讯
1.驯鹿BCMA靶向CAR-T获快速通道资格。驯鹿生物全人源BCMA靶向CAR-T产品CT103A获FDA授予再生医学先进疗法资格和快速通道资格,用于治疗复发/难治多发性骨髓瘤(MM)。CT103A以慢病毒为基因载体转染自体T细胞,CAR包含全人源scFv、CD8a铰链和跨膜、4-1BB共刺激和CD3ζ激活结构域。在中国,驯鹿生物和信达生物正在合作开发该新药针对R/RMM适应症的临床应用。去年6月,CDE已将CT103A纳入优先审评。
2.智康弘义CDH3靶向ADC获批临床。智康弘义CDH3靶向ADC药物BC3195获FDA临床批件。这是一款具有“first-in-class”潜力的新一代ADC,已在临床前研究中显示出较好的抗体内吞活性和安全性,具有良好的肿瘤抑制活性,在多个肿瘤模型中的肿瘤生长抑制率(TGI)大于100%。智康弘义计划在中美同步开展BC3195用于治疗晚期实体瘤的Ⅰ期临床研究。
3.泽璟LAG-3/TIGIT双抗报IND。泽璟制药1类生物制品注射用ZGGS15的临床试验申请获CDE受理。ZGGS15是一款LAG-3/TIGIT双特异性抗体,既可以通过阻断LAG-3与其配体MHC-II等信号通路,激活TCR信号通路,又可以阻断TIGIT与其配体PVR等信号通路,促使PVR结合CD226产生共刺激激活信号,具有协同增强免疫系统杀伤肿瘤细胞的能力。该新药拟开发用于治疗晚期实体瘤患者。
4.奥赛康PD-1/IL-15大分子国内报IND。奥赛康药业1类生物制品注射用ASKG915的临床试验申请获CDE受理,拟用于晚期实体瘤的治疗。ASKG915是一款PD-1/IL-15双功能融合蛋白,可通过PD-1抗体实现肿瘤靶向性,并在肿瘤部位被局部激活。临床前数据显示,ASKG915具有良好的抗肿瘤活性,疗效显著优于PD-1单药疗法,治疗窗显著优于传统细胞因子类药物。去年12月,该产品已获FDA临床批件。
5.石药Nectin-4靶向ADC授权海外。石药集团宣布旗下子公司石药巨石生物已与Corbus公司订立独家授权协议,将重组人源化抗Nectin-4抗体偶联药物(ADC)SYS6002在美国、欧盟国家、英国、加拿大、澳大利亚、冰岛、列支敦士登、挪威及瑞士的开发及商业化授权给Corbus。根据协议,巨石生物将获得750万美元预付款,1.3亿美元开发及监管里程金,5.55亿美元销售里程金,以及药物的销售分成。
6.恒瑞EZH2抑制剂授权海外。恒瑞医药宣布已与美国Treeline公司达成协议,将抗肿瘤药物EZH2抑制剂SHR2554项目有偿许可给Treeline公司。根据协议,恒瑞将获得1100万美元的首付款,累计不超过4500万美元的开发里程碑款以及累计不超过6.5亿美元的销售里程碑款。2023年1月,SHR2554片已被国家药监局纳入突破性疗法,用于治疗复发或难治的外周T细胞淋巴瘤。
国际药讯
1.罗氏眼科双抗两项Ⅲ期临床达主要终点。罗氏旗下基因泰克VEGF-A/Ang-2双抗Vabysmo(faricimab-svoa)在治疗视网膜静脉阻塞(RVO)的两项国际Ⅲ期临床(BALATON和COMINO)达到主要终点。与aflibercept相比,Vabysmo在改善患者因RVO引起的黄斑水肿与视力损害方面达到非劣效性标准。两项试验两组患者视力平均改善的视力表字母分别达到16.9个vs17.5个,以及16.9个vs17.3;Vabysmo还能快速地减少视网膜积液;且药物安全性与之前试验一致。
2.吉利德CD19靶向CAR-T长期疗效积极。吉利德旗下Kite公司靶向CD19的CAR-T疗法Tecartus在第五届欧洲CAR-T细胞大会上公布用于治疗复发性/难治性B细胞急性淋巴细胞白血病(R/R B-ALL)的Ⅰ/Ⅱ期临床(ZUMA-3)最新数据。Ⅱ期研究中接受治疗的患者队列(n=55)其中位随访时间为38.8个月,36个月时的总生存率为47.1%(95%CI,32.7-60.2)。患者的中位总生存期为26.0个月,而达成CR或CRi的患者(n=39)的总生存期为38.9个月。
3.K药皮下注射制剂启动III期临床。默沙东PD-1帕博利珠单抗的皮下注射制剂MK-3475A在clinicaltrials.gov网站上登记注册一项III期临床试验(MK-3475A-D77),拟评估与其静脉注射制剂对比用于一线治疗转移性非小细胞肺癌(NSCLC)患者的药代动力学性质和安全性。该项试验预计纳入339例未接受过治疗的NSCLC患者。研究将于2023年2月20日启动并于2024年9月23日完成。
4.GPCR拮抗剂硬皮病Ⅱ期临床积极。Certa公司靶向G蛋白偶联受体(GPCR)拮抗剂FT011在治疗硬皮病的Ⅱ期临床获积极数据。GPCR蛋白在导致炎症和纤维化的多个下游通路中发挥作用。结果显示,与安慰剂相比,FT011(400mg和200mg)显著改善患者的CRISS评分等多项疗效指标。两个剂量组患者12周时达到临床意义改善的患者比例分别为60%和20%;药物的安全性和耐受性良好。
5.BCMA靶向CAR-T多发性骨髓瘤早期临床积极。Nexcella公司靶向BCMA的CAR-T疗法NXC-201(HBI0101)在第五届欧洲CAR-T会议上公布用于治疗复发/难治性多发性骨髓瘤(RRMM)与轻链淀粉样变性(AL)的Ⅰb/Ⅱ期临床(NEXICART-1)最新数据。在中位随访时间为146天时,NXC-201的客观缓解率达到83%(35/42),并有50%患者达成完全缓解(CR)或严格完全缓解(sCR)。药物的总体耐受性良好。NXC-201基于差异化CAR结构的设计,能降低免疫疗法的毒性,有望成为首个门诊CAR-T疗法。
6.诺和诺德心衰新药上I/II期临床。诺和诺德与Heartseed公司联合开发、源自诱导多能干细胞(iPSC)的心肌细胞疗法HS-4(HS-001),在用于治疗缺血性心脏病引起的晚期心力衰竭患者的I/II期临床(LAPiS)完成首例患者注射给药。HS-4旨在将移植的心肌细胞与患者的心肌细胞结合,从而通过肌肉再生以及分泌血管生成因子在移植部位周围形成新生血管来改善心输出量。临床前研究显示,iPSC来源的心肌细胞可改善心脏功能。
医药热点
1.肖传国受聘武汉大学中南医院泌尿外科教授。2月9日下午,武汉大学泌尿外科研究所、武汉大学中南医院泌尿外科肖传国教授受聘仪式举行。肖传国教授是原纽约大学泌尿外科副教授、同济医科大学泌尿外科研究所所长、教育部国家重点学科(泌尿外科学)学科带头人、同济医科大学协和医院泌尿外科主任和二级教授,现任深圳肖传国医院院长。肖传国教授在国际上首次提出并证实“人工建立体神经-内脏神经反射弧”神经科学新概念,首创“人工反射弧”技术用于治疗截瘫或脊髓栓系综合征导致的神经源性膀胱,并载入国际国内教科书。
2.甘肃临夏实现全流程刷脸就医。甘肃省临夏州积极探索推进医保电子凭证在线上线下就医购药等领域的应用,日前在甘肃省率先实现刷脸办理全流程就医业务。已领取医保电子凭证的患者可直接刷脸挂号,无需携带挂号单只需刷脸便可接受门诊医生接诊;患者无需持取药单只需刷脸便可领取到医生所开药方的药品;在出入院登记结算方面,医院各楼层护士站即可实现患者入院病区办理、出院结算,为患者省去前往门诊缴费窗口或自助机排队的环节。
3.中药注册管理有专门规定。近日,国家药监局发布《中药注册管理专门规定》,要求推进中医药理论、人用经验和临床试验“三结合”,建立具有中药特点的审评审批体系;鼓励运用传统中药研究方法和现代科学技术研究开发中药,形成结合中医药临床治疗特点的中药疗效评价指标。《规定》将自今年7月1日起施行。
评审动态
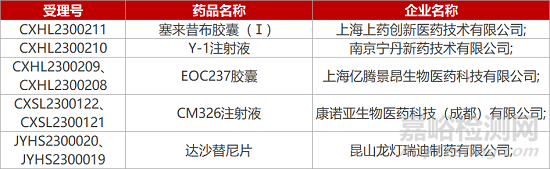
1. CDE新药受理情况(02月13日)
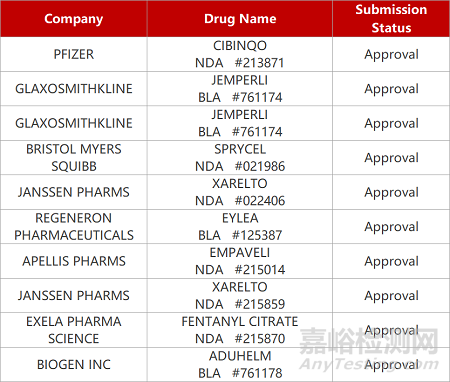
2. FDA新药获批情况(北美02月09日)