合适的细胞微环境是组织工程和再生医学的关键。细胞微环境不仅包括细胞周围的可溶性因子和其他细胞,还包括细胞外基质和参与组织工程或再生过程中的任何生物材料。细胞微环境影响细胞在细胞外基质或生物材料表面/内部的黏附、迁移、分化、增殖和通信。因此,对细胞微环境的研究可以指导新一代组织工程材料的设计。
中国工程院院刊《Engineering》2022年第6期刊发复旦大学丁建东教授研究团队的《组织工程与再生医学中与生物材料相关的细胞微环境》一文。文章综述了与生物材料相关的细胞微环境,主要从材料的化学成分、材料的尺寸和结构、材料控制的细胞几何形状、材料的电荷对细胞的影响、材料基体刚度和生物力学微环境、材料的表面改性6个方面进行了梳理和介绍,并对未来发展方向进行了展望。
一、引言
过去30年见证了再生医学的出现和进步,其中,组织工程是再生医学最有效的策略之一。“组织工程”一词于20世纪80年代由美籍华裔科学家和生物力学先驱冯元桢教授所提出。1985年,他向美国国家科学基金会(NSF)提交了一份名为“活体组织工程中心”的研究提案,并创造了“组织工程”一词。此后,各界科学家逐渐意识到“组织工程”这一概念的重要性。1993年,麻省理工学院的Robert Langer教授和哈佛医学院的Joseph Vacanti教授在《科学》杂志上共同发表了一篇文章,标志着组织工程学科的正式诞生。根据国际生物材料科学与工程学会联合会于2018年组织的“生物材料定义研讨会”,组织工程是指“使用细胞、生物材料和合适的分子或物理因素,单独或组合,修复或替换组织以改善临床结果。”此外,再生医学是指“通过功能性组织或器官结构的再生来治疗疾病、先天性疾病和损伤的疗法”。
无论是对于具有材料和细胞的组织工程,还是在没有外部细胞的情况下植入支架进行原位修复的组织再生,核心科学问题之一是细胞微环境。例如,骨髓基质细胞或者称间充质干细胞(MSC)在复合多孔聚丙交酯-乙交酯(PLGA)支架植入正常关节腔后分化为软骨细胞,而皮下植入仅导致偏离软骨形成的疤痕样组织。
细胞微环境不仅包括器官或组织本身的微环境,还包括植入材料影响的微环境。现代生物材料不再是生物惰性材料;相反,生物活性已经被认为是生物材料越来越重要的特性。根据最新的共识定义,生物材料是“一种旨在通过与生命系统的相互作用来指导治疗或诊断过程的材料”。因此,组织工程和再生医学中的细胞微环境与细胞-材料相互作用的基础科学密切相关。本文就生物材料相关的细胞微环境作一介绍综述。
细胞微环境影响细胞在细胞外基质(ECM)或生物材料表面/内部的黏附、迁移、分化、增殖和通信。在大多数情况下,理想的组织工程和再生医学生物材料的目标是模仿相应的细胞外基质,为细胞提供合适的微环境。因此,对细胞微环境的研究可以指导新一代组织工程材料的设计。
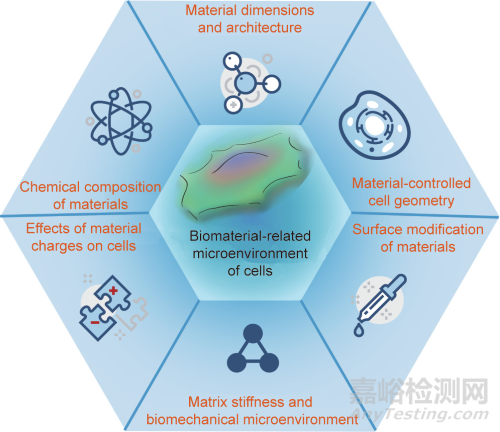
本文综述了笔者对生物材料相关细胞微环境的一些关键方面的理解,如图1所示。下文将从以下6个方面介绍:①材料的化学成分;②材料尺寸和结构;③材料控制的细胞几何形状;④材料的电荷对细胞的影响;⑤材料基体刚度和生物力学微环境;⑥材料的表面改性。
图1. 与材料相关的细胞微环境的关键因素。
二、材料的化学成分
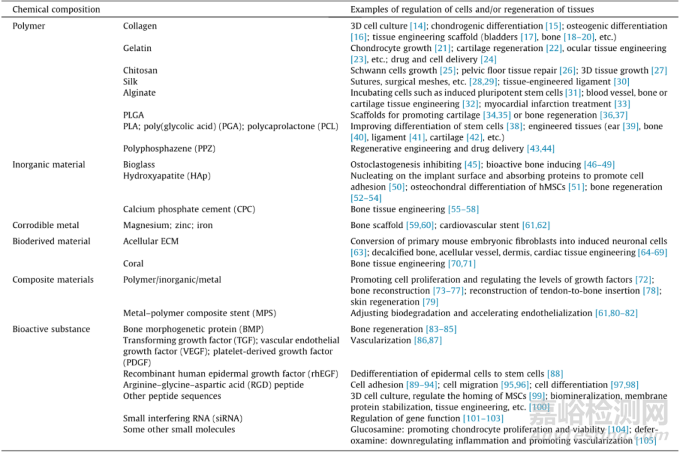
组织工程中使用的生物材料包括聚合物、无机材料、金属、生物衍生材料以及由上述材料组成的复合材料。此外,许多生物活性物质可以促进组织修复和再生。主要组织工程生物材料的分类如表1所示。
人体是由细胞和细胞外基质组成的。在去除组织中的细胞以后,剩余的脱细胞基质代表了组织再生的理想多孔支架,不仅提供了组织的形态,而且为细胞提供了良好的微环境。然而,由于脱细胞基质的局限性,由聚合物、无机非金属材料、金属和复合材料组成的生物材料能满足一些“仿生”的要求。一般来说,金属和无机非金属材料因其强度高而更适合于硬组织修复,而水凝胶等一些聚合物材料则更适合于软组织再生。一些多肽和生物活性分子在细胞支持和组织再生中发挥着重要作用。所有用于组织工程的生物材料原则上都应当是生物相容、可生物降解和可制造的。
由于本文主要研究的是组织工程材料,一些重要但不可降解的材料并未列出。
表1 用于组织工程和再生医学的生物材料的化学成分
三、材料几何尺寸和空间结构
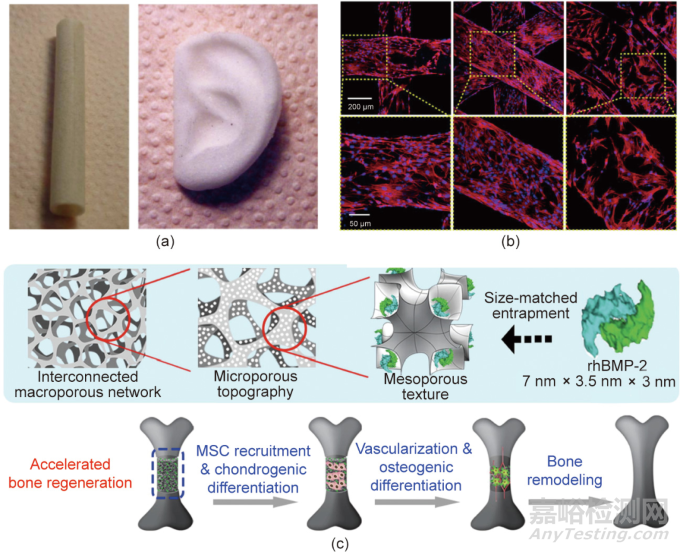
用于组织工程和组织再生的材料通常是三维(3D)多孔支架的形式,以支持细胞的黏附、迁移和生长。多孔支架的制备方法包括发泡法、静电纺丝、冷冻干燥、模压结合粒子浸出。复旦大学丁建东团队开发了一种结合室温注射和颗粒浸出(RTIM/PL)的成型方法来制造由可生物降解聚酯组成的3D多孔支架,用于组织工程,其中一些结果如图2(a)所示。近年来,3D打印和增材制造已成为定制具有不同外部形状和内部孔结构的支架的理想方法。具有不同3D打印结构的支架的典型细胞图像如图2(b)所示,不同尺度(宏观/微观/纳米)的孔结构会影响组织修复和再生。
图2. 组织工程支架研究的部分典型进展。(a)室温注射/颗粒浸出法(RTIM/PL)制备的管状和耳状PLGA多孔支架的全局视图;(b)骨髓间充质干细胞在3D打印的聚乳酸支架上培养7天后的荧光显微图像,支架结构从左到右依次为四方、六方和车轮状结构;(c)负载了重组人骨形态发生蛋白rhBMP-2的多孔支架加速骨再生的示意图。
组织工程多孔支架的制备主要涉及两个方面:获得相互连通的多孔结构及制备合适的支架形状和尺寸。孔径和孔隙率被认为是组织工程支架的重要几何特征。例如,为产生更好的骨软骨修复效果,软骨层的孔径应为100~200 µm,软骨下骨的孔径以300~450 µm为宜。孔径过小会阻碍营养物质的运输,而孔径过大会导致细胞渗漏。
高孔隙率和孔连通性也是组织形成的关键。高孔隙率促进支架内骨组织的形成。Kruyt等研究了孔隙率分别为60%和70%的羟基磷灰石复合材料复合山羊骨髓基质干细胞后的成骨效果。他们发现,70%的孔隙率实现了更多的新骨形成;这归因于高孔率材料的表面积更大,从而对骨诱导因子和离子交换有更好的吸附。
只有相互连通的孔结构才有利于新组织的生长和组织界面的支撑。Lu等发现孔隙的连通通道在20~50 µm的范围内只能形成软骨或类骨样组织,只有在大于50 µm的范围内才可形成矿化骨,闭孔结构阻碍了新生骨和血管的相互连接,导致骨修复效果不理想。
在渗流理论的基础上,丁建东等报道称,具有球形孔的组织工程支架可能比具有立方孔的组织工程支架具有更好的内部连通性,这有利于细胞和组织的向内生长。2001年,Ma和Choi提出了一种制备球形石蜡造孔剂的策略,成功地制备了具有球形气孔和相互连接的内部孔网结构的聚乳酸多孔支架。丁建东团队开发了一种将盐微粒黏合在一起的水溶性致孔剂,并将室温模压和粒子浸出相结合制备了球形PLGA多孔支架。与传统的由大颗粒氯化钠制备的立方体大孔聚合物支架相比,球形大孔改性支架具有更好的内孔连通性和更少的造孔剂残留。此外,在这种糖粘盐内孔壁中观察到了良好的细胞黏附和成骨分化,这可能是由于在致孔剂表面分布了许多微小的氯化钠颗粒,从而在所得到的支架的孔壁上形成了粗糙的内表面。
层次化的孔结构在细胞微环境中对组织修复和再生发挥不同的功能,如图2(c)所示。大孔结构有利于营养物质的交换,而微孔结构可以负载生物活性因子。另外,支架的通道结构和取向排列可诱导细胞的定向招募,并最终影响软骨内成骨。
除了多孔支架外,可注射水凝胶具有高含水率和与天然脱细胞基质相似的特性,为组织工程中的种子细胞负载提供了一种替代方法。可注射性水凝胶还具有显著的优点,因为它们可以用微创注射取代传统手术,能够适合缺陷部位的形状,在要修复或再生的不规则形状的受损组织部位的情况下尤其有用。近年来,人们已经开发了各种可注射水凝胶,包括化学交联水凝胶和物理交联水凝胶,用于组织工程、药物释放和其他医疗应用。
从组织工程的角度来看,种子细胞被水凝胶网络紧密包围。水凝胶中相应的细胞微环境不同于多孔支架内表面的微环境。这种材料也可能影响细胞的行为,通常可以更好地反映细胞的3D特性。
四、材料控制的细胞几何形状
细胞的形状会受到该细胞附着的材料的图案的影响。哈佛大学Ingber和Whiteside首次构想了使用表面图案化对单个细胞进行几何控制。它们的图案是由抗污背景上的黏附性微岛组成的。随后,一系列图案化材料被开发出来用于细胞研究,特别是用于控制细胞黏附。进一步的研究表明,即使是单个细胞的分化也可以受到细胞几何形状的显著调节。然而,用于研究细胞分化的图案化技术比细胞黏附技术更困难,因为它很难长期保持细胞的形状。事实上,大多数非黏附性背景在充满血清的培养液中不能保持长久地抵抗蛋白质吸附和非特异性细胞黏附。
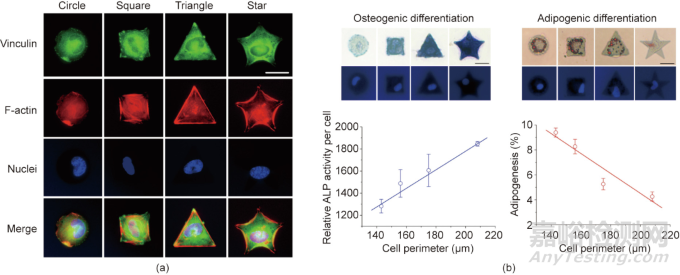
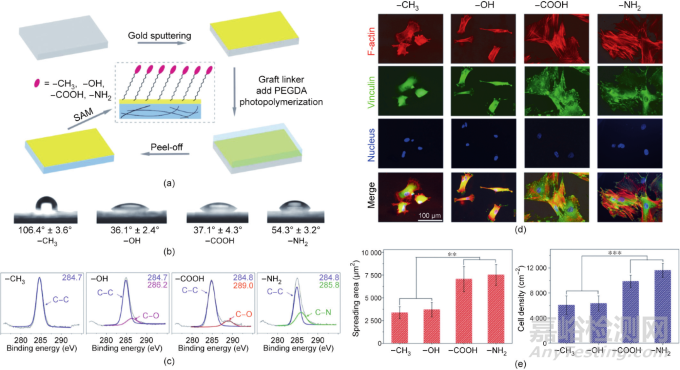
复旦大学丁建东团队开发了一种具有持久的细胞黏附反差的微图案,这使得在微图案表面上广泛研究干细胞分化成为可能。将光刻技术、大分子单体技术和转移光刻等技术相结合,在聚乙二醇水凝胶上制备了精氨酸-甘氨酸-天冬氨酸(RGD)多肽微图形。在这种强烈且持久的无污染背景下,大鼠单个MSC可以很好地定位在RGD微岛上,通过保持适合单细胞大小的不同形状的黏附微岛黏附力,研究发现细胞形状会影响MSC的分化,如图3所示。
图3. 利用材料表面微图案控制单细胞形状和研究细胞形状对干细胞分化的影响。(a)接枝RGD的不同形状的微米岛上的单细胞荧光显微图;(b)通过材料表面图案化控制单细胞黏附研究其对干细胞分化的影响。ALP为碱性磷酸酶,比例尺为25 μm。
利用独特的微图案化技术,丁建东课题组研究表明细胞大小(铺展面积)和细胞-细胞接触是调节干细胞分化的两个潜在因素。圆形形态有利于细胞的成脂分化,而成骨分化趋势与细胞受到的图案张力呈正相关。除了分化,细胞的形态、迁移和转录也受到不同表面结构材料的影响。
借助于独到的表面图案化技术,研究表明,除了细胞铺展的大小外,细胞-细胞接触的程度、细胞命运和其他细胞行为可以很好地控制,并显著地受到材料图案化的调节。
五、材料的电荷对细胞的影响
官能团作为关键的化学线索,已知会影响细胞的行为。据报道,羟基(—OH)和氨基(—NH2)端基表面比羧基(—COOH)和甲基(—CH3)端基表面更有利于成骨。Curran等发现经甲基(—CH3)、氨基(—NH2)、巯基(—SH)、羟基(—OH)和羧基(—COOH)基团修饰的细胞培养板上可见不同程度的MSC分化。至于引入到聚乙二醇水凝胶中的官能团,磷酸功能化的凝胶促进了MSC的成骨,而叔丁基功能化的凝胶促进了成脂分化。
细胞培养液中的蛋白质可以吸附在材料表面。根据耗散石英晶体微天平的测量,中性基团如—CH3和—OH表面的吸附蛋白质比带电的—COOH和—NH2表面的吸附蛋白质少。基于化学生物学的研究,丁建东团队揭示了官能团通过调节蛋白质吸附来调节干细胞分化,从而影响非特异性细胞黏附和干细胞的分化(图4)。
图4. 材料表面官能团影响细胞黏附和干细胞分化。(a)制备具有4种官能团的聚乙二醇表面,以考察官能团对骨髓间充质干细胞的影响。末端官能团分别为—CH3、—OH、—COOH和—NH2;SAM为自组装单分子膜;PEGDA为聚乙二醇二丙烯酸酯。(b)不同官能团修饰的水凝胶上的接触角。(c)X射线光电子能谱(XPS)检测修饰了不同官能团的材料表面上的C1s。(d)骨髓间充质干细胞在具有不同官能团的表面上诱导成软骨9天后,F-肌动蛋白、黏着斑蛋白和细胞核的荧光显微图。(e)统计骨髓间充质干细胞诱导成软骨后在不同功能基团表面的铺展面积和细胞密度(n = 4)。数据以均值±标准差表示,用单因素方差分析处理,**表示0.001 < P < 0.01,***表示P < 0.001。
六、材料基体刚度和生物力学微环境
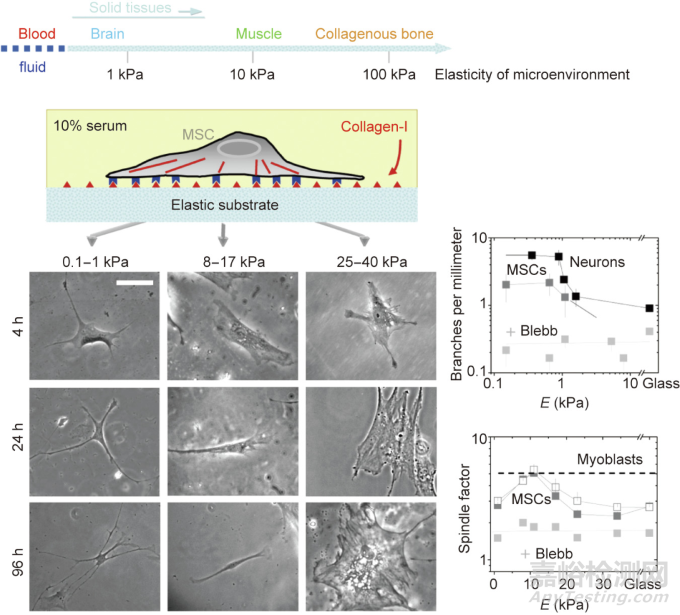
基质硬度(stiffness效应)为干细胞分化提供了一种关键的物理因素。美国宾州大学Discher等首次报道了基质材料的硬度会显著影响MSC的分化。如图5所示,MSC在柔软的基质上进行神经分化,在中等硬度的基质上进行肌源性分化,在硬质表面进行成骨分化。类似的实验结果后来在其他研究中也有报道,包括Schaffer等的研究。
图5. 基质软硬度调控干细胞分化的提出。干细胞在不同模量的基质上会有不同的分化趋势。+Blebb指加入Blebbistatin(一种选择性的非肌球蛋白的细胞渗透性抑制剂),以在一定程度上破坏细胞骨架。
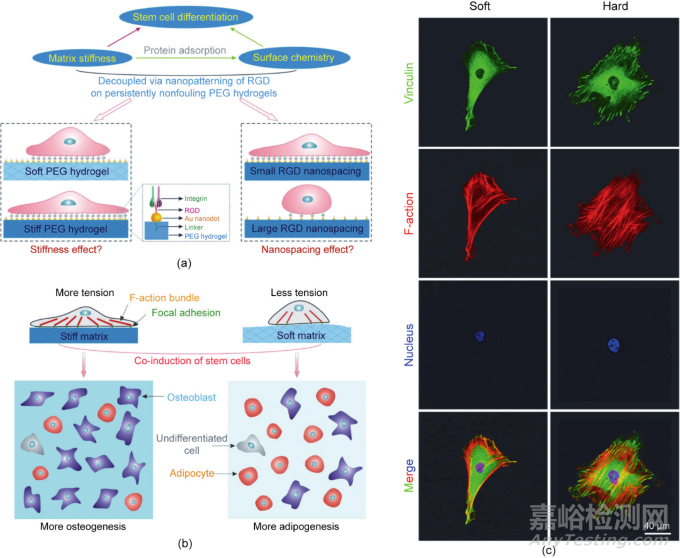
虽然stiffness效应可以被认为是材料相关细胞微环境历史上的一个里程碑,但它曾经受到其他人员的质疑。当Discher的团队改变聚丙烯酰胺(PAAM)的模量,然后使用生物大分子进行表面修饰以增强细胞黏附时,他们试图保持相同数量的表面接枝和蛋白质的吸附。然而,欧洲的一些研究小组认为,考虑到细胞的敏感性,这是不可能的,他们声称可能是潜在的表面化学而不是基质硬度导致了细胞反应的差异。这个“表面化学因素”的论点后来被Discher教授曾经的弟子、美国加州大学圣地亚哥分校的Engler等所反驳。但是,在欧美双方各自的实验中,基质刚性和表面化学是耦合的,因此,很难彼此说服对方。显然,很有必要开发一种能够严格解耦基质刚性和表面化学的模型材料系统,以设计决定性的实验。
复旦大学丁建东课题组开发了一种独特的表面纳米技术,用于在强烈抗污的聚乙二醇水凝胶上通过转移光刻技术制备牢固固定的规整的细胞黏附多肽RGD的纳米阵列。这些纳米点最初是通过嵌段共聚物胶束纳米光刻生成,并且得到了良好控制。如果将相同的纳米图案转移到具有不同大单体长度或不同浓度的交联型聚乙二醇水凝胶上,则有可能获得具有相同表面化学和可调基质刚性的材料。在这种严格的条件下,观察到了不同的干细胞分化程度,这种确定性实验为stiffness效应提供了坚实的证据。
此外,尽管成骨是正常的,但在基质硬度的情况下观察到脂肪生成的“异常”程度。最终,丁建东团队用细胞-细胞接触和细胞-基质接触统一在基质刚性效应下解释了这些有趣的行为。来自硬质水凝胶的强烈机械反馈导致F-肌动蛋白复合体的激活增加和更强的细胞张力。相应的内-外-内感觉导致成骨增加[图6(a)和(b)]。细胞通常在硬质水凝胶表面更为铺展。在硬质水凝胶上观察到纽蛋白密集分布在细胞周围以及显著的肌动蛋白细丝,这表明细胞张力更高,如图6(c)所示。有趣的是,美国的Chen等使用不同高度的微阵列来调整基础材料的硬度。他们发现,软质微柱有利于成脂分化,而硬质微柱有利于成骨分化。
图6. 基质软硬度调控干细胞分化的决定性实验。(a)研究基质硬度对干细胞黏附和分化的影响的示意图。(b)细胞黏附配体的基质硬度和纳米级空间效应直接决定干细胞的命运。(c)RGD纳米图案化的PEG水凝胶上的细胞黏附荧光显微照片。干细胞在基质上黏附24 h,然后免疫荧光染色显示黏着斑蛋白(绿色)、F-肌动蛋白(红色)和细胞核(蓝色)。
生物材料的软硬度影响细胞分化,也影响组织再生。例如,一些金属植入物超过了骨的硬度,从而形成应力屏蔽,阻碍了成骨和破骨的正常过程,而软支架可能无法承受组织的力学要求。此外,stiffness效应也会影响神经组织。据报道,在中枢神经系统植入刚性材料后,免疫反应增加。因此,在组织工程中必须考虑组织硬度和材料硬度的匹配。值得注意的是,有报道称植入水凝胶后的脊髓可以通过超声弹性成像作为一种非侵入性临床建立的工具在犬模型中进行半定量。期待关于基质软硬度和生物力学微环境的全面研究。
七、材料的表面改性
复旦大学丁建东团队基于其独特的纳米颗粒技术和精心的实验设计所进行的一系列严格实验不仅支持了美国Discher等最初提出的stiffness效应,而且还验证了欧洲Watt等提出的表面化学效应。在聚乙二醇水凝胶上的RGD纳米涂层技术可以将基质刚性和表面化学的影响解耦,也可以通过将不同纳米尺寸的纳米颗粒转移到具有相同基质刚性的水凝胶上来简单地检测表面化学。进一步,丁建东团队揭示了调控细胞行为的重要纳米因素。
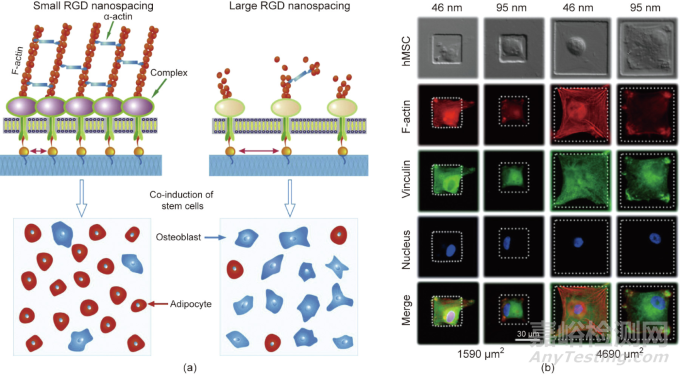
RGD纳米点是干细胞分化的内在调节因子,适合于研究表面修饰和结构对细胞的影响。只有当RGD在ECM或材料衬底上的纳米间距小于约70 nm的临界值时,才能很好地形成生物学意义上的焦点黏附,如图7所示。到目前为止,RGD修饰已被发现影响细胞的黏附、迁移、增殖、分化和去分化。
图7. 基于微纳米图案化表面技术发现材料表面RGD黏附多肽的纳米间距可以调控干细胞的特异性黏附和分化。(a)RGD纳米间距对干细胞分化的影响;(b)RGD微/纳米复合模式的制备及其干细胞分化的研究。
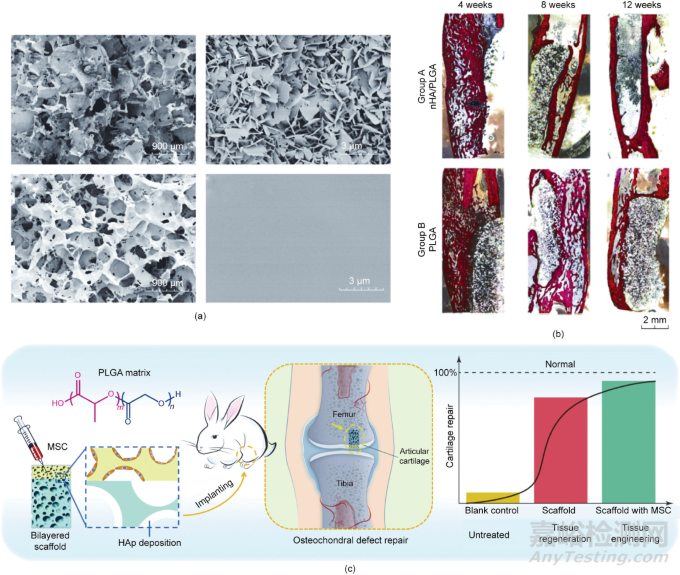
生物材料表面改性是在不改变材料本体性能的前提下,提高生物材料的生物相容性和调节生物活性的有效途径。材料表面改性包括化学改性和物理改性,表面改性的方法通常包括浸渍法、涂层法、接枝法和等离子体处理等。例如,羟基磷灰石(HAp)是骨的一种天然成分,经常用于改性骨修复材料的表面。羟基磷灰石存在于自然骨中,可以促进成骨细胞的增殖和代谢。如图8所示,纳米羟基磷灰石(nHA)修饰的PLGA支架比纯PLGA支架有更好的再生效果。物理修饰通常是通过调节支架表面的拓扑形态或粗糙度来实现的,从而控制细胞的黏附、增殖和分化。已有研究证实,微米级粗糙度支架有利于骨髓间充质干细胞的黏附,不妨碍骨髓间充质干细胞的增殖和成骨分化。Kim等揭示了具有不同和合适的拓扑表面的三维多孔支架可以同时刺激成骨和软骨生成,从而为双层骨软骨修复提供了一种设计策略。
图8. 基于具有改性内表面的多孔支架的组织工程和原位组织再生。(a)含羟基磷灰石涂层的PLGA支架的孔表面的场发射扫描电子显微镜(FE-SEM)图像(上图);未经处理的PLGA支架的孔表面的FE-SEM图像(下图)。(b)骨修复再生的组织学图像显示纳米羟基磷灰石涂层的PLGA支架具有较好的成骨能力。(c)PLGA多孔支架再生关节软骨和软骨下骨的示意图。
对于牙齿或骨组织再生材料,通常采用表面改性来改善骨整合。关于植入物与软组织的生物黏合,聚多巴胺的良好多功能黏附性为生物大分子与甚至化学惰性表面的共价结合提供了一个很好的选择,被广泛用于增强材料表面的生物活性。使用肝素或其他生物活性分子对血管移植物进行表面修饰可以有效地提高血液相容性,从而防止人工血管移植物中的血栓形成。Swartz等在用肝素和血管内皮生长因子依次功能化的小肠黏膜下层的基础上,研制了一种无细胞组织工程血管。一些生物活性成分可以促进血管形成和成骨。例如,Qi等报道去铁胺促进骨髓间充质干细胞的骨再生和内皮细胞的血管生成。
八、展望
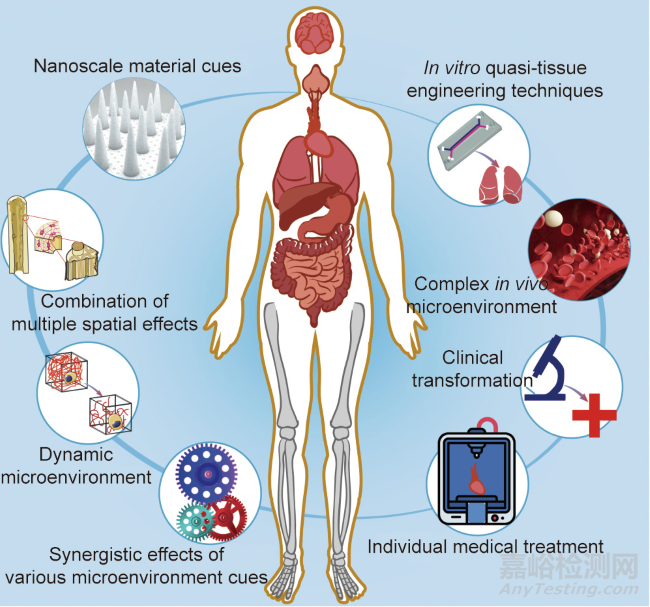
近年来,组织工程和组织再生技术有了长足发展。细胞与材料相互作用的基础研究丰富了生物医学材料的设计,并提出了利用生物活性因子来改善生物材料的相容性和活性的策略。模块化自组装和生物3D打印在组织工程以及再生支架的设计和制造方面提供了前所未有的灵活性和潜力。虽然以上方面已经取得了很大进展,但仍有一些关键问题需要关注,如图9所示。
图9. 组织工程与细胞微环境需要关注的研究方向。
(1)纳米因素对各种细胞行为的影响。最近发现,细胞可以微妙地感知和响应复杂的生命系统的纳米级特征。细胞黏附配体的纳米尺度空间排列为细胞分化提供了一种新的独立调节因子,在再生医学的生物材料设计中应予以考虑。在不久的将来,我们相信研究人员将揭示更多的材料纳米因素来影响各种细胞行为。
(2)组织工程多孔支架的多重空间效应组合。虽然已经对影响细胞的生物材料的各种几何特征在宏观、介观和微观水平上进行了研究,但生物体的结构是复杂的且梯度变化的。为了更好地模拟生物的层次性,制备具有多尺度响应的多孔支架成为一种途径。
(3)体内复杂的微环境,如植入生物材料后的免疫反应等。异物免疫反应可以由巨噬细胞或异体细胞所引起,是植入医疗器械、假体或生物材料后的终末期炎症反应。由生物材料支架驱动的免疫介导的组织再生正在成为一种修复受损组织的创新再生策略。使用生物材料调控适应性免疫系统可能会促进局部或全身免疫反应的疗法,最终刺激组织的修复再生。
(4)材料降解和动态微环境。理想的组织工程和再生材料应该是可生物降解的,研究者已经做出了努力来调整各种材料的生物降解性。此外,生物成像技术促进了对这一生物降解过程的检测。
脱细胞基质是动态的,植入体内的生物材料受到物理、化学和生物信号以及应力载荷的影响。为了概括细胞外基质的动态性质,许多可逆的化学物质已经被结合到生物材料中,以调节细胞扩散、生化配体呈递和基质力学。在这种长期而复杂的作用下,支架材料可能会出现复杂的结构破坏或分子断裂,因此,生物材料的设计应慎重。除了降解产物的影响,最近发现降解速率提供了一个动态因素来调节细胞在设计良好的水凝胶上的黏附和分化。材料降解过程中不可避免地伴随着材料与细胞接触的变化,从而为细胞创造了动态的材料微环境。快速降解环境中的细胞可能会感受到材料变化的影响,导致细胞活化以及细胞骨架重建和更高的牵引力。动态微环境正成为组织工程和组织再生领域的研究热点。
(5)各种微环境因素的协同效应。细胞微环境包括与材料因素和非材料因素相关的综合考量。这些因素之间错综复杂的关系决定了与生物材料相关的细胞微环境。今后应更加重视不同因素之间的协同作用,以调节细胞微环境。
(6)体外准组织工程技术的发展与应用。体外组织工程技术的发展,如器官芯片或类器官(organoid),帮助我们更好地了解组织的再生过程。这种体外构建设备和技术也可以用于大规模药物筛选。此外,利用水凝胶或其他材料帮助多个细胞形成有序细胞簇的类器官是准组织工程的一个很有前途的趋势。
(7)体内组织工程的精密生物材料制造和个性化医疗。随着精准医疗和个性化医疗的出现,支架结构的定制和设计变得越来越重要。3D打印是构建定制组织工程支架的前沿技术,但仍有一些关键技术需要改进,特别是在准确性和可靠性方面存有改进空间。
(8)生物材料和组织工程的临床转化。工程化组织和再生组织的长期转归仍然没有定论。此外,目前尚不清楚早期移植细胞在原位组织再生中的作用和最终命运。临床转化中应更加重视生物材料的标准化。随着工业化需求的增加,批量制造和检测的标准化问题变得突出。
总而言之,组织工程学已经为修复受损组织或构建新组织来治疗多种疾病铺平了道路。植入生物活性材料支架后的原位诱导也可用于体内组织再生。尽管组织工程和再生医学在体外和小动物研究方面取得了快速进展,但在实现临床和商业转化方面的进展低于预期。随着多学科的融合,特别是与材料相关的微环境的研究深入,人们希望在组织工程和组织再生方面取得更大的进展,造福人类。组织工程中细胞微环境的未来研究有望促进生物活性材料的模块化集成和精准医学的逐步实现。