您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-02-01 10:50
输尿管支架放置于肾盂与膀胱之间,用于对人体输尿管进行支撑和引流。体内滞留时间小于30天。
根据《医疗器械分类目录》及有关的分类界定文件,产品管理类别为Ⅱ类,分类编码为14-05-05。
一、输尿管支的结构组成
输尿管支架通常由硅橡胶、聚氨酯或其他聚合物制造,单端或双端有环状弯曲,可包含推送器(管)、矫直器(管)、导丝等配件,也可含有缝线、涂层、显影材料等结构。输尿管支架可按形状(单端弯曲或双端弯曲)、长度、管径等不同分为若干型号与规格,以无菌形式提供。
常见产品外形结构图见图1、图2。
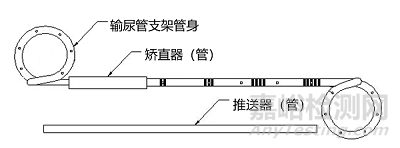
图1 双端弯曲输尿管支架结构示意图
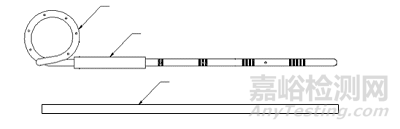
图2 单端弯曲输尿管支架结构示意图
二、输尿管支架主要风险
根据YY/T 0316《医疗器械风险管理对医疗器械的应用》附录E对“输尿管支架”已知或可预见的风险进行判定,产品在进行风险分析时至少应包括以下的主要危害,还应根据自身产品特点确定其他危害。
表1 产品主要危害
|
危害的分类 |
危害的形成因素 |
可能的后果 |
|
|
生物学危害
|
生物污染 |
生产环境控制不好。 灭菌操作不严格。 包装破损。 使用时操作不正规。 |
产品带菌,引起患者使用时局部炎症反应。
|
|
生物不相容性 |
原材料、器械产生的物质(如硫化剂残留等)生物相容性差; 包装材料生物相容性差;包装破损或密封性不良引入生物相容性差的物质;环氧乙烷灭菌后灭菌解析不充分。 |
产生毒性或刺激。 |
|
|
不正确的配方 (化学成分) |
未按照工艺要求配料。 添加剂或助剂使用比例不正确。 |
有可能引起小分子物质残留量过大,造成毒性危害。 |
|
|
再感染和/或交叉感染 |
使用不当、标识不清。 |
引起局部、交叉感染。 |
|
|
化学危害 |
毒性 |
不正确的配方。 加工工艺控制不严格,后处理工艺控制不严格。 产品及包装材料中有害物质析出。 聚合物降解后的小分子单体。 |
产生毒性或刺激。 |
|
环境 危害 |
储存或运行偏离预订的环境条件 |
储运条件(如温度、湿度)不符合要求。 |
产品老化。 无菌有效期缩短。 |
|
意外的机械破坏 |
储运、使用过程中发生意外的机械性破坏。 |
产品使用性能无法得到保证。 |
|
|
由于废物和/或医疗器械处置的污染 |
使用后的产品没有按照要求集中销毁。 |
造成环境污染或者细菌的交叉感染。 |
|
|
与医疗器械使用有关的危害
|
不适当的标记
|
标记不清晰、错误、 没有按照要求进行标记。 |
错误使用。 储存错误。 产品辨别错误。 |
|
不适当的操作说明,如: (1)器械一起使用的附件规范不适当 (2)规范不适当 (3)说明书过于复杂 |
包装破损无法识别。 操作要点不突出。
|
无法保证使用安全性;导致操作失误。 |
|
|
由不熟练/未经培训的人员使用 |
操作不熟练、操作失误。 |
手术失败; 造成输尿管损伤。 |
|
|
可预见的误用 |
规格型号选用错误。 |
导致无法达到满意的输尿管支撑或引流效果。 |
|
|
对副作用的警告不充分 |
对操作人员警示不足。 |
重复使用。 二次灭菌后使用。 使用者出现刺激反应。 |
|
|
对一次性使用医疗器械很可能再次使用的危害警告不适当 |
造成重复使用。 |
交叉感染。 |
|
|
不适当不合适或过于复杂的使用者接口 |
违反或缩减说明书、程序等 |
操作方法、注意事项、储存方法、警示事项等表述不清。 |
重复使用引起感染。 没有集中销毁造成环境危害等。 |
|
功能性失效、维修和老化引起的危害 |
对医疗器械寿命终止缺少适当的决定 |
没有标识产品有效期。 |
超出有效期的产品被使用,造成细菌感染。 |
|
不适当的包装(医疗器械的污染和/或变质) |
没有进行包装确认。 |
不能确保产品无菌,从而导致出现细菌感染。 |
|
|
再次使用和/或不适当的再次使用 |
产品标识没有明确只限一次性使用。 |
出现细菌感染、交叉感染以及粘膜损伤等现象。 |
|
三、输尿管支架性能研究实验要求
输尿管支架产品的部分检验方法,可参考相应行业标准YY/T 0872《输尿管支架试验方法》。若对标准中的试验方法有所修改,应对修改内容进行验证。
1.通常应考虑(但不限于)以下性能指标。
1.1物理性能:外观;尺寸;固定强度;断裂强度;伸长率;动态摩擦力(适用于声称“低摩擦”的产品);与配件的配合性能;耐弯曲;缝线结合强度(适用于带缝线可取出的产品)。
1.2化学性能:pH;重金属;紫外吸光度;还原物质;蒸发残渣;用环氧乙烷灭菌的产品应规定环氧乙烷残留量的要求;由硅橡胶制成的产品可参考YY 0334《硅橡胶外科植入物通用要求》制订产品的化学性能要求。
1.3无菌。
1.4细菌内毒素(如适用)。
1.5如产品包含相关配件,还应制订配件的性能指标。如金属导丝的耐腐蚀等。
2.产品性能研究
应当开展产品性能研究以及产品技术要求的研究,明确性能指标及其确定依据,所采用的标准或方法、采用的原因及理论基础、验证的样本量及依据,对制订的产品性能指标进行验证。
性能验证项目包括但不限于:尺寸、外观、耐弯曲、缝线结合强度(适用于带缝线可取出的产品)、力学性能(如抗压等)、涂层相关性能(如适用)等。申请人应根据具体产品特性,考虑需增加的性能研究项目,对于以上列举的项目中,如有不适用项,亦应说明具体理由。
3.生物学特性研究
输尿管支架是与黏膜(尿路上皮)接触的产品,生物相容性评价应遵循GB/T 16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》及《医疗器械生物学评价和审查指南》相关要求。生物相容性评价应考虑(包括但不限于)以下方面:
(1)生物相容性评价的依据和方法。
(2)产品所用材料及与人体接触的性质。
(3)实施或豁免生物学试验的理由和论证。
(4)对于现有数据或试验结果的评价。
若开展生物学评价试验,应参照GB/T 16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》确定,建议至少考虑:细胞毒性;致敏性;黏膜刺激或皮内反应。
4.灭菌研究
按GB 18279.1《医疗保健产品灭菌环氧乙烷第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求》、GB/T 18279.2《医疗保健产品的灭菌环氧乙烷第2部分:GB 18279.1应用指南》、GB18280.1《医疗器械保健产品灭菌辐射第1部分:医疗器械灭菌过程的开发、确认和常规控制要求》、GB 18280.2《医疗保健产品灭菌辐射第2部分:建立灭菌剂量》、GB/T 18280.3《医疗保健产品灭菌辐射第3部分:剂量测量指南》、GB 18281.2《医疗保健产品灭菌生物指示物第2部分:环氧乙烷灭菌用生物指示物》等标准的要求开展灭菌研究。
应明确灭菌工艺(方法和参数)和无菌保证水平(SAL),无菌保证水平应达到10-6。如灭菌使用的方法容易出现残留,需开展研究明确残留物信息及处理方法。
5.稳定性研究
货架有效期研究:可以开展实时老化研究,也可以开展加速老化研究,加速老化可按YY/T 0681.1《无菌医疗器械包装试验方法第1部分:加速老化试验指南》和《无源植入性医疗器械货架有效期注册申报资料指导原则》要求开展产品及包装的效期验证,其中“室温或环境温度(TRT)”应选择能代表实际产品储存和使用条件的温度,建议开发人采用保守值设计。
包装及包装完整性研究:可参照GB/T 19633.1《最终灭菌医疗器械包装第1部分:材料、无菌屏障系统和包装系统的要求》及YY/T 0698系列标准《最终灭菌医疗器械包装材料》开展产品的包装研究。包装性能的测试方法可以参照YY/T 0681.2《无菌医疗器械包装试验方法第2部分:软性屏障材料的密封强度》、YY/T 0681.3《无菌医疗器械包装试验方法第3部分:无约束包装抗内压破坏》、YY/T 0681.4《无菌医疗器械包装试验方法第4部分:染色液穿透法测定透气包装的密封泄漏》等标准进行。
6.动物试验
如适用,应当明确动物试验研究的目的和结果。
7.其他研究
对于列入《免于进行临床评价医疗器械目录》(以下简称《目录》)的输尿管支架产品,应按照《列入免于临床评价医疗器械目录产品对比说明技术指导原则》开展如下研究:
(1)应将产品相关信息与《目录》所述内容进行对比;
(2)若经对比,产品与对比产品存在差异,应开展差异部分对安全有效性影响的分析研究。二者的差异不应引起不同的安全有效性问题,即产品未出现对比产品不存在的且可能引发重大风险和/或引起显著影响有效性的问题。
若无法证明产品与《目录》所述的产品具有基本等同性,则应开展临床评价。

来源:嘉峪检测网


