您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-11-24 21:31
这几天,小编一直在完善课题的质量标准草案,当时的感觉是"没有60度的酒,却特想说说自己的故事"。
质量标准的起草不像是小编发的朋友圈,一幅美景,一杯咖啡或茶,摆一个美美的POSE,伪装一下形象就妥了。更不能因为拥有高屋建瓴的理论水平,而忽略脚踏实地的实践。
做药品研发需要目标明确,路径自信,始终明白所写所做。
比如:检查项下每个内容的独特性、"对照溶液"与"对照品溶液"绝对不是一个概念、有关物质中各种溶液的书写也不是简单的罗列······
下面这篇文,希望可以和大家一起讨论,仁者见仁智者见智,不同的视角、不同的实践,才能汇聚新奇有趣的观点!
首先小编简单列一下制剂质量标准的顺序:名称与限度 、处方与制法、性状、鉴别、检查、含量测定、类别、规格、贮藏。
名称与限度
名称
药品的名称是标准的首项,包括中文名,汉语拼音,英文名。由原料药名和剂型名两部分组成,命名原则为——《中国药品通用名称命名原则》。
中文名
顺序上原料药名列在前,剂型名列于其后。

遇到说明剂型或用途的形容词,则列于原料药名之前,如注射用更昔洛韦、灭菌注射用水。


汉语拼音名
相对比较简单,只说几个关注点:
1.拼音中遇有与前一字母能合拼读出其他音的,要用分音符号,如组氨酸。

2.药名较长,一般5个字以上,应按音节分开拼音,如甘油果糖氯化钠注射液。

3.药名、剂型和形容词应分组拼音。


英文名
与中文名相同,顺序仍然是原料药在前、剂型名在后;形容词写在名词前。
但要注意剂型名的单、复数。并且每个字的第一个字母要大写,其余小写,但前置词一律小写。


来源与限度
来源
注射剂需写明简要来源:
凡用热压法或其他适宜方法灭菌制成的,称“灭菌水溶液”、“灭菌油溶液”或“灭菌粉末”。


凡用于无菌操作制成的称为“无菌粉末”,经冷冻干燥制成的称为“无菌冻干品”。
对加有稳定剂或附加剂的,由于一般不另列“处方”,应标明。
含量和效价
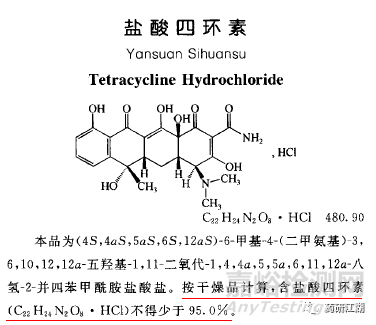
1.化药制剂的含量,一般按照其原料药的分子式(包括结晶水和盐类药物的酸根或碱金属盐)进行计算(盐酸吗啡片)。

2.由于用药剂量或习惯原因,有些品种需按无水物或按有效的盐基或有效物质进行计算。
3.除盐酸四环素外,抗生素类制剂一般均按有效部分进行计算。
限度的描述
一般均按标示量计算。
当标准中列有“处方”或未列“规格”时,则规定其百分浓度或每一单元制品中含有量的范围。

对于粉针剂来说有以下几种情况:
1.除特殊情况外,一般均按“装量差异”项下的平均装量计算。

2.检查项下列有“含量均匀度”的,按平均含量计算。
3.部分抗生素粉针剂还应制定纯度要求。
4.含量测定另有其他规定的,如注射用门冬酰胺酶。

处方和制法
处方
单味制剂一般不列处方。
如所用的某些附加剂或辅料以及处方方法直接影响该制剂的有效性或稳定性,但又没有保证质量的相关措施时,应列出“处方”。
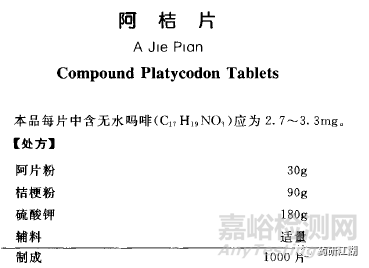
处方中应列出与该制剂质量密切相关的每一组分,按总量1000片计算。

对于某些对制剂质量影响较小、且符合“凡例”和“制剂通则”中有关规定的防腐剂或色素,不要求写出具体的品名和用量。

对于不能完全依靠含量测定项下的方法控制有效组分的复方制剂,为保证制剂质量,需在标准中增加“处方”,同时略去“规格”。
但含有不同装量和浓度的复方注射液,不能用一个“处方”加以固定,应保留“规格”。
制法
并不是每种制剂都需要列出“制法”。但下面两种情况需要列出“制法”:
1.对于《中国药典》制剂通则中未收载的剂型,并且又需要强调制法。
2.有制剂通则,但其制法不同于“通则”的,均应在列有“处方”的前提下写出简要的制法,但叙述不易过细。

性状
性状项下,应依次描述制剂的颜色和外形。
1.片剂:薄膜衣片、糖衣片或肠溶衣片,应在除去包衣后,就片芯的颜色进行描述。

2.液体制剂:应注意溶液颜色的描述与检查项下色号的对应关系,几乎无色≤0.5号,微黄色≤1、2和3号,淡黄色≤4、5和6号,黄色≤8号

3.栓剂:由于脂肪性基质和水溶性基质的“融变时限”不同,因此应在色、形之前加以说明。
4.胶囊剂:对内容物的性状予以描述。

5.其他:如有特有的臭、味、引湿性及溶解性,或影响外观性状的常见情况,以及遇光变质等,可继叙述以后,其间以“;”断开。

6.赤橙黄绿青蓝紫可以写入标准,其他颜色不允许。
鉴别
鉴别的方法必须具有专属性,可以采用与其原料药相同的方法,除此之外,还需注意:
1.红外:应明确规定供试品的处理方法。

2.含量测定采用色谱法时,可用其保留时间作为鉴别;采用光度法时,可用最大吸收波长或特定波长间吸光度的比值作为鉴别。
3.制剂中主要含量低的,可采用专属性强、灵敏度高的TLC或HPLC鉴别。
4.复方制剂中除了辅料外,不要忽略共存物的干扰。
5.制定的鉴别试验应与同类药物或化学结构相近药物相区别。

6.如标准中同时列有两个专属性强、灵敏度高的方法,可考虑仅选用其中一种方法做鉴别。
读到这,请大家继续坚持,每一项的书写都需要字字斟酌,句句揣摩,不能让标准成为空中楼阁或是纸上谈兵,而不具备实际操作意义。
检查
pH值或酸度、碱度及酸碱度
酸度,碱度及酸碱度用于固体制剂,而液体制剂直接用pH值表示
颜色
液体制剂可直接描述颜色,固体制剂则需说明其溶液的颜色
有机杂质与有关物质
该项应该是大家普遍关心的重点。小编叙述不全面的地方欢迎大家补充。
制剂中的已知杂质都应附在标准后面,用罗马数字编号,写明化学名、英文名、结构式、分子式和分子量。
制剂与原料药标准统一时,一定要注意杂质序号的变化,同一序号的杂质一定要确认是相同的,制剂项下的已知杂质引用时采用“原料药名称+杂质名称”。
使用杂质对照品溶液时,杂质含量计算要写成“按外标法以峰面积计算,不得过XXX标示量的XX%”;有外标法计算的已知杂质时,杂质总量一般不用峰面积表示,应分别列出已知杂质限度、单个未知杂质限度、未知杂质的总量。
应设定忽略限,如:峰面积小于对照溶液主峰面积0.05倍的杂质忽略不计。
有关物质检查,仅用自身对照溶液的,不用精密称定,有对照品溶液的要精密称定。
可以制定“灵敏度溶液”,一般为限度溶液的十分之一。
系统适用性试验中最好制定分离度的要求,并且有明确有效的分离度要求时,可以不要理论塔板数。
以高效液相色谱法为例,一般书写顺序为:供试液的制备、对照溶液的制备(包括自身对照品、对照品溶液)、灵敏度溶液、测定方法、色谱柱、流动相、流速(不显示时,默认为1ml/min)、洗脱方式、检测波长、分离度要求、灵敏度要求、限度要求。

注射用无菌粉末或冻干品的干燥失重或水分
使用烘箱的,要注明烘箱的温度;使用干燥器的,要注明所用的干燥剂;用减压干燥的,要写明“减压干燥”;恒温减压干燥的,要写明干燥剂与温度。
限度需根据药品的物理性质和实测数据,并结合稳定性的影响制定。一般仅规定一个高限。
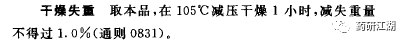
静脉输液的重金属
静脉输液,因其注入体内的用量较大,应对其重金属进行检查,其限度的表示方式可根据其主要含量或其容量计算。如:肌苷葡萄糖注射液。

渗透压
制备注射剂、滴眼剂等药物制剂时,必须考虑其渗透压。如:复方门冬维甘滴眼液。

含量均匀度
2015年版开始,药典附录含量均匀度检查项由A+1.8S≤15修改为A+2.2S≤15。
检查方法应尽可能与“含量测定”项下方法相同。
以含量测定项下测得的每瓶头孢他啶含量计算,应符合规定(通则0941)。如:马来酸氯苯那敏滴丸

溶出度
应具体写明选用的方法,并注明溶出介质及其用量、转速、取样时间、测定方法及限度等。如:阿司匹林肠溶片。

生物安全性检查
在此不做详细叙述
制剂通则中的有关规定
其他应符合XX制剂下有关的各项规定(通则0101)。
含量测定
一般当其原料药的含量测定方法可以完美排除辅料的干扰,且较为简便时,制剂可首选原料药的测定方法。
提示
抗生素类原料药纯度均以有效成分表示,与制剂规格中计算基准一致,而化学药品的原料药纯度与制剂规格中计算基准不一致时,应在最后给出换算因子。如:注射用氢化可的松琥珀酸钠。

取样量
1.常规片剂、栓剂或滴丸剂的取样量为20片(或粒);部分抗生素、生化药品及价格昂贵的片剂,在满足平行两份测定测定时,可用10片(或粒)。
2.若主药含量低微,取20片不够两份测定时,应根据两份测定的取样量与该制剂的“规格”计算供试品的取样数量,并以5的倍数计。
3.对于规格不同的品种,应分别注明。
4.包衣片的取样量同前述,若包衣不影响测定,可取包衣片10片(个别例外)。
5.注射用无菌制剂、胶囊或软胶囊,一般规定“取装量差异项下的内容物”。
6.注射液或其他液体制剂,则为“精密量取本品适量”,对于粘稠的液体,要强调用内容量移液管,并洗出移液壁的附着液。如:紫杉醇注射液。

类别
单味制剂的“类别”,如在其原料药中已有收载并与之完全相同时,可书写为“同XXX原料药名”,如:同盐酸普鲁卡因(盐酸普鲁卡因注射液)。
复方制剂则应全部写出,如:镇咳祛痰片阿桔片。
规格
规格是指片剂的每片、注射剂或滴眼剂的每支、胶囊剂或栓剂的每粒或其他每一个单位制剂中含有主药的重量(或效价)或含量(%)或装量。
1.当按有效部分计算时,一般应以分子式表示,而不用中文名,并应与其含量项下相呼应。
2.液体制剂还应注明每支的容量;多剂量的制剂也可用浓度%表示。
3.制剂规格在0.1g以下的用“mg”为单位,0.1g以上的用“g”为单位;若同时存在于一个制剂项下,则统一为单位,即小的规格如用“mg”表示,超过0.1g的较大规格也采用“mg”为单位。如:蒿甲醚胶囊。
4.一个制剂有多种规格时,从量小到量大排列。

贮藏
贮藏是对药品贮存与保管的基本要求。
1.片剂或其他制剂:可根据药品的性质与制剂通则有关规定以及原料药的贮藏项下规定进行描写。
如:密闭,在凉暗处保存
遮光、密封,室温保存
密封,在阴凉处保存
2.对于容器直接接触药品的制剂(如:分装注射液的安瓿、注射用粉针剂的分装容器、分装眼膏的灭菌容器、分装滴眼液):可视为各该制剂的组成部分,因而在贮藏项下对包装的要求,可写为“密闭保存”等,而不用“熔封”或“严封”。


来源:铭研医药


