您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-19 22:29
今年浙江大学口腔医学院、浙江省口腔疾病临床研究中心、浙江省重点实验室、浙江大学肿瘤中心联合在Colloids and surfaces. B, Biointerfaces杂志发表题为 Nanomaterial-based cell sheet technology for regenerative medicine and tissue engineering 的文章。
在这篇综述中,主要列出了光诱导细胞薄片技术、热响应细胞薄片技术、磁控制细胞薄片技术、活性氧诱导细胞薄片技术四种不同类型的基于纳米材料的细胞薄片技术、机理以及在组织工程和再生医学方面潜在的临床应用。
研究背景
纳米材料是指在三维空间中具有至少一个纳米尺寸(1-100nm)的材料;细胞薄片技术是一种新兴的无支架组织工程新方法,它可以提高细胞的生存能力并轻松将细胞移植到目标部位,是再生医学和组织工程的热门研究领域,其应用场景涉及骨、肌腱、肢体、心脏组织、骨骼机、牙种植体等。虽然基于纳米材料的细胞薄片技术有诸多优势,但是在将其应用于临床治疗之前还需要进行更多的基础研究。
技术介绍
1、光诱导细胞薄片技术
通过光诱导得到的细胞薄片以TiO2为代表,由于TiO2材料自身的优势而赋予其较强的紫外吸收能力和高效光催化活性等特性,这些特性可以提高生物效应的可用性,因此TiO2纳米点是光诱导细胞片技术中最常用的纳米材料。
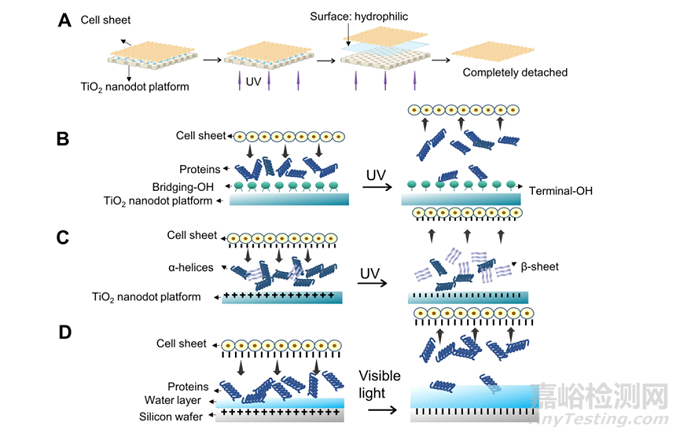
在细胞薄片的制备过程中主要通过紫外线照射改变TiO2的疏水性来实现,原理如下所示:
一般情况下细胞外基质是疏水的,没有照射的TiO2纳米点也是疏水性的,当经过紫外线照射后,通过照射转移的能量将电子转化为“光电子”,而失去电子的部分产生“电子·空穴对”。光电子将Ti4+转换为Ti3+,同时,电子空穴将O3-氧化成氧原子,氧原子离开空穴后水填充氧空位而形成亲水表面,这样细胞片便从材料表面分离出来(如图A);
在氧空位被水填充后末端羟基(TiOHT)与NH3+相互作用,在表面和细胞片形成蛋白质键,改变NH3+的数量和构象。由于结合蛋白的量减少,细胞片从表面脱离(图B);
紫外线照射后电子在表面累积,导致细胞膜带负电荷,而细胞片也带负电,这样两者之间由于排斥而分离(图C);
在可见光照射下材料表面上的电子累积,蛋白质被释放,水层密度增加,最终也会导致细胞片的分离(图D)。
2、热响应细胞薄片技术
通过热响应得到的细胞薄片以聚(N-异丙基丙烯酰胺)(PNIPAAM)为代表,这是一种可以在不同温度之间来回切换亲水性和疏水性的材料(温度为37℃时,材料表面为疏水性;温度为25℃时,材料转变为亲水性),但是基于该材料的水凝胶不能完全应用于细胞片分离。碳纳米管(carbon nanotubes , CNT)是一种典型的一维纳米材料,不仅具有碳材料的固有性质,还具有金属材料的导电性和导热性,其表现出的表面电荷、疏水性、亲水性、表面化学性质等有助于细胞薄片的脱离。
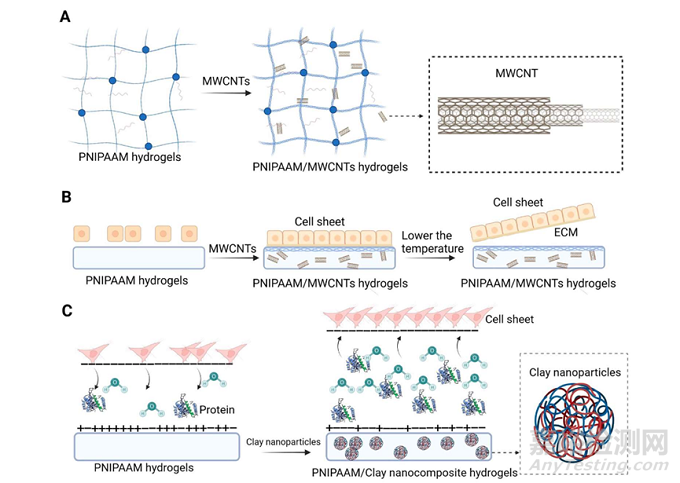
技术原理如下所示:
疏水性的多壁碳纳米管(multiwalled carbon nanotubes , MWCNTs)可以分散在PNIPAAM水凝胶中取代其亲水性成分,这种取代性会随着MWCNTs浓度的增加而增强,导致疏水性增强,有助于细胞的黏附,细胞的高黏附率和高增值率是细胞成功脱落的原因之一,最后通过降温作用将疏水性转变为亲水性,促使细胞薄片的脱落(图A-B);
由有机PNIPAAM和无机粘土网络组成的纳米复合(nanocomposite , NC)水凝胶可以吸收更多的牛血清白蛋白,有助于细胞粘附,最后细胞大量聚集、增殖形成细胞薄片并完整脱落(图C)。
3、磁控制细胞薄片技术
通过磁控制得到的细胞薄片以Fe3O4为代表,其优异的导电性和低毒性使其在生物学中广泛应用。
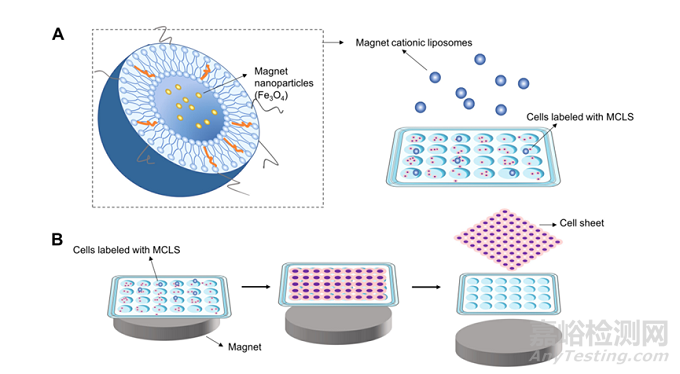
技术原理如下所示:
首先用由磁纳米颗粒(magnetic nanoparticles , MNP)制备的磁性阳离子脂质体(magnetic nanoparticles , MCL)标记细胞(图A);
然后将细胞培养在具有亲水性和中性电荷表面的24孔板中,在培养皿底部施加磁性材料诱导细胞粘附;
最后将磁性材料移除,细胞片便不再粘附而转移(图B)。
4、活性氧诱导细胞薄片技术
活性氧(ROS)是细胞氧化的产物,可参与代谢、凋亡、分化、细胞信号传导等,其包含的产物也可以用于调节基因表达、细胞信号转导和细胞信号传导级联的激活等,其来源分为细胞内ROS和细胞外ROS,在细胞薄膜的制备中主要依赖细胞外ROS来获得。
金纳米颗粒(AuNPs)是一种普通的光敏剂,具有强的光吸收能力,其在绿色激光照射下可以吸收能量转变为激发态,并反应产生ROS,因此可以通过AuNPs产生ROS的思路制备细胞薄片。
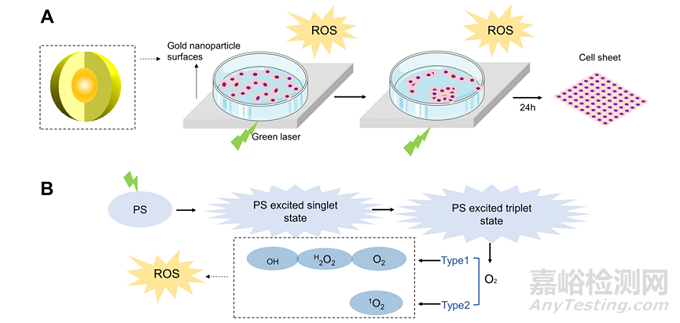
其技术原理如下所示:
金纳米颗粒在绿色激光的照射下产生ROS,破坏了细胞薄片和材料之间的细胞膜,导致薄片的脱落(如图)。
应用场景
基于纳米材料细胞薄片技术的发展,已经有研究将其应用于组织工程和再生医学中,如光诱导制造的细胞薄片在于骨再生和牙种植中的应用、磁控制制造的细胞薄片在骨再生、血管生成、心脏组织再生、骨骼机再生中的应用(如图所示)。
牙种植体骨整合
在牙种植手术中骨和种植体的结合占据关键位置,基于纳米材料的光诱导细胞片技术是增强骨整合的潜在方法。研究发现通过光诱导获得的骨髓干细胞薄片放置在牙植入物上后形成的复合物可以产生更加活跃的骨生长和骨整合。
骨增生
人类间充质干细胞是常用的移植细胞,其具有分化为成骨细胞、脂肪细胞、神经细胞、肌肉细胞和软骨细胞的潜力。研究发现通过光诱导获得的间充质干细胞和人脐静脉内皮细胞共培养的细胞薄片可以帮助骨再生,因为这两种细胞共培养得到的细胞薄片具有预血管化的能力,而血管网络可以参与骨的形成,最终造成骨增生。
心脏组织再生
心肌组织在疾病发生后再生能力有限,通过移植手段进行治疗后易发生术后免疫排斥等并发症,细胞薄片可能为心脏组织再生提供新的选择。研究发现利用磁控制方式制作的3D心脏模型有诸多优势,如组织中的心肌细胞可以均匀分布、可以自发收缩,并具有良好的收缩特性等等。

来源:和义广业创新平台