您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-08-11 07:27
本文我们来讲讲CDE和EDQM在药学变更事项、分类和研究工作的异同。首先我们要清楚国内原料药药学变更最重要的指导原则为CDE制定发布的《已上市化学药品药学变更研究技术指导原则(试行)》(2021年2月10日发布,发布即生效)。该指导原则包含了化学原料药(含无菌)和化学制剂的化学变更类型,其中具体跟原料药相关的变更事项共有六项,分别为 三、变更原料药生产工艺;七、变更生产批量;八、变更注册标准;九、变更包装材料和容器;十、变更有效期和贮藏条件;十二、变更生产场地。每种事项又根据对药品安全性、有效性和质量可控性产生影响的潜在风险,分为三类:重大变更、中等变更、微小变更。而在EDQM递交CEP变更时主要参照的指南为《GUIDELINE ON REQUIREMENTS FOR REVISION/RENEWAL OF CERTIFICATES OF SUITABILITY TO THE EUROPEAN PHARMACOPOEIA MONOGRAP》(2018年9月更新,2019年1月实施)。该指南适用于化学原料药(含无菌),草药,生物原料药(TSE),不包含制剂。其中涉及化学原料药药学的变更有五项1.生产(Manufacture)2. 最终产品控制(Control of the final substance)3. 容器密闭系统(Container closure system) 4. 稳定性(Stability)5. 设计空间和批准后变更管理方案(Design space and Post-Approval Change Management Protocols)。根据变更对最终产品质量的潜在影响分为通知(AN)、立即通知(IN)、微小(MIN)、重大(MAJ)。
下图为两个指导原则变更事项的对应关系:
从下图可以看出CDE和EDQM划分的原料药药学变更的事项基本是一致的,除了EDQM的第5类:设计空间和批准后变更管理方案。目前国内还没有实施该类变更,本文不做对比。
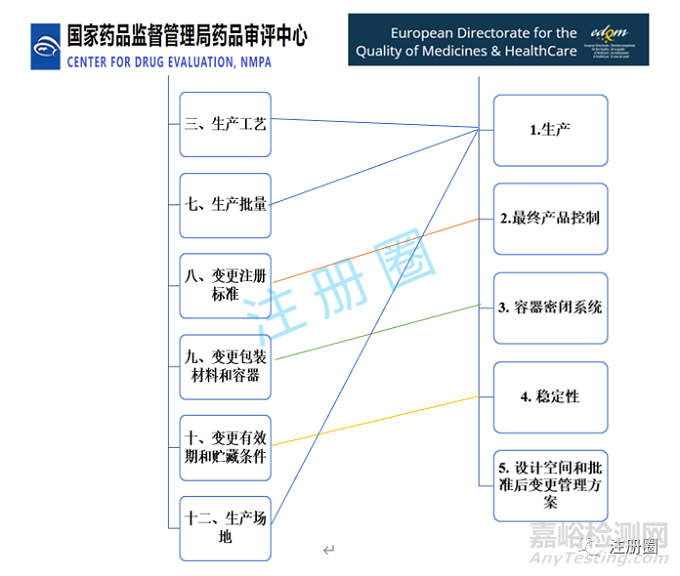
为了方便对比,下面按照CDE划分的变更事项逐一对两个药监机构的变更级别和研究资料要求进行对比。对于EDQM需要提交的一些声明信,在以下表格未列出。需要注意的是,CDE建议变更研究验证采用商业化生产规模样品,如采用中试规模样品,应提供充分的依据。而EDQM要求至少为中试规模。
生产工艺
|
变更分类 |
CDE |
变更分类 |
EDQM |
|
微小变更 |
1. 增加新的生产过程控制方法或制订 更严格的过程控限度,以更好地控制 品生产和保证药品质量。 如果上述变更是因为原料药生产过程中发现存在工艺缺陷或稳定性问题而进行的,应按照重大变更进行申报。 2. 提高起始原料、中间体的质量标准。 3. 变更原料药生产工艺中所用反应试剂、溶剂的质量标准或级别,但不降低反应试剂、溶剂的质量。 4. 变更最后一步反应之前的工艺步骤中使用的生产设备,或变更最后一步反应及之后工艺步骤中使用的生产设备且材质、设计和工作原理不变,原料药杂质谱或关键理化性质(如粒度、晶型等)不变。 5. 变更起始原料的供应商(指实际生产者,以下同),起始原料的合成路线不变,且起始原料的质量不降低。 |
AN |
1. 增加新的成品中控检测或增加起始物料/试剂/中间体质量标准项目/限度。 变更不是因为生产中意外事件引起的,且增加的项目不为关键项,例如不在其他步骤控制的含量,杂质,致突变杂质,元素杂质或所有关键物理特性,例如粒径分布、松密度或振实密度、鉴别检测、水分均为关键项。 2. 检测方法不变的情况下,收紧中控检测限度,或提高起始物料/试剂/中间体质量标准限度。 变更不是因为生产中意外事件引起。 3. 删除不重要的中控检测或起始物料/试剂/中间体 的质量标准项目。 变更不是因为生产中意外事件引起。 4. 轻微改变/更新中控/起始物料/试剂/中间体检测方法。 已根据相关指南进行了适当的验证研究,且显示更新后的检测方法至少等同于原来的检测方法。 5. 中间体或成品生产工艺轻微变更,预期不会对成品的质量、安全性或控制策略产生影响。 成品或中间体的质量标准保持不变,对成品杂质谱没有质和量的负面影响。(轻微指的是:合成路线保持不变,即中间体保持不变,没有新的试剂、催化剂或溶剂用于生产工艺(例如,操作条件无重大调整、设备无重大变更、增加返工步骤,即直接重复已批准的步骤、同一步骤内重复洗涤/精制操作、改变/升级无菌级别物料以外的设备)。 |
|
研究工作 |
|
研究工作 |
1. 已批准的和新的中控检测或起始物料/试剂/中间体质量标准项目/限度的对比表格;相关时,新的非药典分析方法的详细描述和验证数据。 2. 已批准的和新的中控检测限度或起始物料/试剂/中间体质量标准限度的对比表格。 3. 已批准的和新的中控检测或起始物料/试剂/中间体质量标准项目/限度的对比表格;CEP 持有人对删除的中控检测没有重大影响原因的风险评估。 4. 同1 5. 根据已批准的和新的工艺各生产的至少两批(最小批量为中试批量)成品的批分析数据(采用比较表格);已批准和新的工艺的直接对比。 |
|
笔者说明 |
1. 从可阅读性看,CDE发布的变更指导原则的变更类型和文件要求更为清晰明了,而EDQM的指南则对每种变更设定了很多前提条件。同属于AN的变更,所要求的资料也按照实际变更进行了具体化的说明。在做CDE变更时,关于“对变更后的工艺进行研究”,如果不知道需要研究什么时,也可以参考EDQM的资料要求。 2. 关于CDE变更指导原则里的设备变更,EDQM全文是没有该变更事项,笔者也专门听了EDQM关于该指南的相关培训,EDQM解释是EDQM只要求申请人在初次递交时对设备有一个大概的描述(generic description),EDQM在审评时也不会非常仔细的去看这一块内容。如果后续设备发生了变化,需要申请人根据对产品质量的潜在影响自行进行变更分类。如干燥设备的变更,对于EDQM来说就会进行额外关注。而如何界定设备的设计和工作原理,建议参考FDA的相关指南Post-approval Changes to Drug Substances Guidance for Industry 和SUPAC: Manufacturing Equipment Addendum -Guidance for Industry。 3. 关于杂质谱不变的定义,CDE在变更指导原则也做了详细的解释,EDQM变更时可以参考。 4. 关于EDQM里的“分析方法的轻微改变”,EDQM也举了例子,如,色谱柱长或柱温变更,而不是改变方法所用柱子类型。(可参考Ph.Eur 2.2.46) 5. CDE指导原则中最后一步反应仅限于形成共价键的化学反应,成盐等反应不包括在内。 |
||
|
变更分类 |
CDE |
变更分类 |
EDQM |
|
中等变更 |
1. 在批准工艺路线基础上延长工艺路线,将原起始原料作为中间体,其中延长的工艺路线与原起始原料一致。 2. 变更起始原料的合成路线,起始原料的质量不降低。 3. 变更最后一步反应之前的工艺步骤中的反应试剂、溶剂种类、生产条件等(重大变更(4)除外),但原料药杂质谱保持一致。如上述增加或变更的溶剂种类在变更前原料药合成工艺中已使用,可按照微小变更管理。 4. 将返工工艺作为固定的生产步骤纳入注册生产工艺导致的注册生产工艺变更。 5. 变更起始原料、中间体的质量标准(微小变更(2)除外),变更后起始原料、中间体的质量控制水平不得降低。 6. 变更最后一步反应及之后工艺步骤中使用的生产设备,材质、设计和工作原理发生变化,原料药杂质谱或关键理化性质(如粒度、晶型等)不变。 7. 无菌原料药的以下情形: ①变更除菌过滤过程的滤过参数(包括流速、压力、时间、或体积,但孔径不变),且超出原批准范围的。 ②除菌工艺过滤器从单一过滤器改为两个无菌级过滤器串联。 |
IN |
1. 非无菌原料药变更起始原料生产商(笔者注:这里变更指增加或替换)并且与已批准生产商不属于同一集团。新生产商起始物料质量标准,及变更后的原料药质量标准保持不变。 |
|
研究工作 |
|
研究工作 |
|
|
笔者说明 |
1. 关于CDE变更指导原则中的起始原料、中间体质量不降低,CDE在开展法规培训时也强调了“是实际质量不得降低,而不是只要符合原先的质量标准即可”。这主要针对一些较早批准的原料药,由于当时的法规环境,并没有对起始原料或中间体的杂质进行控制,固没有纳入质量标准中,针对此类情况,建议申请人根据合成路线,重新评估起始原料或中间体的潜在杂质(有机杂质,元素杂质,残留溶剂,致突变杂质),并通过实际检测几批变更前的起始原料或中间体,了解杂质上限水平,确保变更后的起始原料或中间体的杂质不高于该上限。 2. 关于粒度和晶型是否为原料药的关键理化性质可以参考ICHQ6(A)。 |
||
|
变更分类 |
CDE |
变更分类 |
EDQM |
|
重大变更 |
1. 变更原料药合成路线(中等变更(1)除外)。 2. 变更起始原料的合成路线,起始原料的质量发生变化。 3. 变更最后一步反应及之后的生产工艺(如变更结晶溶剂种类等)。 4. 变更可能影响原料药关键质量属性的工艺参数。 5. 在注册生产工艺中增加重新加工工艺。 6. 放宽或删除已批准的起始原料、中间体质量控制和生产过程控制,可能导致原料药的杂质谱、关键理化性质发生变化的。 7. 变更原料药生产工艺中的设备,可能导致原料药杂质谱或关键理化性质发生变化。 8. 无菌原料药生产过程变更可能影响无菌保证水平的以下情形: ①变更原料药的灭菌/无菌工艺,例如从除菌过滤、干热灭菌、辐射灭菌中的一种工艺变更为另一种工艺。 ②变更无菌生产工艺中使用的除菌过滤器孔径。 9. 其他可能导致原料药杂质谱和关键理化性质与变更前不一致的变更。
|
MIN |
1. 非无菌原料药变更起始原料生产商并且与已批准生产商不属于同一集团。新生产商起始物料质量标准保持不变。 2. 变更起始原料生产商,且生产商使用了不同的生产路线或生产条件,会对起始物料的质量标准产生影响,但不影响最终原料药质量标准。 3. 对中间体或成品生产工艺的任何其它轻微变更,例如,引入回收步骤、在不是最终精制的合成步骤增加一种在已批准工艺其它步骤中已使用的溶剂 、工艺变更得到新的成品级别如微粉化。成品生产工艺无变更、成品质量标准保持相同。 4. 起始原料/中间体/试剂中致突变性杂质限度依据 ICH M7指南原则进行变更。 |
|
MAJ |
5. 变更起始原料生产商,且生产商使用了不同的生产路线或生产条件,会对最终原料药的质量标准产生影响。 6. 采用可能会严重改变成品杂质谱的生产工艺取代现有工艺,包括引入“一锅煮工艺”进行多个化学转变而不将中间体分离出来),或引入新技术(例如“流体化学”或“连续生产工艺技术”)。 (笔者注:在EDQM的培训资料里还列举了一个属于MAJ的变更情形需要值得关注:在倒数第二步或之前引入一个新的二类溶剂,并且该溶剂在最终原料药中的残留不超多其限度的10%,若超过10%,则需要按sister file单独申报) 7. 中间体或成品灭菌步骤生产工艺变更,包括无菌产品批量变更。 8. 增加属于关键参数的中控检测和限度。 9. 放宽可能会对成品的质量造成显著影响的生产中控检测限度或起始原料/中间体/试剂的质量标准项目。 10. 删除可能会对成品的质量造成显著影响的生产中控检测限度。 |
||
|
研究工作 |
性考察,申请时提供不少于3个月的稳定性研究资料,并与变更前产品的稳定性情况进行比较,变更后样品的稳定性应不低于变更前。 |
研究工作 |
1. 所有已批准的和拟变更起始原料生产商清单对比(包括名称与完整地址);用已批准的和新生产商的起始原料各生产至少两批(最小为中试批量)原料药成品的批分析数据(采用对比表格)。 2. 所有已批准的和拟变更起始原料生产商清单对比(包括名称与完整地址);用已批准的和新生产商的起始原料各生产至少两批(最小为中试批量)原料药成品的批分析数据(采用对比表格)。 (笔者注:资料没有要求提交新的合成路线,笔者认为这个是需要提交的。) 3. 根据已批准的和拟变更的工艺各生产的至少 2 批(最小为中试批量)成品的批分析数据(采用对比表格);已批准和拟变更的工艺的直接对比。 4. 已批准的和拟变更的中控检测或起始物料/中间体/试剂限度的对比表格;相关时,新的非药典分析方法的详细描述和验证数据;CEP持有人提供论证或风险评估以证明可根据ICH M7 原则和限度删除或放宽参数;2 个生产批次成品的完整批分析数据。 5. 不做具体要求,申请人需要对该变更对最终原料药潜在的质量影响进行充分讨论。适用时,提交在“上市许可变更申报中稳定性试验指南”现行版本中适用的支持性稳定性数据。(EMA/CHMP/CVMP/QWP/441071/2011) 6. 同5 7. 同5 8. 已批准的和新的中控检测项目/限度的对比表格;相关时,新的非药典分析方法的详细描述和验证数据。 9. 不做具体要求,申请人需要对该变更对最终原料药潜在的质量影响进行充分讨论。 10. 同9 |
|
笔者说明 |
1. 关于重大变更的界定,不是根据企业说自己进行了充分评估,并检测了连续三批原料药后发现变更对最终原料药质量没有负面影响,所以不属于重大变更。要注意所有指南里都是写的根据该变更对产品质量影响的可能性来界定变更分类,如果可能性是重大的,则归于重大变更。 |
||
|
变更分类 |
CDE |
变更分类 |
EDQM |
|
微小变更 |
原料药的生产批量变更在原批准批量的10倍以内(包括10倍)。 |
AN |
1. 非无菌原料药成品或中间体批量最多增加至原批准批量的10倍。并且原批准批量必须是通过非通知类型的变更批准的。 2. 非无菌原料药成品或中间体批量减少至不低于1/10 。 以上两个变更均需保证生产方法变更仅因为批量增加/降低而产生,变更对工艺重复性无负面影响,变更原因不是生产过程中意外事件,或稳定性原因, 成品/中间体质量标准保持相同。 |
|
研究资料 |
|
研究资料 |
1. 拟变更批量的已检测批次的批号;批准的和拟变更的批量;按拟变更批量进行生产的工艺描述。 |
|
笔者说明 |
关于批量的变更,CDE和EDQM的核心思路是一样的。CDE在对变更指导原则进行培训时也强调,如果企业想扩大批量至原来的20倍,不可以通过先通过微小变更(年报)变为4倍,然后继续通过年报在4倍基础上扩大5倍。每次批量的变更需要跟CDE第一次批准的批量进行比较。并且要关注因为批量变更触发的关联变更,如设备、工艺参数等,进行关联变更申报。 |
||
生产批量
|
变更分类 |
CDE |
变更分类 |
EDQM |
|
中等变更 |
原料药的生产批量变更在原批准批量的10倍以上。 |
MIN |
批量增加超过原批准批量的10倍。 |
|
研究资料 |
|
研究资料 |
批准的和拟变更的批量;按拟变更批量进行更新的完整工艺描述;至少各一批变更前批量和变更后批量的批分析数据(以表格对比的格式) |
|
笔者说明 |
对于批量10倍以上的变更,往往伴随着设备,工艺参数的变更,也可能会影响原料药杂质谱和物理特性,需要重点关注。 |
||
原料药质量标准
对于药典(中国药典或欧洲药典)升级触发的质量标准变更,均不在这两个指导原则范围内。
|
变更分类 |
CDE |
变更分类 |
EDQM |
|
微小变更 |
无 |
AN |
删除成品的不重要质量标准项目(例如删除过时的参数)。 变更不是因为生产过程中的意外事件引起,例如,新的未知杂质、总杂质限度变化。 |
|
研究资料 |
无 |
研究资料 |
|
|
笔者说明 |
从EDQM的资料要求可见,即使删除某些质量标准项目,也要充分做好评估并提交评估资料,例如删除臭味检测。 |
||
|
变更分类 |
CDE |
变更分类 |
EDQM |
|
中等变更 |
1. 新增检验项目 新增检验项目应可以更有效地控制产品质量,新增检测项目的方法学验证和拟定的控制限度,均应符合相关指导原则的要求。该变更不包括因安全性或质量可控性原因导致的增加检验项目。另外,因生产工艺改变导致药学方面特性发生变化,而在标准中增加检验项目也不属于此类变更范畴。例如,原料药改用微粉化处理后,在标准中增加粒度分布检查。 2. 在原标准规定范围内收紧限度 这类变更是指在原标准规定范围内收紧控制限度。例如,原料药或制剂经过多批次生产验证,水分、有关物质等指标可以达到更优的控制水平,进而收紧控制限度。由于药品的生产工艺、处方等方面的重大变更而引起限度范围缩小不属于此类变更范畴。例如,原料药生产工艺中增加微粉化处理而引起粒度变小的变更。 3. 注册标准中文字描述的变更 此类变更不应涉及检验方法、限度等的变更。 |
IN |
1. 增加成品质量标准项目 变更不是因为生产过程中的意外事件引起,例如,新的未知杂质、总杂质限度变化。所有变更与诱变性杂质或元素杂质无关。所有新杂质的控制应与欧洲药典一致。拟增加的质量标准项目与关键参数无关。 2. 收紧成品质量标准限度 变更不是因为生产过程中的意外事件引起,例如,新的未知杂质、总杂质限度变化。检测方法保持相同,或对检测方法的变更轻微。 3. 对成品检验方法的微小变更。对 CEP 附录中检测方法的编辑性变更 根据相关指南进行了适当的验证研究,研究表明更新后的检测方法至少与之前的检测方法对等。总杂质限度无变更,未检出新的未界定杂质。分析方法保持相同(例如,对色谱柱长度或温度变更,但没有改变柱子型号或方法)。 |
|
研究资料 |
若涉及限度修订,需对一定批次样品(建议含近效期样品)批分析结果进行汇总,为限度修订提供依据,另外,需考察在原定的有效期内,药品是否符合修订后质量标准的要求。如涉及增加检验项目,需对检验方法进行方法学研究(包括方法的选择 、验证)提供限度拟定据。需对一定批次样品(建议含近效期样品)批分析结果进行汇总,以考察在原定的有效期内 ,药品是否符合修订后质量标准的要求。
|
研究资料 |
1. 已批准的和拟变更的质量标准对比表;所有新检测方法和验证数据的详细资料,如相关;两批成品的全检批分析数据。 2. 已批准的和拟变更的质量标准对比表。 3. 分析方法描述和修订后的质量标准;验证结果的对比,或对分析结果进行对比,论证所批准的方法与拟变更的方法至少等效;按 CEP 附录的格式更新的方法描述。 |
|
笔者说明 |
可以看出在界定质量标准变更的中等变更/IN时,CDE和EDQM都给了很多前提条件,需要申请人按照要求进行判定。另外,在CDE关于该变更指导原则的培训中,对于“新增检测项目”,CDE强调增加的项目只是起到“锦上添花”的作用时,才可以归属于中等变更。 |
||
|
变更分类 |
CDE |
变更分类 |
EDQM |
|
重大变更 |
1. 变更检验方法 2. 放宽控制限度 3. 删除注册标准中的任何项目 |
MIN |
1. 放宽已批准的成品质量标准限度,以与欧洲药典各论 /ICH/VICH 指南一致。 2. 根据ICH M7 指南的原则和限度改变成品质量标准中诱变性杂质限度。 3. 在原料药合成路线保持不变的情况下,引入或修改元素杂质(非编辑性修改)风险管理综述(RMS)。 4. 增加一个质量标准项目以使CEP证书包括新的级别(例如,微粉物料)。成品合成路线/生产工艺、检测程序和质量标准 (粒度除外)与已批准相同。 |
|
MAJ |
5. 删除成品质量标准中可能对成品质量有重大影响的项目。 6. 放宽已批准的成品质量标准限度。 |
||
|
研究资料 |
如涉及检验方法改变,需对新方法进行方法学研究验证并应与变更前方法进行比较,确保方法变更不引起药品质量控制水平的降低。另外,需对一定批次样品(建议含近效期样品) 批分析结果进行汇总,以考察在原定的有效期内,药品是否符合修订后质量标准的要求。 如涉及删除标准中任何内容,需结合药品生产过程控制、药品研发过程及药品性质等综合分析和证明该项变更不会引起药品质量控制水平的降低。如涉及放宽控制限度,需进行详实的研究,必要时需要有关安全性和/或有效性试验资料或文献资料的支持。限度变更还需基于一定批次样品的检测数据并符合相关的技术指导原则。
|
研究资料 |
1. 已批准的和拟变更的质量标准对比表;两批成品的全检批分析数据。 2. 已批准的和拟变更的质量标准对比表;两批成品的全检批分析数据;CEP持有人提供论证或风险评估以证明可根据ICH M7原则和限度删除或放宽参数。 3. 元素杂质风险管理讨论和综述。 4. 已批准的和拟变更的质量标准对比表;所有新检测方法和验证数据的详细资料,如相关;两批成品的全检批分析数据;如果涉及新场所,则要在当前申报资料中提交 所有已批准场所和所有本次拟增加的生产场所清单对比(名称和完整地址)。 5. 不做具体要求,申请人需要对该变更对最终原料药潜在的质量影响进行充分讨论。 6. 同上
|
变更包装材料和容器
CDE指导原则涉及的包装材料和容器主要指直接接触药品的包装即内包装而EDQM指南包括内包装和外包装。
|
变更分类 |
CDE |
变更分类 |
EDQM |
|
微小变更 |
1. 变更原料药装量,如每袋重量。 2. 指导原则中未规定的原料药包装材料和容器的材质和 /或类型的变更。变更后的包装材料和容器已在具有相同给药途径的已上市药品中使用,并且具有相同或更好适用性能。 3. 本指导原则中未规定的包装材料和容器的供应商、尺寸和/或形状的变更。 |
AN |
1. 内包材质量标准和/或限度的变更。 变更不是因为包装材料的生产过程中的意外事件导致,也不是国为原料药成品存贮期间的意外导致。检测方法保持相同,或对检测方法有轻微变更。 2. 外包材质量标准的变更。原料药成品的外包装成份保持不变 |
|
研究资料 |
|
研究资料 |
1. 当前的与拟变更的内包材质量标准的对比表格。 2. 当前的与拟变更的外包材质量标准的对比表格。
|
|
笔者说明 |
在CDE关于该变更指导原则的培训中,有提到对于原料药仅装量的变更,不需要提供新的稳定性研究。建议申请人可以在年报里简单说明下不需要提供稳定性的原因。 |
||
|
变更分类 |
CDE |
变更分类 |
EDQM |
|
中等变更 |
1. 无菌和/或液体原料药的包装材料和容器的材质和/或类型。
|
IN |
1. 非无菌原料药内包材成份变更(如果CEP中涉及复验期时)。 拟变更的包装材料在相关特性上必须至少与原批准的包装材料等效。在根据ICH 指南的条件进行相关的稳定性试验, 对至少两个中试批次或工业规模批次进行了相关的稳定性试验项目评估,在变更实施时至少已有三个月良好的稳定性数据。但如果拟变更的包装比已有包装阻隔能力更好,则不需要三个月稳定性数据。如果复验期结束时,稳定性数据超出或可能超出质量标准,则这些研究必须完成,数据(连同所拟措施)必须立即提供给 EDQM 。 2. 非无菌原料药内包材成份变更(如果CEP中未涉及复验期时)。 拟变更的包装材料在相关特性上必须至少与原批准的包装材料等效。 3. 原料药外包材成份变更 |
|
研究资料 |
|
研究资料 |
1. 当前的与拟变更的内包材质量标准的对比表格,如适用;新包装适当的数据,包括材料符合相关药典要求的确认,或欧盟对接触食品的塑料材料和物质的要求;CEP 持有人出具的根据 ICH 条件开始进行稳定性试验的申明(说明相关的批号),以及相关的在实施时对稳定性数据的最低要求,已有数据未能说明的问题。保证研究会完成,如果在批准的复验期结束时数据超出或可能超出质量标准,会将数据立即提交有关当局( 以及提议的措施 2. 当前的与拟变更的内包材质量标准的对比表格,如适用;新包装适当的数据,包括原料符合相关药典要求的确认,或欧盟对接触食品的塑料材料和物质的要求。 3. 已批准的和拟变更的外包装的对比表格。 |
|
笔者说明 |
对于EDQM,只有申请人需要在CEP上体现复验期时,才需要提供稳定性数据,否则不强制要求提供。 |
||
|
变更分类 |
CDE |
变更分类 |
EDQM |
|
重大变更 |
1. 变更为全新材料、全新结构、风险度提高的新用途的包装材料和容器。 2. 变更纳入登记管理的包装材料和容器(笔者注:主要指内包装),变更后的包装材料和容器尚未登记或登记状态为 I 。 |
MIN |
1. 液体(非无菌)成品中内包装的成分。 |
|
MAJ |
2. 无菌原料药内包装的成分。 |
||
|
研究资料 |
|
研究资料 |
1. 当前的与拟变更的内包材质量标准的对比表格,如适用;新包装适当的数据,包括原料符合相关药典要求的确认,或欧盟对接触食品的塑料材料和物质的要求; 适当时,必须提交证据证明内容物与包材之间不会发生相互反应(例如,所提议材料中没有成分会转移至内容物中,产品组分不会流失至包材中),包括确认材质符合相关的药典要求或欧盟与食品直接接触的塑料材质和物体法律要求;如果已批准有复验期,则应提交在ICH 条件下执行的 对至少2个中试批次或工业规模批次相关稳定性参数的稳定性研究结果 ,覆盖至少三个月,并且要保证将完成这些研究,如结果超标或可在所批准的复验期即将结束时可能会超标将立即向 EDQM 提交数据(连同所拟措施)。 2. 不做具体要求,申请人需要对该变更对最终原料药潜在的质量影响进行充分讨论。适用时,提交在“上市许可变更申报中稳定性试验指南”现行版本中适用的支持性稳定性数据。(EMA/CHMP/CVMP/QWP/441071/2011) |
变更有效期和贮藏条件
|
变更分类 |
CDE |
变更分类 |
EDQM |
|
中等变更 |
1. 延长有效期 有效期变更主要依据长期稳定性试验结果。延长有效期不应超过长期稳定性试验已完成的时间。 2. 缩短药品有效期 此类变更不包括因生产或稳定性出现问题而要求缩短有效期。 |
IN |
1. 删除或缩短已批准的复验期 该变更原因不是生产过程的意外事件,或稳定性原因。 2. 加严存贮条件 该变更原因不是生产过程的意外事件,或稳定性原因。 3. 变更已批准的稳定性试验方案
|
|
研究资料 |
|
研究资料 |
1. 删除或缩短复验期的理由陈述。 2. 加严存贮条件的理由陈述。 3. 申请的变更的理由陈述 以及更新后的稳定性方案。 |
|
变更分类 |
CDE |
变更分类 |
EDQM |
|
重大变更 |
1. 变更药品贮藏条件。 (笔者注:包括加严或放宽) 2. 由于药品的生产工艺、处方、质量标准、直接接触药品的包装材料和容器等方面的变更导致的有效期变更。 |
MIN |
1. 增加成品复验期和/或对成品存贮条件进行变更。 2. 延长成品复验期和/或对成品存贮条件进行变更。
|
|
研究资料 |
|
研究资料 |
1. 至少两个中试批次或工业规模批次长期和加速稳定性试验结果;包装材料的适当数据,包括确认包材符合相应的药典要求或欧盟关于与食品接触的塑料材料和物品的法规要求。 2. 至少两个中试批次或工业规模批次稳定性试验数据的更新。 |
变更生产场地
对于国内注册,场地变更本身没有变更分类,生产场地变更需要按照《药品生产监督管理办法》、《药品上市后变更管理办法(试行)》及所在地省局出台的生产场地变更管理实施细则等相关规定执行。生产场地变更的研究验证工作需参考下述内容。而因场地变更触发的其他变更,如设备变更,工艺变更,若属于重大变更,需在省局完成生产地址变更以后(更新生产许可证),再向CDE进行补充申请。
|
变更分类 |
CDE |
变更分类 |
EDQM |
|
无 |
生产场地变更,包括生产地址的改变或新增,或同一生产地址内的生产场地的新建、改建、扩建。 变更生产场地,由于新生产场地生产设备、生产环境(温度和湿度)、技术人员素质等与原生产场地情况很难完全一致,会对原料药、制剂生产和质量产生一定的影响,一般需要进行比较全面的研究工作。已在同一生产地址工作一段时间,且对生产工艺具备足够经验的人员通常可理解为 具有相同的人员素质 。 总体上,新旧场地处方、生产工艺、批量等应保持一致,包括原辅料、溶剂、 包装材料和容器、 生产的质量过程控制等。如变更场地的同时,其处方、生产工艺、批量等发生变更,则需按照本指导原则相关章节要求进行关联变更研究。
|
IN |
1. 非无菌原料药变更中间体生产商,并且拟变更的生产商与目前已批准的生产商归属同一集团。 中间体的质量标准和合成路线(包括中控、所有使用原料的分析方法)均与已批准的一致。 2. 非无菌原料药变更最终原料药生产商(生产场所/车间)并且拟变更的生产商与当前已批准生产商归属同一集团。 质量标准(包括中控、所有物料的分析方法)、制备方法(包括批量)和详细的合成路线与已批准的一致。 3. 非无菌原料药增加或替代最终物质的 QC 检测场所。 从当前场所向新场所的分析方法转移已成功完成。 4. 非无菌原料药引入新的(增加的)微粉场所。 CEP 中已批准一个微粉场所。质量标准(包括中控、所有物料的分析方法)、制备方法(包括批量)和详细的合成路线与已批准的一致。最终物质的粒径质量标准与相应的分析方法保持不变,并已包括在CEP 中。 |
|
研究资料 |
1、在同一生产地址内变更非无菌原料药或无菌原料药的非无菌生产步骤的生产场地,同时变更前后的生产设备、操作规程、环境条件(比如温度和湿度)、质量控制过程和人员素质等方面一致。
2、同一生产地址内变更无菌原料药无菌生产步骤的生产场地,或者原料药的生产地址变更至另一不同生产地址。 研究验证工作包括:
|
研究资料 |
1. 所有当前已批准的生产商和拟变更生产商对比清单(包括有名称和完整地址);来自已经批准和拟变更 中间体生产商生产的最终原料药批分析数据(以对比表格形式)。最终原料药至少各2批。(最小需要中试规模) 2. 所有当前已批准的生产商和拟变更生产商对比清单(包括有名称和完整地址);来自已经批准和拟变更生产商 生产的最终原料药批分析数据(以对比表格形式)。最终原料药至少各两批。(最小需要中试规模) 3. 所有当前已批准的QC检验场所和拟变更的QC检验场所对比清单。(包括有名称和完整地址) 4. 所有当前已批准的微粉场所和拟变更的微粉场所对比清单(包括有名称和完整地址);来自已经批准和拟变更微粉场所生产的最终原料药批分析数据(以对比表格形式)。最终原料药至少各两批。(最小需要中试规模)
|
|
变更分类 |
CDE |
变更分类 |
EDQM |
|
无 |
无 |
MIN |
1. 非无菌原料药变更中间体生产商,并且拟变更的生产商与目前已批准的生产商不属于同一集团。 中间体的质量标准和合成路线(包括中控、所有使用原料的分析方法)均与已批准的一致。 2. 增加或取代最终物质灭菌场所,且采用欧洲药典所列灭菌标准方法。 质量标准(包括中控、所有物料的分析方法)、制备方法(包括批量)和详细的合成路线与已批准的一致。所拟替代的灭菌场所需与已批准最终原料药生产商为同一集团,并且亦从事最终原料药的生产(包括灭菌前合成步骤)。如果不符合此条件,不能接受所提议新场所 。 |
|
MAJ |
3. 原料药变更中间体生产商,且拟变更的中间体生产商使用了显著不同的合成路线或生产条件,可能会改变最终原料药的质量标准(杂质谱)(例如,改变合成方法、合成中引入了新的试剂、溶剂、物料)。 此时新的生产商将取代原来的生产商,不允许一个CEP里有两种不一样的中间体合成路线,即使最终原料药的杂质谱保持一致。 |
||
|
研究资料 |
1. 所有当前已批准的生产商和拟变更生产商对比清单(包括有名称和完整地址);来自已经批准和拟变更中间体生产商生产的最终原料药批分析数据(以对比表格形式)。最终原料药至少各两批。(最小需要中试规模) 2. 所有当前已批准的灭菌场所和拟变更灭菌场所对比清(包括有名称和完整地址);来自已经批准和拟变更灭菌场所生产的最终原料药批分析数据(以对比表格形式)。最终原料药至少各两批。(最小需要中试规模) 3. 不做具体要求,申请人需要对该变更对最终原料药潜在的质量影响进行充分讨论。适用时,提交在“上市许可变更申报中稳定性试验指南”现行版本中适用的支持性稳定性数据 (EMA/CHMP/CVMP/QWP/441071/2011)。 |
笔者注:虽然在CDE的变更研究资料里不管微小、中等还是重大变更,都提出了进行变更稳定性研究,但正如指导原则和CDE的培训里所说的,“在充分评估的基础上,可能不需要针对变更进行稳定性研究。”例如原料药的装量变化等。
以上为化学原料药在中国和EDQM进行药学变更的对比。通过对比可以看出,EDQM变更的情形更为具体,在判断变更大小时,要仔细看好前提条件。并且EDQM有一个变更默认制,即所有未列在变更清单里的情形,默认归属为微小变更(MIN)。原料药发生变更时,若在CDE的指导原则中没有找到对应的归属,可以翻阅下EDQM的指南中是否有合适的归属,反之亦然。笔者根据两个药监机构对变更事项的划分,递交时间及变更的审评要求,大致认为国内的微小变更类似于EDQM的AN,中等变更类似于IN,重大变更对应于EDQM的MAJ。而落单的MIN更接近于重大变更。

来源:注册圈


