您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-08 11:19
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
石药rt-PA类溶栓药III期临床积极。石药集团附属公司石药明复乐自主研发的注射用重组人TNK组织型纤溶酶原激活剂(铭复乐,rhTNK-tPA),在用于治疗急性缺血性卒中的III期临床(TRACE II)达到主要研究终点。铭复乐与阿替普酶相比,在主要终点(90天mRS评分0-1分的受试者比例)疗效方面达到非劣性。石药集团目前已向NMPA递交上市许可申请前会议申请。
国内药讯
1.索元FIC抑郁症新药上国际Ⅱb期临床。索元生物潜在“first-in-class”抗抑郁症新药DB104(liafensine)的国际Ⅱb期临床首例患者在美国完成入组。该研究将在中美同步开展,并在生物标志物DGM4指导下,评估用于治疗难治性抑郁症(TRD)患者的有效性和安全性。Liafensine最初由百时美施贵宝与AMRI公司开发,可特异性地抑制在抑郁症中起重要作用的5-羟色胺、去甲肾上腺素和多巴胺的再摄取。
2.迪哲舒沃替尼早期临床积极。迪哲医药EGFR-TKI创新药舒沃替尼在WCLC2022上公布用于治疗既往接受含铂化疗失败的EGFR 20号外显子插入突变型(EGFR exon20ins)晚期非小细胞肺癌的三项I/II期临床(WU-KONG1、WU-KONG2和WU-KONG6)的汇总分析结果。数据显示,舒沃替尼的客观缓解率(ORR)高达52.4%,在脑转移患者中ORR为44%。药物的安全性良好,常见不良反应类型与传统EGFR TKI类似。
3.信立泰口服GLP-1R激动剂获批临床。信立泰1类新药SAL0112片获国家药监局临床试验默示许可,拟用于2型糖尿病(T2DM)患者的血糖控制。SAL0112是一款胰高血糖素样肽-1受体(GLP-1R)的口服小分子偏向激动剂,可与胰岛细胞上的受体结合并刺激胰岛素的分泌,从而发挥降血糖的作用。目前,国内已上市的用于2型糖尿病的GLP-1R激动剂共有8款,均是注射剂。
4.第一三共B7-H3-ADC在华获批临床。第一三共ADC新药DS-7300a获国家药监局临床试验默示许可,拟开发用于治疗既往接受过一线或以上治疗的广泛期小细胞肺癌。DS-7300a(DS-7300)是一款靶向B7-H3的抗体偶联药物(ADC),目前正在海外开展Ⅱ期临床试验。公布在ESMO大会上用于治疗晚期/不可切除或转移性实体瘤的Ⅰ/Ⅱ期临床数据显示,DS-7300在70例患者中达到10例确认部分缓解和5例待确认的部分缓解。
5.百济神州2022H1业绩公布。8月4日,百济神州公布2022年上半年业绩报告,公司实现营收6.482亿美元,研发投入为7.681亿美元。值得一提的是,百济神州2022年上半年产品收入达5.661亿美元,较上一年同期增长131.3%;其中,百悦泽®(泽布替尼)在上半年实现全球销售额2.331亿美元,同比大增261.3%;百泽安®(替雷利珠单抗)在国内市场销售额达到1.925亿美元,同比增长55.6%。
国际药讯
1.FDA批准首个HER2低表达乳腺癌靶向药。阿斯利康与第一三共开发的HER2-ADC新药Enhertu (T-DXd,DS-8201)获FDA批准新适应症,用于治疗无法切除或转移性HER2低表达(HER2-low)乳腺癌患者。在III期DESTINY-Breast04试验中,Enhertu与化疗相比,使这类患者的疾病进展或死亡风险显降低49%(HR=0.51,p<0.001);Enhertu组中位PFS为10.1个月(vs5.4个月),中位OS为23.4个月(vs16.8个月)。药物的安全性与之前研究一致。
2.奥拉帕利获欧盟批准治疗早期乳腺癌。阿斯利康与默沙东联合开发的PARP抑制剂奥拉帕利(Lynparza)获欧盟委员会批准,用于BRCA突变/HER2-的高风险早期乳腺癌的辅助治疗。在一项Ⅲ期试验OlympiA中,奥拉帕利将患者疾病复发、出现新肿瘤或死亡的风险降低42%(HR=0.58,99.5%CI:0.41-0.82,p<0.0001),并将死亡风险降低32%(HR=0.68,98.5% CI:0.47-0.97,p=0.009)。
3.广谱抗真菌药Ⅲ期临床积极。SCYNEXIS公司具有独特结构的葡聚糖合成酶抑制剂口服药物ibrexafungerp,在用于避免复发性外阴阴道假丝酵母菌病(RVVC)的Ⅲ期临床(CANDLE)达到主要终点与关键次要终点。ibrexafungerp治疗组患者24周时实现成功临床治疗的患者比例为65.4%,显著优于安慰剂组,而且有70.8%的患者不具真菌学证实的复发。FDA已受理该新药用于上述适应症的sNDA申请,并授予其优先审评资格。
4.礼来AD抗体疗法获优先审评。礼来日前透露其阿尔茨海默病(AD)候选药物donanemab的生物制品许可(BLA)申请已获FDA授予的优先审评资格。Donanemab是一款Aβ单抗,它能够与AD大脑中淀粉样蛋白沉积中的β淀粉样蛋白结合,从而促进患者大脑中淀粉样蛋白沉积的清除。在Ⅱ期临床TRAILBLAZER-ALZ中,donanemab较安慰剂使早期AD患者的临床进展速度延缓32%。该疗法已在中国获批临床。
5.安进40亿美元购进FIC补体C5a受体抑制剂。安进宣布拟斥资约37亿美元收购ChemoCentryx公司,并获得该公司一款“first-in-class”药物Tavneos(avacopan),以及3个早期候选药物(包括靶向其他炎症性疾病中的趋化因子受体的早期候选药物和一种潜在抗癌的口服检查点抑制剂)。Tavneos是FDA批准的首款口服补体C5a受体抑制剂,已获批与标准疗法联用,辅助治疗两种主要的抗中性粒细胞胞浆自身抗体相关血管炎:显微镜下多血管炎(MPA)和肉芽肿伴多血管炎(GPA)。
6.FDA再次拒绝帕金森症躁狂药物新增ADP适应症。Acadiaia公司帕金森症躁狂药物Nuplazid (pimavanserin) 拟新增用于治疗与阿尔茨海默症精神病(ADP)相关幻觉和妄想的补充新药上市申请(sNDA)再次收到FDA的完整回复函(CRL)。FDA认为当前基于Study 019和Study 045试验的数据不足以支持pimavanserin获批,并建议Acadiaia增加针对ADP的额外试验。Nuplazid是一种选择性5-羟色胺反向激动剂和拮抗剂,是首个获批用于帕金森病精神病(PDP)相关的幻觉和妄想的治疗药物。
医药热点
1.中国首个智慧家庭病房在穗启动。中国首个智慧家庭病房日前在广东省第二人民医院启动。智慧家庭病房将基于华为鸿蒙系统生态,应用物联网技术、5G/WIFI6等新技术,将智能穿戴设备、智能家居、健康监测设备等部署到家,并采用可视化的门铃、一键升降的洗手台等防碰撞、防摔倒、无障碍的适老化室内设计,实现医疗机构专业服务向家庭连续延伸。在家中监测到的使用者体征数据,会同步上传到医院里的“虚拟病房”(即医院端的远程管理中心)。医护人员在“虚拟病房”,可随时查阅相关数据,对使用者状况进行远程管理。
2.安徽省发布互联网诊疗监管征求意见。日前,安徽省发布《安徽省互联网诊疗监管细则实施办法(试行)(征求意见稿)》。根据该《意见稿》,互联网诊疗病历记录保存时间不得少于15年,音频资料等保存时间不得少于3年,互联网诊疗需全程留痕、可追溯,并向省级监管平台开放数据接口。《意见稿》还要求,医师开展互联网诊疗活动,应当依法取得相应执业资质,应具有3年以上独立临床工作经验,并经其执业注册的医疗机构同意。
3.湖北加强妇幼领域中医药服务。湖北省印发《“十四五”湖北省推进妇幼健康领域中医药工作实施方案》,要求妇幼健康领域全面开展中医药服务,三级、二级妇幼保健机构开展中医药专科服务比例分别达到90%和70%以上。《方案》还明确,要加强妇幼健康领域中医药人才队伍建设,力争到“十四五”末,培养妇幼健康领域“湖北省中医大师”1~2人、“湖北省中医名师”3~5人、“湖北省中医药中青年骨干人才”20~30人,并建设一批妇幼健康领域中医药传承工作室。
4.辽宁明确核酸检测机构准入要求。近日,辽宁省卫健委新出台的《辽宁省新冠病毒核酸检测机构管理办法(试行)》明确了核酸检测机构、人员的准入以及核酸检测机构的退出要求。《办法》提出,医疗卫生机构拟设置临床基因扩增检验实验室(核酸检测实验室),开展新冠病毒核酸检测项目的,应当具备二级以上生物安全实验室条件,在市级卫生健康行政部门完成实验室生物安全备案后,向辽宁省卫健委指定的专业机构申请技术审核。
评审动态
1. CDE新药受理情况(08月07日)
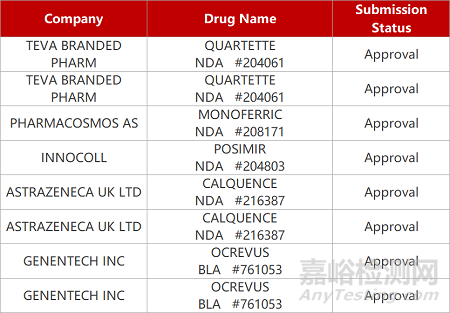
2. FDA新药获批情况(北美08月05日)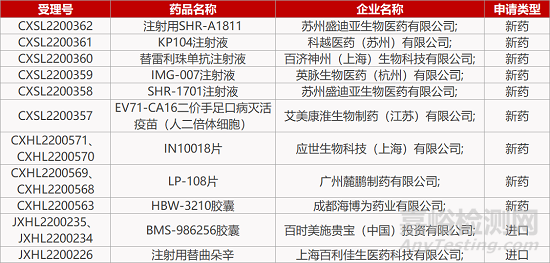

来源:药研发


