您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2022-08-03 21:45
吸入制剂是一种通过肺部给药的特殊剂型,通过局部给药的方式可以快速、直接地进入肺部发挥药效,降低了给药剂量,提高了药物疗效。
呼吸系统疾病作为我国第二大疾病,意味着吸入制剂有巨大的市场空间。随着越来越多的企业涉足吸入制剂的研发,吸入制剂有望成为下一个投资热点。
吸入制剂行业技术壁垒:国内市场长期被国外企业垄断的主要原因就是因为吸入制剂有极高的技术壁垒,主要涉及三个方面,研发壁垒+审批壁垒+生产壁垒
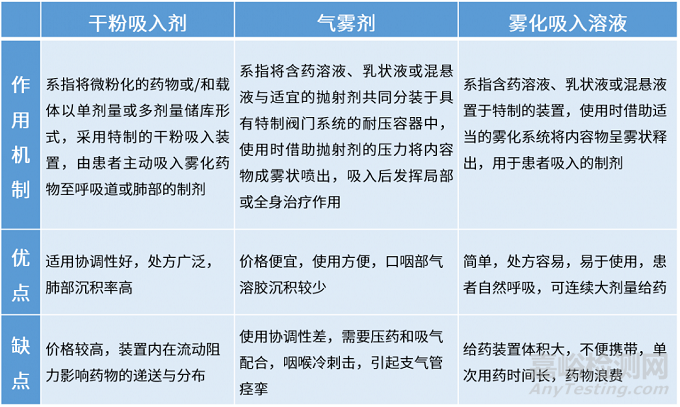
吸入制剂根据其装置的区别可分为干粉吸入剂(DPI)、气雾剂(MDI)、雾化吸入溶液(NEB)以及喷雾剂,其中喷雾剂以鼻喷剂为主,市场占比较小
与传统剂型不同,大多数经口吸入制剂被设计为局部作用于肺部,主要有雾化吸入剂(nebulizer,也称喷雾剂)、压力定量吸入剂(pMDI,也称气雾剂) 和干粉吸入剂(DPI,也称吸入粉雾剂) ,针对其作用机制及优缺点见下表。
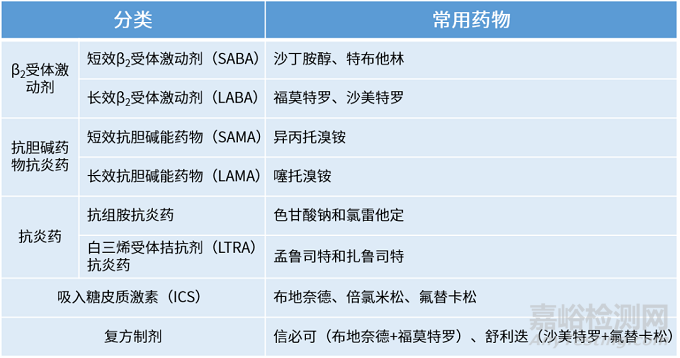
常见的慢病呼吸系统疾病所用吸入制剂类型药物包括短效β2 受体激动剂(SABA)、长效β2 受体激动剂(LABA) 、短效胆碱能拮抗剂(SAMA) 、长效胆碱能拮抗剂(LAMA) 及吸入性糖皮质激素(ICS) 等,常见药物如下表。
Part1吸入制剂的技术壁垒
吸入制剂的技术壁垒高,因此无论在成熟的海外市场还是在国内市场,布局的企业及已上市的药品均相对较少。技术壁垒主要包括了开发和审批方面的壁垒。
1研发壁垒
吸入制剂是药物学、吸入动力学、颗粒动力学、流体力学、表面科学和吸入器设计加工等多种技术的结合,研发难度极大。药物在肺部的沉积率是影响药物疗效的关键因素。肺部沉积率又受到药物粒子的性质(粒径、粒径分 布、药物分散状态)、载体、设备、外界环境等方面的影响。对于多数吸入制剂,本身又是一种药械合一的特殊制剂,对药械的联动性要求很高,因此合适的吸入装置是研发的核心,药品与器械的组合方式需充分合理;另外从工艺处方方面考虑,原辅料的粒径、分散状态、与载体的比例和结合方式以及水分和环境湿度的控制等都是影响药物疗效的关键因素。此外对于定量吸入气雾剂(MDI),还必须要保证给药装置每一次释放的剂量都相对稳定。从另外一个成本角度来讲,生产过程所用的无菌设备以及生产检测的设备成本都较高,这也是制约多数仿制企业的因素之一。
2临床试验壁垒
吸入制剂临床BE试验较复杂主要在于患者操作可控性差,容易产生误差。吸入制剂在患者操作上要求较高,操作 不当容易出现含喷嘴过于紧密、未完全含住吸嘴、通过鼻子吸入、吸气过快、药物沉积于口腔等问题。而由于吸入制剂每次给药剂量小(微克级别),真正进入肺部的药物剂量更小,因此若患者在操作过程中出现误差,很容易对药效有较大的影响。
3审批壁垒
以FDA为例,FDA批准吸入制剂仿制药的要求是处方和装置与原研相似、全身试验等同、体外暴露PK等同和临床疗效相同四项同时满足才能确定生物等效性,药械合一联合申报。而在国内2019年 8月 2 日,我国CDE 发布了《经口吸入制剂仿制药药学和人体生物等效性研究指导原则(征 求意见稿)》。该指导原则提出了仿制药吸入制剂在人体生物学等效研究评价中,在体外药学质量一致的 前提下,一般需通过(1)药代动力学研究(PKBE 研究),和(2)药效动力学研究(PD-BE 研究)或临床终点研究评价人体生物等效性(仿药与原研的一致性);若仅通过PK-BE 研究评价人体生物等效性, 则需进一步证实本品药代动力学和局部递药等效性之间具有线性关系。对于吸入溶液剂,如证明与参比制 剂药学质量一致,通常不再要求进行人体生物等效性研究;对于吸入混悬剂、吸入气雾剂、吸入粉雾剂, 在与参比制剂药学质量一致的前提下,一般还应进行人体生物等效性研究。
对于吸入制剂而言,同时达到体外和体内一致性的难度很大:体外一致时体内不一定一致,处方量一样但药效表现出的结果可能不一样,比如可能晶型表面粗糙度不一样,影响了溶解度和药代动力学;体内一致时也有可能体外不一致,如改了处方量、剂量和原研不一样可能还能达到体内一致,而此时体外就不一致了。
2020年12月16日,国家药品监督管理局药品审评中心(CDE)正式发布《经口吸入制剂仿制药生物等效性研究指导原则》,针对经口吸入制剂特殊性,提出仿制药开发进行药学和人体生物等效性研究方法,包括把体外、体内结合研究作为评价依据等。
专利障碍:国外原研产品不仅在制剂和装置方面进行了核心的专利布局,还在辅料等方面进行了相关专利布局。例如葛兰素史克(GSK)在其核心产品舒利迭和辅舒酮中就设置了多重专利,在辅料选择应用以及给药装置的药物包、气雾剂容器的阀、带有剂量计数器的配器及其剂量指示装置、动作装置的动作指示器等核心产品构造上,都有详细的专利保护。
Part2全球呼吸系统主要吸入制剂
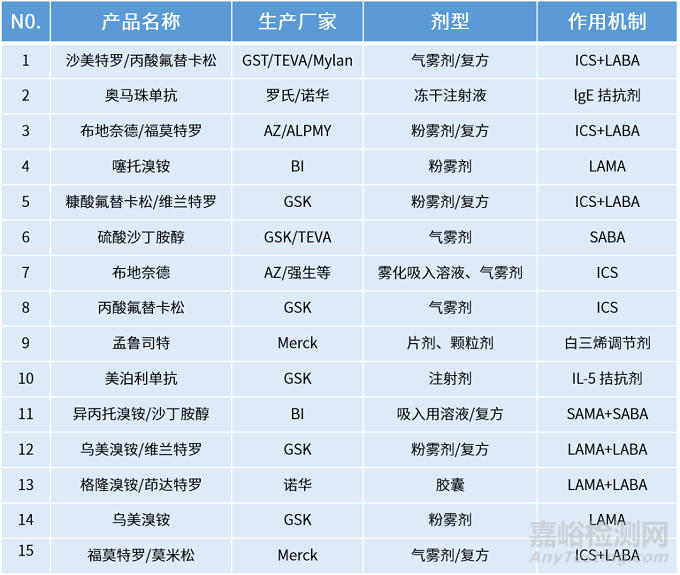
1美国的市场格局与规模
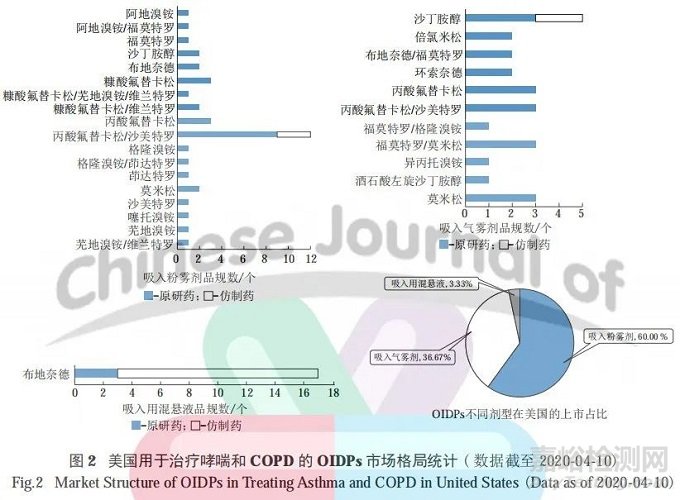
经查询 FDA Orange Book 数据库,可知美国市场在售的吸入粉雾剂、吸入气雾剂和吸入用混悬液共 30 个品种 ( 80 个品规 ),其中吸入粉雾剂共 18个品种 (37 个品规 )、吸入气雾剂共 11 个品种 (2个品规 )、吸入用混悬液共 1 个品种 ( 17 个品规 )。
从剂型角度进行统计分析可见,美国市场的 OIDPs 各类剂型分布存在差异,其中吸入粉雾剂品种数占比较高,约为总 OIDPs 品种数的 60% ;其次是吸入气雾剂,约占 36.67% ;吸入用混悬液占比最低,约占 3.33%。具体品种及数量分布情况见图 2。
2中国的市场格局与规模
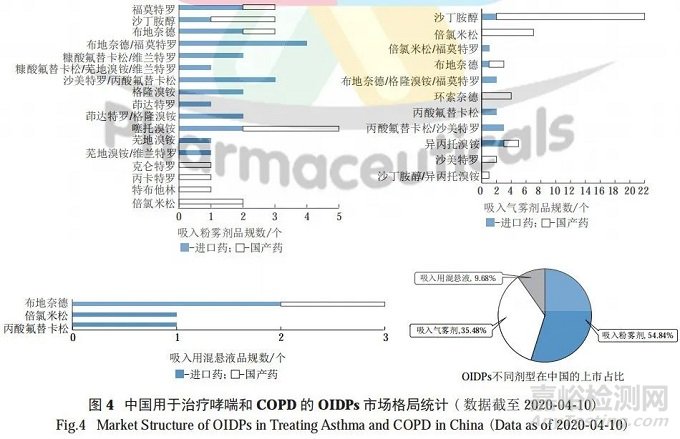
经查询 NMPA 国家药品监管数据共享平台数据库,国内市场的吸入粉雾剂、吸入气雾剂和吸入用混悬液共 31 个品种 (93 个品规 ),其中吸入粉雾剂共 17 个品种 ( 36 个品规 )、吸入气雾剂共 11 个品种 (52 个品规 )、吸入用混悬液共 3 个品种 (5 个品规 )。
从剂型角度进行统计分析可见,国内市场的吸入粉雾剂品种数占比最高,约占总 OIDPs 品规数的 54.84% ;其次是吸入气雾剂,约占 35.48% ; 吸入用混悬液占比最低,约占9.68%。具体品种及数量分布情况见图 4。

来源:Internet


