您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-03 11:24
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
杭州剂泰改良型新药获批PBA临床。剂泰医药2.2类改良型新药MTS004口崩片日前获国家药监局批准,即将在国内开展用于假性延髓情绪(PBA)适应症的临床试验。PBA是一种继发于多种神经系统疾病或损伤的情绪表达障碍。通常表现为频繁、不自主、无法控制的与患者情绪状态不协调或不相称的大笑和/或大哭,俗称“强哭强笑综合征”。如果进展顺利,MTS004口崩片预计2023年初进入III期临床。
国内药讯
1.礼来胰高血糖素鼻喷剂报NDA。礼来高血糖素鼻用粉雾剂(胰高血糖素、Baqsimi)上市申请获CDE受理,推测适应症为治疗糖尿病患者严重低血糖。Baqsimi是首款获FDA批准的严重低血糖非注射型紧急疗法,于2019年7月获批用于4岁及以上年龄糖尿病患者严重低血糖。该新药装在一次性、即用型喷雾器中,可由护理人员通过鼻腔给药,用于治疗严重低血糖患者。
2.恒瑞乳腺癌新药III期临床积极。恒瑞医药HER1/HER2/HER4酪氨酸激酶抑制剂马来酸吡咯替尼片联合曲妥珠单抗和多西他赛一线治疗HER2阳性复发/转移性乳腺癌的III期临床(HR-BLTN-III-MBC-C研究)达到主要研究终点。与安慰剂联合曲妥珠单抗和多西他赛相比,马来酸吡咯替尼片联合曲妥珠单抗和多西他赛治疗显著延长患者的PFS。该公司计划近期向CDE递交上市前的沟通交流申请。
3.诺华长效降脂药国内启动新III期临床。诺华与Alnylam开发的PCSK9靶向siRNA药物Inclisiran注射液(KJX839)登记启动一项III期临床,在诊断为非阻塞性冠状动脉疾病且既往未发生心血管事件的受试者中评价KJX839对基于冠状动脉计算机断层扫描血管造影评估的动脉粥样硬化斑块进展的影响。主要研究者由首都医科大学附属北京安贞医院主任医师刘宇扬担任。Inclisiran是一种长效降脂药,已在欧美获批上市,仅需每年皮下注射给药两次即可降低LDL-C水平,达到降低血脂的效果。
4.礼新GPRC5D靶向ADC获批临床。礼新医药靶向GPRC5D的抗体偶联药物LM-305获FDA临床许可,拟开展I/II期临床研究,评估LM-305在多发性骨髓瘤患者中的安全性、耐受性、药代动力学和初步抗肿瘤活性。GPRC5D在多发性骨髓瘤(MM) 患者中特异性高表达,且表达水平与另一款对多发性骨髓瘤的靶点BCMA相对独立,GPRC5D有望成为治疗复发难治多发性骨髓瘤(RRMM)的下一个靶点。LM-305也是首个获批进入临床的GPRC5D-ADC药物。
5.远大医药2款抗肿瘤RDC报IND。远大医药宣布其放射性核素偶联药物(RDC)领域用于诊断前列腺癌的药物TLX591-CDx(注射用68Ga-PSMA-11)以及用于诊断透明细胞肾细胞癌(ccRCC)的药物TLX250-CDx(锆[89Zr]吉伦妥昔单抗注射液)的临床试验申请获得CDE受理。2020年11月,远大医药与Telix公司就RDC产品达成合作,获得后者多款用于肿瘤诊断、具备“first-in-class”潜力的创新型RDC产品(TLX591-CDx、TLX250-CDx和TLX599-CDx)在大中华区的商业化和生产的独家权益。
国际药讯
1.斑秃创新疗法第二项Ⅲ期临床积极。Concert公司口服JAK抑制剂CTP-543在治疗中重度斑秃的第二项Ⅲ期临床获积极结果。与安慰剂相比,CTP-543(8 mg或12 mg)治疗组24周后患者实现头皮毛发覆盖率≥80%的比例显著更高(33.0%和38.3%,vs0.8%);两组患者表示“满意”或“非常满意”的比例分别为47%和52%,安慰剂组这一数值为2%。此前,CTP-543已经在另一项Ⅲ期临床中达到主要终点。该公司计划明年上半年递交CTP-543的新药申请。
2.罗氏皮下注射PD-L1抑制剂Ⅲ期临床积极。罗氏PD-L1抗体Tecentriq(atezolizumab)皮下制剂用于治疗既往铂类治疗失败的局部晚期或转移性非小细胞肺癌(NSCLC)患者的Ⅲ期IMscin001研究达到共同主要终点。与需要30-60分钟的静脉(IV)输注相比,只需3-8分钟的皮下注射Tecentriq在血液中的水平(药代动力学)显示出非劣效性。此外,Tecentriq皮下制剂的安全性与静脉输注Tecentriq一致。详细结果将在医学会议上分享。
3.益普生斥16亿美元布局T细胞疗法。益普生与Marengo Therapeutics就后者两款临床前期选择性T细胞受体(TCR)激活剂达成合作许可协议。Marengo专有的STAR技术平台能够生成多特异性融合蛋白,它们不但能够靶向特定TCRVβ变体,而且通过与不同的共刺激受体结合,生成强力的T细胞激活剂。根据协议,Marengo将负责临床前开发活动,直至向FDA递交IND申请;益普生将负责临床开发和后续商业化活动;Marengo将获得4500万美元的前期付款,以及潜在总额达15.92亿美元的里程碑付款。
4.耳鸣新药II期临床失败。Otonomy公司终止拟用于治疗耳鸣的耳内局部注射制剂OTO-313(gacyclidine)的进一步开发。gacyclidine是一种N-甲基-D-天冬氨酸(NMDA)受体拮抗剂,可通过减少耳蜗及其连接处受损听觉神经纤维的过度活化,减轻耳蜗损伤后的耳鸣程度。在一项治疗耳鸣的II期临床中,OTO-313与安慰剂相比,主要终点和次要终点在所有的时间点均未显示出有临床意义的改善。虽然OTO-313在预期定义的耳鸣持续时间少于6个月的患者亚组中显示出比安慰剂更高的缓解率,但总体结果不支持其进一步开发。
5.美国控股实验室分拆其CRO业务。美国控股实验室(Labcorp)宣布将分拆其大部分CRO业务,成立两家独立的上市公司,预计将在明年下半年进行免税分拆。分拆后,Labcorp将保留包括其核心诊断测试业务、早期开发和中心实验室业务等部分业务,这部分业务去年创造了105亿美元的收入。新分拆出的临床开发业务在去年创造了30亿美元的净收入,未来该公司将通过提供各阶段的临床试验管理来寻求发展。
6.艾伯维2022H1业绩公布。7月29日,艾伯维公布2022年上半年业绩报告,上半年总收入281.21亿美元,同比增长4.3%。研发投入31.06亿美元,同比下降9.55%。2022年上半年,该公司自免业务收入133.48亿美元,同比增长12.5%,占到艾伯维总收入的47.5%。其中Humira(阿达木单抗)上半年收入达到100.99亿美元,同比增长1.7%,今年仍有望继续突破200亿美元。
医药热点
1.公立医院高质量发展评价指标出台。8月1日,国家卫健委、国家中医药管理局联合印发《公立医院高质量发展评价指标(试行)》《公立中医医院高质量发展评价指标(试行)》。两者围绕党建引领、能力提升、结构优化、创新增效、文化聚力5个方面,各细化为18个和24个具体的评价指标,供各地对辖区内公立医院高质量发展情况进行评价。
2.重庆分级管理医护人员执业信用。重庆市卫健委出台《重庆市医护人员执业信用管理办法(试行)》,将对医护人员执业信用实行分级评价,评价结果划分为5个等级。《办法》规定,医疗机构在法定权限范围内,可根据医护人员的信用评价结果,在人才项目评审、职称申报聘任、评先评优等日常监管工作中,按照相关法律法规规定,采取相应的奖惩措施。
3.印度首现猴痘死亡病例。据《印度快报》7月31日报道,印度喀拉拉邦1例确诊感染猴痘病毒的男子于7月30日在医院死亡,这是印度发现的首例猴痘死亡病例。根据印度喀拉拉邦卫生部长维纳·乔治介绍,这名男子年仅22岁,被送医时并没有出现猴痘症状。几天前,他刚从阿联酋返回印度,他在阿联酋期间就已确诊感染猴痘病毒,但他的家人于7月30日才交出检测报告。当地有关部门将就这起死亡事件展开调查。
评审动态
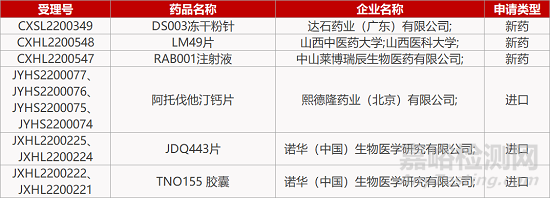
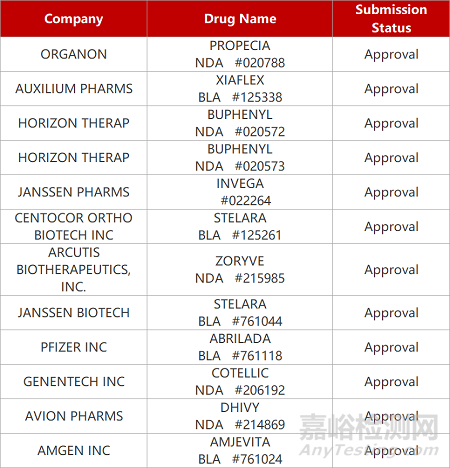

来源:药研发


