您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-15 11:26
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
信达降脂新药PCSK9抑制剂报产。信达生物1类新药托莱西单抗注射液(tafolecimab,IBI-306)的上市申请获CDE受理。IBI-306是一款靶向PCSK9的单克隆抗体,旨在通过减少PCSK9介导的低密度脂蛋白受体(LDLR)内吞来增加LDLR水平,继而增加LDL-C清除,降低LDL-C水平。信达生物拟开发该新药用于治疗非家族性高胆固醇血症及杂合子家族性高胆固醇血症等适应症。
国内药讯
1.全球首款NF1疗法在华申报上市。阿斯利康与默沙东开发的5.1类新药selumetinib胶囊(司美替尼)的上市申请获CDE受理。CDE同日还将该新药以“符合儿童生理特征的儿童用药品新品种、剂型和规格”为由纳入优先审评,拟用于治疗≥3岁、伴有症状、无法手术的丛状神经纤维瘤的1型神经纤维瘤病(NF1)儿科患者。Selumetinib是一款MEK1/MEK2选择性抑制剂,最早于2020年4月获FDA批准上市,是全球首款治疗NF1的创新疗法。
2.安济盛FIC新药获FDA罕见儿科疾病认定。安济盛生物自主研发的首创新药AGA2115获FDA授予罕见儿科疾病认定,用于治疗成骨不全症(OI)。这是一种严重危害生命的遗传性结缔组织疾病,因胶原代谢异常,导致骨骼畸形、骨脆性、骨量减少和各种非骨骼疾病如神经系统并发症等。临床前研究显示,AGA2115能通过显著的刺激成骨作用达到增加骨量、减少骨折发生并促进骨折愈合的效果,对OI具有潜在疗效。
3.君实四代EGFR抑制剂获批临床。君实生物1类新药WJ13404片(JS113)获国家药监局临床试验默示许可,拟用于晚期非小细胞肺癌的治疗。WJ13404是君实与微境生物合作开发的第四代EGFR抑制剂,临床前数据显示该药对第三代EGFR抑制剂不敏感的原发性和获得性EGFR突变(包括Del19/T790M/C797S和L858R/T790M/C797S共突变),以及部分TKI耐药的旁路激活靶点和免疫抑制性靶点均有很好的抑制活性,同时对野生型EGFR具有高度选择性。
4.沃森终止重组EV71疫苗研发。沃森生物发布公告,宣布终止其子公司上海泽润的重组肠道病毒71型病毒样颗粒疫苗(毕赤酵母)重组EV71疫苗的临床研究工作,并将集中优势资源全力推进双价HPV疫苗WHO PQ预认证、9价HPV疫苗临床研究、重组新冠疫苗海内外临床研究等。重组EV71疫苗主要用于预防因EV71病毒感染导致的手足口病。目前国内已有三家EV71灭活疫苗获批上市。
5.泽布替尼新适应症美国上市审评延期。百济神州发布公告,宣布FDA已将百悦泽(泽布替尼)用于治疗慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)的新适应症申请(sNDA)的PDUFA日期延长至2023年1月20日。FDA需要额外的时间来审查百济神州补充提交的Ⅲ期Alpine试验数据。经IRC评估的最终缓解结果显示,在复发/难治性CLL或SLL成人患者中,百悦泽具有优于伊布替尼的总缓解率。
6.复宏汉霖2款生物类似药海外授权。复宏汉霖宣布与Organon公司签署许可及供货协议,将公司自主开发的帕妥珠单抗生物类似药HLX11(重组抗HER2结构域II人源化单克隆抗体注射液)、地舒单抗生物类似药HLX14(重组抗RANKL全人单克隆抗体注射液)两款产品的全球(除中国以外)独家商业化权益授予Organon公司。根据协议,复宏汉霖将获得7000万美元预付款、1.03亿美元研发里程碑、3.65亿美元销售额里程碑金额,协议总金额高达5.38亿美元。
国际药讯
1.口服JAK抑制剂获批用于治疗斑秃。礼来与Incyte公司联合开发的口服JAK抑制剂巴瑞替尼(baricitinib,Olumiant)获FDA批准新适应症,用于治疗成人严重斑秃。这也是FDA批准用于斑秃的首款系统性疗法。在2项III期临床中,baricitinib(4 mg)治疗52周后,39%的患者头发再生显著,头皮毛发覆盖达到80%以上。此前该疗法已获批用于治疗类风湿性关节炎,和中重度特应性皮炎。
2.Alnylam又一款RNAi疗法获FDA批准。Alnylam公司开发的RNAi疗法Amvuttra(vutrisiran)获FDA批准上市,用于治疗遗传性转甲状腺素蛋白介导的淀粉样变性成人患者的多发性神经病。这是FDA批准的首款只需每3个月皮下注射一次,就能够逆转神经病损伤的RNAi疗法。在一项Ⅲ期临床HELIOS-A中,Amvuttra治疗组9个月后患者的mNIS+7评分(评估神经病障碍的评分)的改善较基线降低2.2点(vs增加14.8点,p<0.0001),有50%的患者较基线相比症状得到改善。
3.ALS口服复方获批上市。Amylyx公司口服固定剂量配方Albrioza(苯丁酸钠/牛磺酸)获加拿大监管机构批准有条件上市,用于治疗肌萎缩侧索硬化(ALS)。这也是该疗法首次获得监管机构的上市批准。一项Ⅱ期临床CENTAUR结果显示,Albrioza可使患者ALSFRS-R评分平均改善2.32点;并显著延长患者的中位生存期。目前,该公司已开展国际Ⅲ期临床PHOENIX,拟招募约600例ALS患者,预计将于2024年获得顶线结果。
4.Keytruda新适应症申请获FDA受理。FDA受理默沙东PD-1单抗Keytruda 的补充生物制品许可申请(sBLA),用于辅助治疗经完全手术移除的IB-IIIA期非小细胞肺癌(NSCLC)患者。在关键Ⅲ期临床KEYNOTE-091中,与安慰剂相比,无论肿瘤PD-L1的表达量如何,Keytruda均可增加患者的无病生存期(DFS)。该项试验将继续分析PD-L1阳性病患的DFS以及其他的次要终点。Keytruda的安全性与已在研究一致。
5.儿童脑瘤创新疗法关键Ⅱ期临床积极。Day One Biopharmaceuticals公司高脑渗透性、口服泛RAF激酶抑制剂tovorafenib,在治疗儿科低级别胶质瘤(pLGG)的关键Ⅱ期临床结果积极。在22例可评估患者中,tovorafenib达到64%的总缓解率ORR和91%的疾病控制率。所有疾病稳定的患者也出现肿瘤缩小,缩小幅度为19%到34%。携带BRAF融合或BRAF V600E突变的经治患者中均观察到缓解。该公司计划明年上半年递交监管申请。
6.FLT3抑制剂治疗AML达Ⅲ期临床终点。第一三共FLT3抑制剂quizartinib治疗FLT3-ITD突变、急性髓系白血病(AML)的Ⅲ期临床结果积极。与标准治疗相比,quizartinib联合标准诱导和巩固化疗治疗,然后继续接受quizartinib单药治疗患者的中位总生存期表现出显著改善(中位OS:31.9个月vs15.1个月);将死亡风险降低22.4%。目前该新药已获得FDA授予的突破性疗法认定和快速通道资格;并获批日本上市。
医药热点
1.北京对“天堂超市酒吧”立案调查。6月14日,据北京日报客户端消息,北京对全市娱乐场所大检查,对“天堂超市酒吧”立案调查。6月13日,北京市新冠疫情防控工作新闻发布会上介绍,6月9日0时至13日15时,涉天堂超市酒吧聚集性疫情累计报告228例感染者,其中,天堂超市酒吧(工体西路6号)到访人员180例,酒吧工作人员4例,到访人员的续发关联人员44例。228例感染者涉及14个区和经开区。
2.2022年国家医保目录调整征求意见。国家医保局日前公布《2022年国家基本医疗保险、工伤保险和生育保险药品目录调整工作方案》及相关文件公开征求意见。今年医保药品目录将“2022年6月30日前经批准上市的罕见病治疗药品”“2022年6月30日前经批准上市并纳入鼓励研发申报的儿童药品清单的药品”明确列入申报条件,充分体现对罕见病用药、儿童用药的关注。今年目录还首次提出非独家药品准入的规则,增加申报结果公示环节,完善专家评审流程。
3.核酸采样规范再加码。6月13日,国务院联防联控机制发布《关于进一步加强新冠病毒核酸采样质量管理工作的通知》,要求各地要严格核酸采样人员的资质管理,在现有医务人员基础上,将民营医院、零售药店、学校医务室以及企事业单位中具有卫生相关专业技术职业资格的人员纳入采样人员队伍,这些人员经规范培训并考核合格后方可采样,对采样人员的调配使用尽量不挤占正常医疗资源。
评审动态
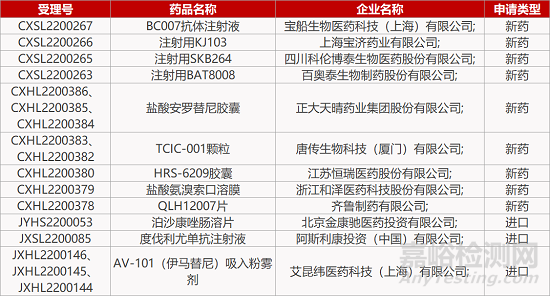
1. CDE新药受理情况(06月14日)

来源:药研发


