您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2022-05-29 21:48
摘要 目的:通过实际案例研究找寻ICH Q13指南背后的基本原理,促进连续制造技术在我国制药行业的应用。方法:以原料药碳酸钙生产为实例,分析其连续制造生产线中部分工序的连续生产设计与实现方式,并参照ICH Q13指南的要求,提出监管层面的考虑。结果与结论:类似于碳酸钙这种工艺简单的品种非常适合转化为先进的连续制造工艺,现有条件可实现部分工序连续生产,也非常有望实现真正的全过程连续制造,为药品连续制造在我国的顺利落地实施提供了实践参考。
1背景介绍
随着近几年过程分析技术(Process Analytical Technology,PAT)的发展,国内外制药行业的连续制造(Continuous Manufacturing,CM)的相关研究也取得了很大的进步。美国食品药品监督管理局(FDA)以及欧洲药品监督管理局(EMA)等相继批准了以连续制造工艺制造的相关药品[1]。但目前国内制药行业还是以传统的批次生产为主,连续制造工艺的发展还处在刚刚起步阶段。传统的间歇批次生产工艺一般是以固定批量进行的分步骤生产工艺,在一个工序完成之后再进入下一个工序。因此,当一个工序未完成或中间体检测未放行时,无法进入下一个制造工序,同时还存在上一个工序与下一个工序之间的短时高通量的物料转移。因此,传统的间歇批次制造工艺存在制造工艺时间长,设备占用体积大,批间产品质量波动大,制造规模放大困难等问题。连续制造涉及生产过程中物料的持续输入,物料的持续转化,以及输出物料的同步去除[2]。与间歇批次生产相比,连续生产的优势主要包括:生产周期短,效率高,设备体积小,占地面积小,物料消耗低,生产成本低。同时,整个药品生产过程中通过过程分析技术和先进工艺控制,产品质量一致性较高[3],保证了产品质量的均一性和批间一致性。
1.1 法规背景
早在2004年9月,FDA发布了PAT的框架性指导原则,用以支持制药行业在药品研发、生产制造以及药品质量控制上的有效且高效创新[4]。而PAT技术正是连续制造的核心控制技术,用以实现连续制造过程中的工艺监控及实时放行。2019年2月,FDA发布了关于连续制造工艺过程中质量考量的指导原则,进一步在工艺动态、批次定义、控制策略、质量体系、工艺放大、稳定性以及批次生产如何桥接至连续生产给出了相应的参考原则,进一步推动了连续制造在制药工业上的发展[5]。2021年7月,国际人用药品注册技术协调会(ICH)发布了药品原料及成品的连续制造指导原则草案Q13,进行了公开意见征询[2],其中正文部分就连续制造概念、实现的科学技术,监管考量等进行了系统指导,附录也分别对原料药、制剂成品及生物制品的连续制造进行了举例。ICH Q13连续制造指导草案的发布,更进一步推动了连续制造在应用层面的落地,也为监管机构就连续制造如何监管提供了切实的指导意见。2021年10月18日,国家药品监督管理局药品审评中心(CDE)官网发布了关于公开征求ICH指导原则《Q13:原料药和制剂的连续制造》意见的通知,按照ICH相关章程要求,ICH监管机构成员需收集本地区关于第2b阶段指导原则草案的意见并反馈ICH[6]。随着ICH Q13正式发布的临近,连续制造工艺的审评也将逐步纳入药品监管考量。
1.2 应用背景
原料药行业目前竞争激烈,各原料药生产企业都对生产效率、制造成本控制提出了更高的要求,显然传统的批次生产不能满足新时代的发展需求。在探索原料药新的连续制造生产方式上,基于市场以及药物经济学的角度考虑,一般会从产品市场定位、产品附加值、产品工艺等几个方面来选择生产品种。轻质碳酸钙是化学工业生产中的一种基础原料,通过石灰石的煅烧、消化、碳化等一系列化学工艺过程生产。它广泛应用于橡胶、塑料、造纸、涂料、医药保健和农药、食品等生产领域中[7],碳酸钙作为原料药也具有较大的市场规模和需求。同时,碳酸钙的形成通常采用无机沉淀的过程,工艺简单稳定,非常适合转化为先进的连续制造工艺。根据国家药品监督管理局药品审评中心网站原辅包登记信息平台显示,目前拥有国药准字文号的碳酸钙生产厂家只有4家[8],均为传统的批生产工艺,因此,设计一条符合ICH Q13关于连续制造的概念和方法的药用级碳酸钙连续制造GMP生产线有很好的探索和实践意义。
2 原料药碳酸钙的连续制造生产线的设计与实现
2.1 概念设计
2.1.1 连续制造生产模式
工业级碳酸钙的生产普遍按照化工大规模连续生产设计,因此可参照已有的工业级生产线布局,进行药用级碳酸钙生产线设计和改造,连续制造生产线应利用PAT、自动控制系统、工艺控制模型以及整合各工序设备的连接,仍按照全连续流程进行设计。这符合ICH Q13中定义的3种连续制造模式之一,即:生产工艺的所有单元操作进行集成并以连续模式运行[2] 。在设计过程中,应注意原料合成区与洁净车间的厂房设施设备设计应符合药品生产质量管理规范(GMP)相关的要求。
2.1.2 批次的定义
连续制造的批次定义一般有3种方式,一是产物的量,二是输入物料的量,三是在定义的质量流量下的运行时间[2]。从部分国外已上市批准的连续制造工艺药品评估报告来看[9-11],批次定义通常使用的是输入物料的量来定义,这样更有利于物料的追溯。碳酸钙生产在设计时也可以考虑使用运行时间作为批次定义,这样就需要预先定义一个固定的质量流量,在整个生产过程的控制中,控制物料进料流量和反应时间已经包含在部分工艺策略中,因此使用运行时间作为批次定义应该是可行的。虽然如此,但在全连续的工艺条件下,以运行时间作为批次定义仍需进行评估和探讨。
2.2 工艺描述
轻质碳酸钙可通过两步反应制得,第一步:氧化钙与水进行消化反应,生成氢氧化钙;第二步:氢氧化钙与二氧化碳反应生成碳酸钙。具体反应公式如下所示:
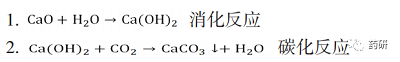
碳化反应结束后,碳酸钙浆料则输送转移至洁净车间,经脱水、干燥、包装等步骤,得最终碳酸钙原料药成品。
传统的批生产方式生产的碳酸钙工艺流程见图1(以下简称传统的批次生产工艺),生产规模依赖于设备规模,设备利用率不足,生产过程依赖于人工操作,工艺不连续,批次差异性大,无法控制产品包括形貌在内的各种质量特性,相比于连续制造,在同等规模下,生产周期长、耗能高、规模经济不显著。
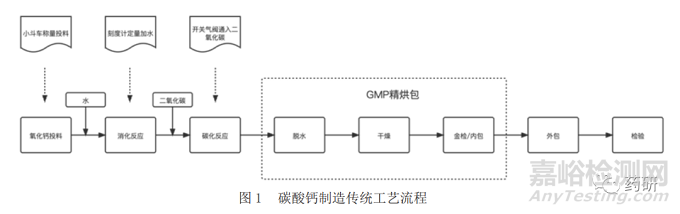
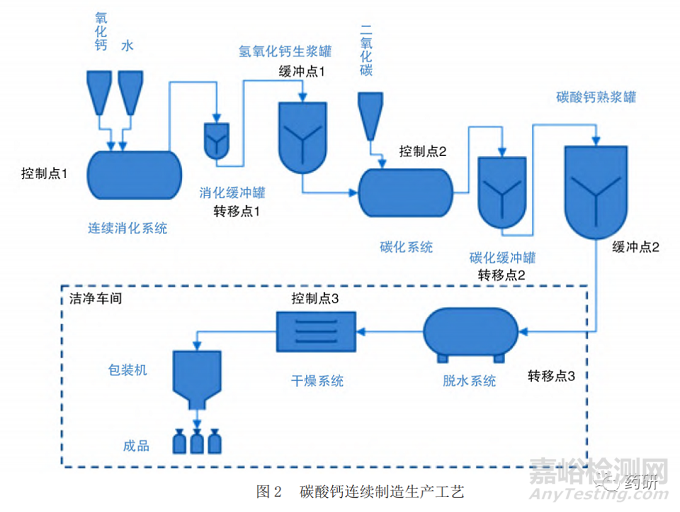
碳酸钙连续制造的工艺设计示意图见图 2。其基本过程包括了二个连续反应系统(消化、碳化)以及 3 个后续连续处理工序(脱水、干燥、包装)。相比于前述举例中的传统的批次生产工艺,该连续工艺每个工序都进行了自动化改造,并增加了工艺控制点,可以实现单元连续运行。同时,通过设置的缓冲点和转移点,实现各连续单元的连接。该设计既便于部分单元连续生产,以批生产方式制备成品,又具备了扩展为全连续生产模式的条件。其中氧化钙可以用石灰石煅烧产生,同时产生的二氧化碳也可用于碳化反应,更加节能环保。生产线前端也可以考虑配备全自动化生产的石灰窑炉,以实现起原料的自动化连续生产。
2.3 控制策略
连续生产的控制策略一般包含设备的设计与集成、物料可追溯性和转移、受控状态、工艺动态、工艺监测和控制、工艺模型、物料表征和控制等几个方面 [2]。在本文探讨的碳酸钙连续生产线设计过程中,最主要的消化反应和碳化反应均考虑了上述控制策略,并进行研究和设计。
2.3.1 消化反应
消化反应是氧化钙与水的反应,传统的批次生产工艺是氧化钙投入到消化反应釜中进行反应,待反应完成后,转移至下一步工序,进行碳化反应。如果要进行连续生产,就涉及到氧化钙及水的连续输入,消化反应的持续进行以及所产生的氢氧化钙持续输出的问题。
在设备设计方面,采用氧化钙及水的连续投料,在反应釜中进行消化反应。同时,需要将持续生成的氢氧化钙从系统中连续移去,从而保证反应的持续输入及输出。因此,在反应釜中设计了一个连续输出的管路系统,以此来保证输入以及输出的动态平衡。
在工艺控制和受控状态方面,为保证消化反应充分,需要对关键的工艺控制参数“水灰比”(即氧化钙与水的比例),进行控制,同时又要保证满足水灰比的物料同时进入反应釜进行反应,因此,在消化工艺中,可以采用连续消化机的系统控制,通过在线称重系统控制氧化钙的投料速度以及进料数量;再通过在线流量计系统,控制水的流速和流量;二者之间再通过专门设计的分布式控制系统(Distributed Control System,DCS)进行物料比的关联,从而实现反应物料、氧化钙、水的持续输入和稳定控制。物料的在线关联监控图见图3,二者能够保持稳定的输入比例。利用在线温度计的实时监控,确认消化反应的结束。
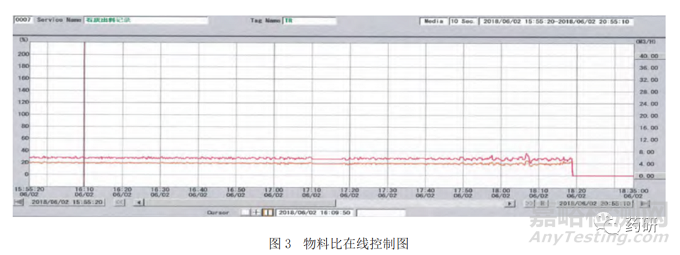
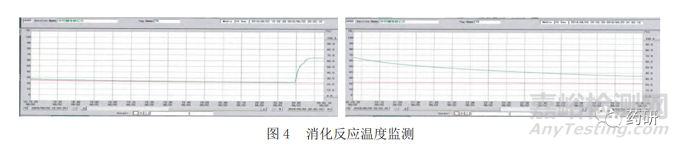
在工艺监控方面,体现在反应的终点判断上,由于消化反应是放热反应,当温度下降时,则可判定反应已经结束。因此,在控制指标上,以氢氧化钙浆料温度的变化,来持续监测消化反应的终点。
图 4 显示了在线监测温度曲线。在消化反应的初期温度上升,在达到反应完全后,温度逐渐下降。
2.3.2 碳化反应
碳化反应是混悬状态的氢氧化钙浆料与气态二氧化碳的酸碱中和反应。传统的批次生产是在碳化反应釜中通入二氧化碳进行反应。反应完成后,通过取样检测方式,使用酚酞指示剂进行反应终点判断。如果要进行连续生产,就需要确定影响反应终点的关键参数及控制方式。
碳化反应是碳酸钙生产的关键反应步骤,实际上通过控制不同的反应条件可影响着碳酸钙产品的微观结构,包括结晶形貌以及晶体尺寸等。为此需要建立工艺模型进行研究。
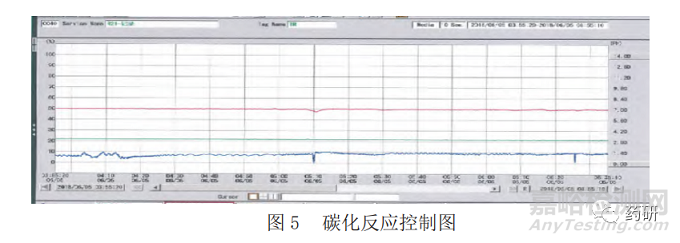
在工艺模型建立方面,首先考虑对碳化反应的各项参数建立与可控结晶形貌及尺寸之间的关联模型。通过相关文献资料[12]和实验室研究发现,产物晶形和反应速度以及反应过程中的pH值有直接关联,而pH值与氢氧化钙浆料的进料流量、二氧化碳气体浓度、流量等控制参数均形成相互关联。为简化控制机制,降低系统复杂度,在一定的工艺条件下,固定二氧化碳的浓度及流量,氢氧化钙浆料的浓度与终点判定的动态关联,最终形成通过设定关键参数pH值,DCS控制系统通过PID调节方式控制氢氧化钙浆料流量来拟合反应终点。图5显示了氢氧化钙及二氧化碳的连续输入,在线终点监测。图6、图7显示了不同控制模型下的晶形。

在设备设计方面,为支持上述控制方式,碳化系统采用小容量高通量的碳化反应釜设计。碳化反应釜设计了转移管路系统,确保反应完成的物料转移至熟浆罐,反应未完成的物料继续在反应釜内进行反应,以确保pH值的动态平衡。碳化缓冲罐的设计确保了氢氧化钙浆料进料量的可控。
在工艺监控方面,对所有影响碳化反应的参数:pH值;CO2浓度、温度、流量、氢氧化钙浆料流量等均实施在线监控,并建立了工艺报警清单。
2.3.3 后处理工序(脱水、干燥、包装)
碳化反应生产的碳酸钙浆料,还需要转移至洁净区进行脱水及干燥工序,得最终成品。其连续制造的实现方式较为简单,主要体现在设备的选型上,使用连续进出料的脱水设备和干燥设备,并进行工艺流程上的整合。
在设备集成设计方面,在物料从熟浆罐进入洁净区前设置了缓冲罐,脱水设备使用连续进出料方式的脱水设备,实现连续进入浆料,出料通过螺杆连续进入干燥机进行干燥,同时对干燥后的出料温度进行精准控制,物料经管道连续输送至自动包装机进行包装,得成品碳酸钙。
在工艺控制方面,干燥机的出风温度直接影响物料的水分,通过工艺验证来确保在目前的温度控制范围内,干燥后的物料水分符合要求。
2.4 监管考虑因素
对于连续制造工艺,参照ICH Q13的要求,监管层面除了关注控制策略外,还应考虑药品质量管理体系、原料药的稳定性、批工艺到连续制造的变更、工艺验证、清洁验证等方面[2]。
ICH Q13指出,从批工艺到连续制造的变更,需要制定适当的控制策略且批工艺和连续工艺的产物应具有相当的质量[2]。本文探讨的碳酸钙连续制造生产线在以批生产方式进行生产时符合经批准的生产工艺规定,而且,在连续生产模式时各操作单元的控制策略无变化。需要重点考虑全连续生产时的物料转移和收集,例如:物料在各工序的停留时间分布、各工序间的物料缓冲连接、不合格品的剔除等,另外还需要评估批生产和连续生产的原料药稳定性数据是否存在差异。
此外,需要特别关注全连续生产时整个系统的稳健性,包括清洁方式及传感器的结垢可能性,如碳化反应中关键的pH传感器在长时间连续生产后是否容易被物料污染,是否应配备冗余的传感器以降低风险,生产设备是否有运行时间的维护要求等。
工艺模型是控制策略中重要的一部分,对于工艺模型的科学性和合理性,也是监管考虑的重要内容。工艺模型可以实时预测质量属性,从而能够及时调整工艺以维持受控状态,也可以在开发阶段通过解释输入(例如:工艺参数,物料属性)和输出(例如:产品质量属性)是如何关联的来支持设计空间的建立[2]。在碳化工序中建立的pH值控制模型,就是通过在开发阶段的实验建立的,并通过工艺验证的方式明确了与原料药晶形的关系,这种控制方式是建立在工艺参数能够稳定控制产品质量属性的基础之上的。更优的工艺控制方式可以利用PAT,直接测量或预测质量属性,包括近红外光谱法、拉曼光谱法、X-射线粉末衍射法等,这些方法已成功应用于制药工业的各个领域,如原料药、生物药、中药的生产过程[13]。在本例碳酸钙连续生产线中,可利用拉曼光谱和近红外技术在反应釜中监控晶体形成的过程;同时可通过在线粒度检测监控碳化过程形成碳酸钙颗粒的大小,以适应不同制剂需求;而在精制干燥工序阶段,可采用近红外技术监控水分和颗粒均匀性。若采用近红外技术,应考虑模型的验证是否符合FDA和EMA发布的相关近红外验证指南要求[14-15]。
3结论与展望
连续制造作为药品生产的发展趋势之一,也是制药行业智能制造升级的重要方向之一。碳酸钙药品的连续制造在设备利用率、产线人员需求、占地面积、质量稳定性等方面较传统的批次生产工艺都有着显著的优势。连续流动的工艺控制系统以及过程分析技术是实现连续制造的关键,二者的控制反馈技术是实现实时放行的保证。
可以看出,通过对产品工艺的深入理解、新技术的运用以及工程设备的集成与设计,碳酸钙原料药连续制造生产线非常有望实现真正的全过程连续制造。通过传统的批生产系统积累的各项工艺参数数据,结合产品稳定性数据和工艺验证情况,也可以为连续工艺控制策略和工艺模型的稳定性和可靠性提供一定的支撑。总之,我国医药行业的连续制造发展尚处在起步阶段,需要监管机构、企业、科研院所等各界共同努力,并结合我国行业发展实际,探索从批生产转换为连续生产工艺的变更申报机制,促进连续制造在我国的顺利落地实施,为实现医药产业健康发展、制药行业智能制造升级奠定基础。

来源:Internet


