您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2022-05-19 14:26
引言:上海是长三角经济带最重要城市,也是我国医疗器械注册改革先发城市,在医疗器械监管管理方面一直是榜样和示范。本文以上海市药监局发布的2011年度官方数据为基础,带大家一起看医疗器械注册质量管理体系考核常见不符合项。
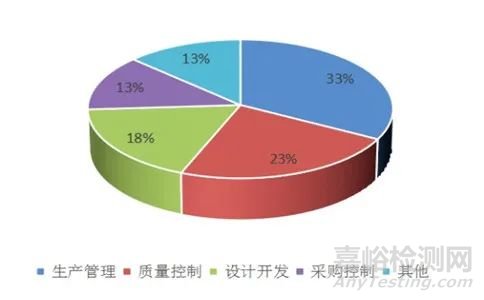
一、2021年度上海医疗器械注册体系考核不合格项分布:
2021年度共完成现场核查909件,累计发现不合项4648条,平均每次核查开具不合格项至少5条。其中生产管理、质量控制、设计开发、采购控制四部分的不合格项数量占总数的77%。
所有不符合项中,一般项不合格数量为3095条,占比67%,关键项(*星号项)不合格数量为1553条,占比为33%,说明我市医疗器械生产质量管理体系运行能力和总体情况较好。在关键(*星号项)不合格项中,生产管理占33%,质量控制占23%,设计开发占18%,采购控制占13%,这四部分合计占关键项总数的87%,进一步说明这四部分是医疗器械生产质量管理体系的核心和容易出现问题的薄弱点。
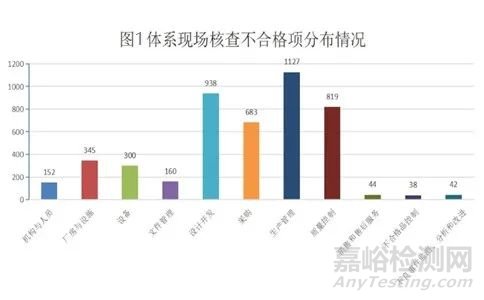
图2.体系现场考核关键不符合项分布情况
从不同类别的产品不合格项数量分布的情况来看,如下图所示,无菌产品共开具不合格项1527条,有源产品共开具不合格项1059条,较其他类型产品显著增加,一方面与无菌、有源类产品申报数量相对较高有关,另一方面也说明有源产品部分生产企业质量管理体系基础比较薄弱,运行能力和有效性不足;无菌类产品复杂,要求相对较高,企业容易出现管控不到位的情况。
二、医疗器械注册质量体系核查发现的主要缺陷和风险:
(1)变更控制方面 在原材料供应商或质量标准、产品结构组成或性能指标、生产方式或关键设备、工艺流程、工艺参数、性能检测方法或条件等方面发生变更后未及时进行风险评价、验证或确认、评审,实质性变更未按法定程序申请变更注册;内部沟通缺乏,操作层面文件未同步更新等,变更控制不充分,可能导致上市后的违法风险、产品安全和有效风险。
(2)偏差控制方面 在产品实现过程中未能有效识别偏差,物料质量等级或投料量、工艺配方和参数、质量检验原始数据和方法等与质量标准、工艺文件、产品技术要求等存在不一致的情况,可能导致上市后的违法风险、产品安全和有效风险。
(3)可追溯性控制方面 未明确内部及外部可追溯范围、途径、程度,在原料、半成品或成品的批号/编号管理、批记录控制、设备使用管理、仓库出入库管理、检验原始记录管理等方面存在批号/编号未准确记录、批记录关键参数不完整、关键设备记录缺失、出入库信息不全、原始记录不能提供、销售记录不完整等问题,不能实现产品质量有效追溯。
(4)委托生产方面 存在委托生产质量协议不完整、双方职责分工不明确、各过程接口不清晰、设计输出文件转移不全、受托方评审不充分、发生变更未及时沟通等问题,可能导致产品质量安全风险。

来源:Internet


