您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-05 11:18
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
诺诚健华蛋白降解分子胶报IND。诺诚健华新型靶向蛋白降解剂ICP-490的临床试验申请获NMPA受理。ICP-490是一款分子胶,通过与CRL4CRBN-E3泛素连接酶复合物的底物受体CRBN特异性结合,诱导淋巴转录因子Ikaros和Aiolos的泛素化降解,从而诱导细胞凋亡,抑制肿瘤细胞的生存及增殖;它还可以刺激T细胞活化,发挥免疫调节效应。该药将开发用于治疗复发/难治多发性骨髓瘤(MM)、非霍奇金淋巴瘤(NHL)等血液肿瘤疾病。
国内药讯
1.百济神州CD3/19双抗新适应症获批。百济神州注射用贝林妥欧单抗新适应症获国家药监局批准,用于治疗成人及儿童复发或难治性前体B细胞急性淋巴细胞白血病。贝林妥欧单抗是安进开发的靶向CD3和CD19的双特异性T细胞接合器(BiTE®),此前已在中国获批上市,用于治疗成人复发性或难治性前体B细胞急性淋巴细胞白血病(ALL)。百济神州拥有该药在中国的商业化权益。
2.辉瑞第三代ALK抑制剂在华获批上市。辉瑞第三代ALK-TKI洛拉替尼获国家药监局批准上市,用于既往接受过一种或多种间变性淋巴瘤激酶(ALK)酪氨酸激酶抑制剂(TKI)治疗的ALK阳性局部晚期或转移性非小细胞肺癌 (NSCLC) 患者。在这类耐药和肿瘤脑转移患者中,洛拉替尼的总缓解率达到48%。在美国,FDA已批准该新药用于治疗经治的ALK阳性转移性NSCLC、以及一线治疗ALK阳性NSCLC。
3.再鼎ROS1/NTRK抑制剂中国队列数据积极。再鼎ROS1/NTRK抑制剂repotrectinib治疗ROS1阳性非小细胞肺癌(NSCLC)全球Ⅰ/Ⅱ期TRIDENT-1研究中国亚组数据积极。ROS1 TKI初治队列中,全球cORR为79%,中国亚组cORR为91%;在既往接受过1个前线ROS1 TKI+1个前线化疗的经治队列中,全球cORR为42%,中国亚组cORR为67%;既往接受过2个前线ROS1 TKI的经治队列中,全球cORR为28%,中国亚组cORR为50%;既往接受过一个前线ROS1 TKI并且未接受化疗或免疫治疗的经治队列中,全球cORR为36%,中国亚组cORR为36%。epotrectinib的安全性和耐受性与之前报道一致。
4.诺华SMA基因疗法在华启动Ⅲ期临床。诺华治疗脊髓性肌萎缩症(SMA)的基因疗法OAV101注射液(Zolgensma)在中国登记启动一项Ⅲ期临床。该项研究是该药国际Ⅲ期临床的中国部分,拟评估鞘内(IT)注射OAV101在≥2岁至<18岁的携带SMN1双等位基因致病突变和2-4个SMN2拷贝的初治、能独坐但无法行走的2型SMA患者中的安全性、耐受性和疗效。Zolgensma是FDA批准的首款治疗SMA的基因疗法。该药2022年Q1销售额增长18%,预估年收入约为20亿美元。
5.君实PD-1单抗收到FDA完整回复函。君实生物日前发布公告,宣布收到FDA关于PD-1单抗特瑞普利单抗作为晚期复发或转移性鼻咽癌患者的一线治疗和单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗的生物制品许可申请(BLA)的完整回复信(CRL)。FDA要求君实进行一项质控流程变更。君实计划与FDA直接会面,并预计于2022年仲夏之前重新提交该BLA。
国际药讯
医药热点
1.《医学学术评价规范建议》发布。中华医学会第二十六届理事会常务理事会第六次会议审议通过《医学学术评价规范建议》。《建议》明确,医学学术评价应以同行评议的代表作制度为基础,构建政府部门引导评价、社会机构参与评价和用人单位执行评价的学术评价机制。高水平的研究论文仍是重要的评价指标,应提高发表在我国学术期刊上并且被国外引用的论文的评价地位。
2.国家区域医疗中心建设有序扩大。国家发改委等多部门印发《有序扩大国家区域医疗中心建设工作方案》。《方案》提出,在第一批8个试点省份基础上,将内蒙古、吉林、黑龙江、江西、广西、海南、重庆、贵州、西藏、甘肃、青海、宁夏12个省份和新疆生产建设兵团新纳入国家区域医疗中心建设范围,基本覆盖患者输出大省和医疗资源相对薄弱省份。力争到2022年年底,基本完成全国范围内的规划布局。
3.北京一公厕传染链近40人感染。5月3日,北京市第323场新冠肺炎疫情防控工作新闻发布会召开。北京市疾控中心副主任庞星火表示,1例感染者因3次上公厕,引发3例续发病例,进而引发近40例的感染者。此前在新发地疫情时(2020年6月),公厕就曾导致传播链延长。即日起,北京将增加公厕消毒频次,封控区内厕所一人一消毒杀菌,不能两人(含)以上同时如厕。
评审动态
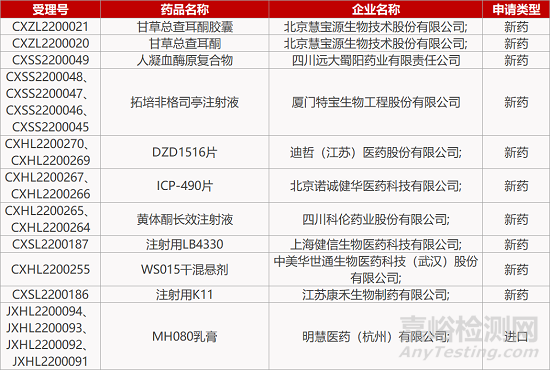


来源:药研发


