您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-22 01:53
药物能够以多种不同的固态形式存在,如无定形、多晶型、水合物、溶剂化物、盐、盐水合物/溶剂化物、共晶、共晶盐、共晶盐水合物/溶剂化物、共晶水合物/溶剂化物等,每种固态形式都具有其独特的理化性质。
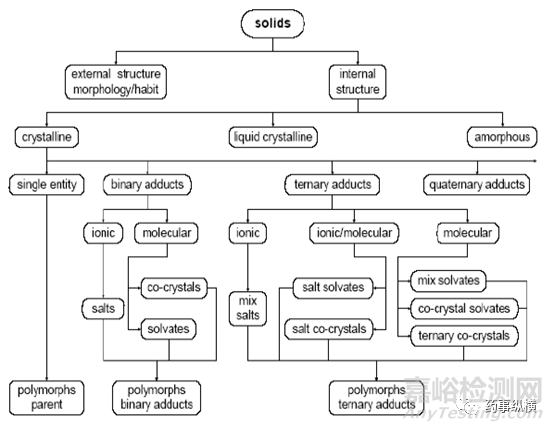
图1 固态物质的分类
共晶作为一种新兴的药物晶型,可以在不影响药物的内部结构的同时改善药物的理化性质、提高药物的溶解度、提高生物利用度、提高药物的稳定性、影响药物原有的药效活性。重要的是共晶可以突破原研公司的晶型保护,因此在当前的药物研发中引起了广泛关注。图2统计了近1999年至2018年关于共晶论文发表与专利授权的情况,可见药物共晶的研究发展之快。
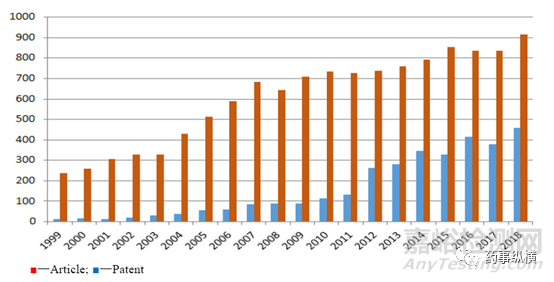
图2 共晶相关论文及专利授权的情况
本文对药物共晶的基本概念、FDA和EMA相关指导原则、理化性质、表征方法进行了归纳总结,并结合文献中的案例进行了说明,为共晶相关研究提供参考。
一、共晶简介
1、共晶的定义
在2018年FDA 颁布的《工业指南:药物共晶的监管分类》中将共晶定义为:共晶是在同一晶格内由两个或多个不同分子组成的结晶材料,一般来说是活性成分(API)和共晶形态(共晶物)。
2019年5月4日国家药典委官网发布的《中国药典》2020年版四部通则增修订内容(第十三批)公示的通则9015药品晶型研究及晶型质量控制指导原则(第二次征求意见稿)中首次收载了共晶的概念:由两种或两种以上的化学物质共同形成的晶态物质被称为共晶物,共晶物属晶型物质范畴。
2、已上市的代表性共晶药物
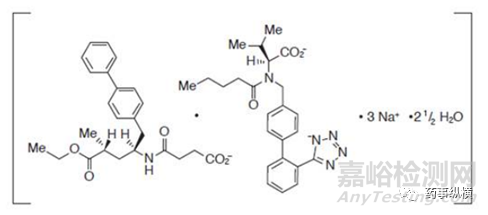
2015年7月,FDA批准诺华的新型抗心衰复方药物ENTRESTO(LCZ-696)上市,Entresto是沙库巴曲单钠盐、缬沙坦二钠盐和水的共晶物,化学结构式如下:
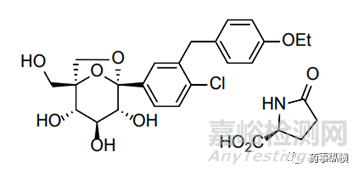
2017年12月,FDA批准默克公司的新型治疗糖尿病药物STEGLATRO上市,STEGLATRO是埃格列净-L-焦谷氨酸的共晶物,化学结构式如下:
这些共晶药物的获批上市提升了研究者和制药公司对共晶开发的热情,通过共晶研究来改善药物的理化性质或者生物利用度或规避专利,实现仿制药提早上市的目的。
二、药物共晶的指导原则
随着对晶型药物研究的深入,FDA和EMA已发布关于共晶药物研究的指导原则, 2020年版《中国药典》中也会收载共晶的定义及增加评价方法的说明,但与FDA和EMA指导原则比较内容还较少。
1、FDA指导原则
FDA先后于2013年、2016年分别发布了关于药物共晶监管分类的指导原则及其修订版,最终于2018年2月发布了《工业指南:药物共晶的监管分类》(Regulatory Classification of Pharmaceutical Co-Crystals Guidance for Industry)最终版,该指南中将共晶定义为:共晶是在同一晶格内由两个或多个不同分子组成的结晶材料,一般来说是活性成分(API)和共晶形态(共晶物,CCF)。
共晶与盐的显著区别是,共晶不像盐,共同存在于共晶晶格内的组分具有既定的非离子型化学计量相互作用,即共晶晶格内的共晶组分处于中性状态而不是以离子形式产生相互作用,而盐是指通过金属或类似金属的自由基代替酸的部分或全部酸性氢而产生的化合物,属于离子或电价结晶化合物。此外,共晶也不同于多晶型。多晶型是指同一API的不同结晶形式,不同的多晶型被认为是相同的API。多晶型包括晶格中以不同的排列方式或分子构型存在的单组分的晶体、无定形或多组分相(如溶剂化物和水合物)。共晶与溶剂化物更为类似,两者在一个晶格中均含有一个以上的组分。从理化和注册角度来说,共晶可以看作是一种特殊的溶剂化物和水合物,这里的第二种组份(共晶物),它不能是溶剂(包括水),并且通常是不挥发性的。从法规角度看,含有共晶的药品被认为是类同于API的一个新晶型。由两个或两个以上API组成的共晶(含有或不含额外的非活性共晶物)可被视为固定剂量组合的产品,而非新的API。
对于包含共晶形式的NDA和ANDA,申请人需要提交适当的数据支持以下内容:
(1)提供证据证明API和共晶物两者存在于单元晶格中。
(2)如果药物和共晶配体均具有可电离的官能团,要证明共有于共晶中的药物和配体之间的相互作用为非离子化相互作用。可参照如下决策:一般来说,如果API和配体的△pKa[pKa(共轭酸的碱)-pKa(酸)]≥1,将有大量的质子转移,此时离子化和成盐的可能性大于共晶。如果△pKa<1,将只有少量的质子转移。如果满足该标准,则API-配体实体可归类为共晶。然而,如果申请人认为依据pKa相对差值不能预测该固体是盐或共晶,则需使用光谱分析和其他正交方法来提供相反的证据。
(3)确保在到达药理活性位点之前API能从其共晶形式中大幅离解出来。鉴于API与其配体相互作用的数量级类似于溶剂化物中API与溶剂的相互作用,通常认为基于溶出度和或溶解性的体外评估足以证明API在到达药理活性位点之前与其配体的解离。
对于满足以上条件的共晶,对其进行表征和释放测试的类型和程度,应足以确保API的认定、剂量、质量和纯度。
2、EMA指导原则
EMA 2015年发布了针对共晶的反馈文件Reflection paper on the use of cocrystals of active substances in medicinal products,用于指导药物共晶的研究。该文件介绍了共晶的定义、共晶与其他固体形态的区别以及申报时的监管分类,与FDA指导原则的核心内容基本一致。与FDA指导原则不同,EMA文件中对部分易混淆的细节问题做了详细的讨论,例如:
(1)关于共晶与盐的区别:FDA指导原则中认为,共晶与盐的区别在于共晶中各组分均为中性状态,且组分间的相互作用力为非离子键;而EMA文件认为,共晶与盐的区别在于,在盐中各组分主要基于离子配对排列在晶格中,而在共晶中,都是通过较弱的相互作用组装而成的,例如氢键、π-π堆积或范德华力相互作用,共晶中的组分既可以是中性状态,也可以是酸性或碱性状态。
(2)关于组分间形成共晶或盐的判定:FDA指导原则建议通过API和配体的△pKa[pKa(碱)-pKa(酸)]进行判定;EMA文件认为通过△pKa不能精确地进行判定,需要利用光谱学工具进行判定。
(3)关于共晶配体:EMA文件中规定共晶配体必须是药学上是可接受的,安全和质量必须得到保证。如果以前没有在EU/EEA范围内的药品中使用过,应说明理由。应作为新辅料对待,例如应提供相应的毒理学数据。
(4)关于两个或多个API组成的共晶的注册分类:FDA指导原则将这类共晶全部归为复方制剂。EMA文件中同样规定这类共晶应按复方制剂进行申报,同时还规定,共晶中各组分的化学计量比直接决定各组分的剂量比,故其化学计量比不需要满足等摩尔,但必须符合合理的剂量比例。同时,还应充分考虑共晶对各单一组分生物利用度的影响。通常,这类共晶申报时需要符合所有复方制剂的相关要求,比如,需要明确标出共晶中每个组分的用量而非仅仅给出共晶的用量。此外,如果共晶中的某一组分与欧盟已批准的药品相比具有更多的治疗效果,可将其视为新药。
三、共晶药物的理化性质
1、熔点
药物共晶在药物晶格中引入了另一组分,其熔点与单独两组分相比会有所变化,一般介于药物和配体的熔点之间或是低于两者,高于两者熔点的情况较少出现。对于热不稳定的药物,形成共晶可提高药物的熔点而有效避免其在某些制剂工艺(如热熔挤出)受热过程中发生降解,也为这类药物提供了更多的制剂工艺选择。
2、溶解度
共晶的形成改变了药物原有分子排列和晶格堆积方式,使得药物与溶剂发生溶剂化时的相互作用发生了改变。此外,共晶溶解后,共晶形成物可能会影响药物-溶剂相互作用或改变溶剂的性质而改善药物的溶解度。将难溶性药物制备成共晶是改善其水溶性的有效途径之一。药物在溶出介质中的溶解度会显著影响其溶出度,因此,设计共晶时需密切关注其在溶出介质中的溶解度。共晶在溶出介质中的溶解度会受介质中的添加物(如溶液的pH、配体性质、加入表面活性剂等)的影响。如果共晶组分在溶液中能够电离,那么共晶在溶液中的溶解度具有pH依赖性。
在研究共晶的溶解度时,如果测定的是药物的平衡状态的浓度,可能会忽略药物在溶解过程中发生的晶型转变。因此,正确地测定共晶物的溶解度的方法应该是将过量的共晶粉末加入介质中,并与不同的时间点取样,绘制药物浓度-时间曲线。
卡马西平、氢氯噻嗪、共晶在水中的溶解度曲线如下图所示。卡马西平及共晶中的卡马西平的溶解度相近,而氢氯噻嗪在形成共晶以后,溶解度大约相当于原料药氢氯噻嗪的1/2。
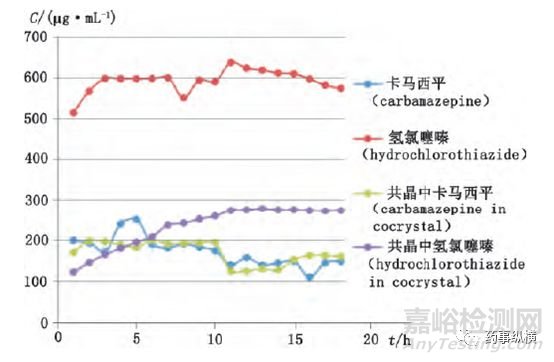
图3 卡马西平、氢氯噻嗪、共晶在水中的溶解度曲线图
3、溶出度
根据Noyes-Whitney溶出方程,药物的溶出速度(DR)公式为DR=AD/h(Cs-Xd/V),其中A为药物表面积,D为扩散系数,h为扩散层厚度,Cs为停滞层的药物浓度,Xd是药物在t时的溶出量,V是溶出介质体积。药物的溶出速率随表面积的增加而增大,而表面积与药物的粒径大小和被介质润湿的能力有关。共晶改变了分子间的连接和堆积方式,降低了原药物的晶格能,使溶质的溶解过程更容易,溶出速率提高;另一方面,不同制备方法会导致共晶粒子表面结构、形态、粒子大小不同,使共晶更易于润湿,粒径更小,会加速溶出。然而,有时共晶中的某组分的溶出也可能低于原药物,研究时应注意比较并进行说明。
黄芩素(BE)、茶碱(TH)、黄芩素-茶碱(BE-TH)物理混合物、黄芩素-茶碱(BE-TH)共晶在人工胃液中的溶出曲线如下图所示。
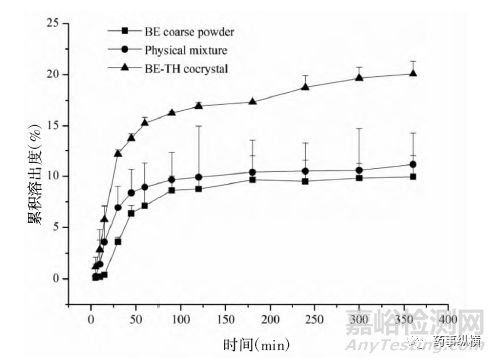
图4 BE、BE-TH 物理混合以及BE-TH 共晶在人工胃液中BE 的累积溶出度
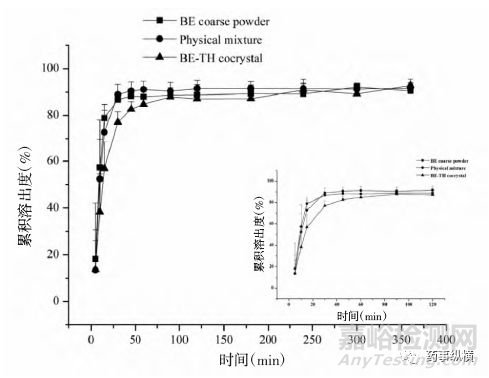
图5 TH、BE-TH物理混合以及BE-TH 共晶在人工胃液中TH的累积溶出度
在360min内的累积溶出度结果显示,BE-TH共晶与TH原料药及BE-TH物理混合物无统计学差异。但BE在30min内的溶出速率结果显示,BE原料药<BE-TH物理混合<BETH共晶,表明BE-TH共晶能够促进BE的溶解。TH在30min内的溶出速率结果显示,BE-TH共晶<TH原料药<BE-TH物理混合,表明BE-TH共晶对TH起到了缓释作用。
4、稳定性
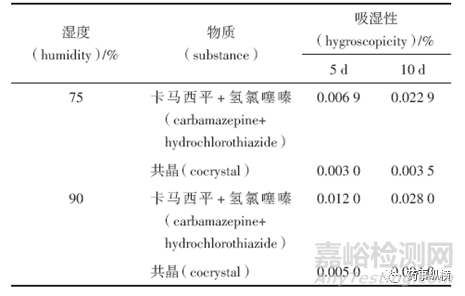
通常水分可能会引起药物发生固体形态的改变,共晶稳定性考察时应考察其吸湿性。药物吸收水分的程度取决于药物的理化性质与环境湿度。当药物分子与空气中的水分形成氢键或产生分子间作用力时,则易呈现吸湿现象。有些药物共晶后吸湿性降低,可能是药物分子和CCF形成了氢键,导致其结构中能够形成氢键的基团被占用,从而难以再与水分子相互作用,因此制备成共晶后吸湿性下降,此外形成共晶后固体粉末表面的性质(如孔隙率、比表面积等参数)发生了改变,使得粉末直接接触的水减少,也可能导致共晶吸湿性降低。
卡马西平与氢氯噻嗪在形成共晶后,在不同湿度条件下进行考察,其吸湿性均有所降低。
表1 卡马西平、氢氯噻嗪、共晶在高湿条件下的吸湿性
设计共晶时应对共晶的化学稳定性进行研究,考察条件可以为高温、高湿、光照、高温高湿等,并采用合适的有关物质方法进行考察。
例如:卡马西平与氢氯噻嗪在形成共晶后,在高温、高湿、光照条件下进行稳定性考察。结果显示,共晶与原料药相比,在高温、高湿条件下稳定性没有发生变化。卡马西平、氢氯噻嗪在光照的条件下不稳定(见表2),但是两者结合形成共晶后,卡马西平与氢氯噻嗪的稳定性均有小幅度的提高。
表2 卡马西平、氢氯噻嗪、共晶在光照条件下的稳定性
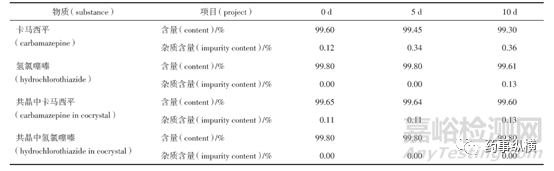
5、生物利用度
药物的吸收除与本身的渗透性有关外,还与药物的溶解度有关,某些难溶性药物由于其结构特殊,成盐困难,故可尝试通过与合适的共晶配体形成共晶来改善溶解度和溶出度,进而提高生物利用度。
6、机械性质
共晶的形成常伴随着晶形(晶习)的变化,晶形不同,会引起药物密度、机械加工性能、粒子流动性、聚合性和混合性等的差异,这些性质会影响制剂工艺的选择。
四、药物共晶的表征方法
1、X射线衍射法
X射线衍射法(XRD)是一种能够检测样品的三维立体结构(含手性、晶型、结晶水或结晶溶剂)或成分(主成分及杂质成分、晶型种类及含量)的分析方法。单晶 X 射线衍射法(SXRD)的检测对象为一颗晶体,是确定晶体结构最准确、最权威的方法;粉末 X 射线衍射法(PXRD)的检测对象为众多随机取向的微小颗粒,它们可以是晶体或非晶体等固体样品,共晶物与物理混合物的粉末X射线衍射图谱间存在差异。根据检测要求和检测对象、检测结果的不同需求可选择适应的方法。
拉莫三嗪-邻苯二甲酰亚胺共晶的单晶衍射分析结果表明,该晶体的空间群为p21/c1,其不对称单元由一个拉莫三嗪和一个邻苯二甲酰亚胺组成。在晶体中,碱性超分子单位是两个拉莫三嗪分子通过氢键N1—H⋯N2连接形成的氨基吡啶二聚体。二聚体中一个拉莫三嗪通过N1—H1⋯O1与邻苯二甲酰亚胺间形成氢键,另一个拉莫三嗪的N3原子通过N3—H3⋯O1与邻苯二甲酰亚胺的O1原子形成氢键,导致O1原子成为双质子受体。与O1相反,另一个邻苯二甲酰亚胺的O2 原子通过氢键O2⋯H3B—N3 连接拉莫三嗪的N3原子。邻苯二甲酰亚胺的N6原子通过与拉莫三嗪的N4原子形成氢键N4⋯H6A—N6 进行连接。
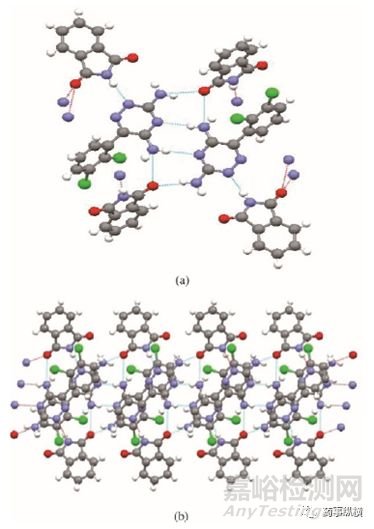
图6 拉莫三嗪-邻苯二甲酰亚胺共晶的单晶结构图:拉莫三嗪与邻苯二甲酰亚胺形成的超分子合成子(a),拉莫三嗪-邻苯二甲酰亚胺共晶ac平面的结构图(b)
经粉末X 射线衍射法检测,罗沙司他-肉桂酰胺共晶在6.22、10.46、14.57、25.30 ± 0.2°等处出现新的特征峰,与罗沙司他、烟酰胺的晶型不同。
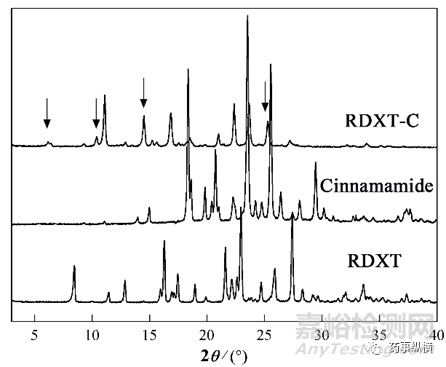
图7 罗沙司他-肉桂酰胺共晶PXRD图
2、热重法
热重法(TG)可以区分样品中所含的水分是吸附水(或吸附溶剂)还是结晶水(或结晶溶剂),并根据热重曲线中的失重率可计算出所含结晶水(或结晶溶剂)的分子比例。
卡马西平原料药、没食子酸甲酯与共晶CBZ-MTG的TGA 谱图如下。没食子酸甲酯(曲线a)起始失重温度为206℃,到298℃时失重78.7%;原料药卡马西平(曲线c) 在196℃开始失重,到265℃时失重96.8%。曲线b为共晶热重曲线,其在186℃开始失重,到260℃失重96.5%,说明共晶在186℃之前较为稳定。
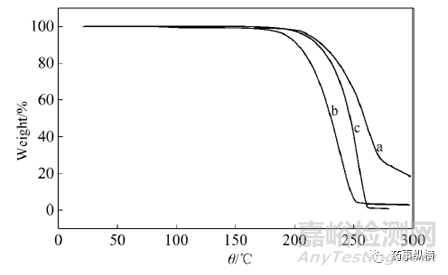
图8 卡马西平(a)、氢氯噻嗪(b)和卡马西平-氢氯噻嗪共晶(c)的DSC图
4、红外光谱
红外光谱法(IR)可对共晶样品进行定性分析,当组分通过氢键等化学键形成共晶后,其化学键吸收峰会发生相应偏移,据此判断是否形成共晶。
来那度胺中1702cm-1归属于C=O的伸缩振动峰,向低频方向移动至1676cm-1,这是由于氢键共轭效应的存在,使其振动频率降低;烟酰胺中1682cm-1归属于C=O 的伸缩振动峰,向高频方向移动至1704cm-1。可知来那度胺和烟酰胺之间存在C=O⋯N=H氢键相互作用,表明它们之间能形成共晶。
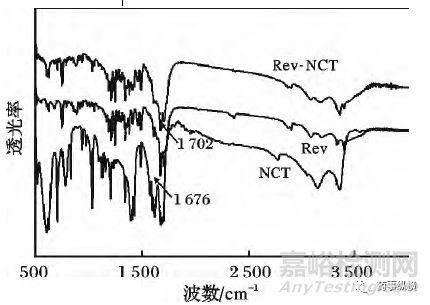
图9 来那度胺(Rev)、烟酰胺(NCT)和共晶(Rev-NCT)的红外光谱
5、拉曼光谱
拉曼光谱法是以拉曼效应为基础研究分子振动的一种方法,主要用来监测分子和光相互作用产生的散射光和频率,与红外光谱源于偶极矩变化不同,拉曼光谱源于极化率变化,可用于研究非极性基团和对称性振动,有时红外吸收不明显的非极性基团在拉曼光谱中往往很明显。
在吡嗪酰胺与2,5-双羟基苯甲酸物理混合778、1453cm-1的位置存在一个由吡嗪酰胺和2,5-双羟基苯甲酸共同峰位叠加所造成的特征峰,但是在形成共晶之后该特征峰却几乎消失不见。因此,能够初步判断氢键作用使得共晶体的形成导致其空间结构发生改变不同与原料药使得其光谱特征与原料药不同。另外还有一些明显的差异,例如物理混合物中1303、1348、1386cm-1处的特征峰在共晶体光谱中没有出现,但是该位置附近1322cm-1处仅出现一个特征峰。
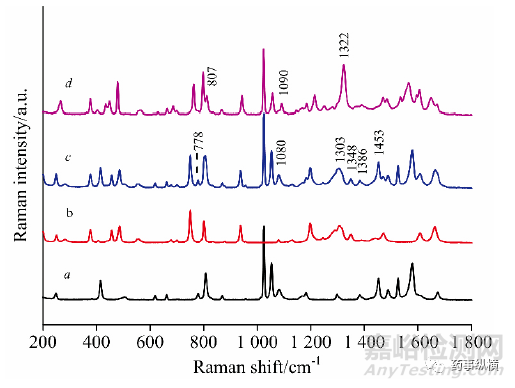
图10 吡嗪酰胺(a)、2,5-双羟基苯甲酸(b)、物理混合物(c)和共晶(d)的拉曼光谱
6、核磁共振波谱
根据核磁共振波谱图上共振峰的位置、强度和精细结构可判断共晶中碳原子和氢原子的化学环境,根据特征峰的位移可分析API 与CCF 分子间作用力,判断是否形成共晶。
罗沙司他-肉桂酰胺共晶的核磁共振氢谱如下图所示,共晶的图谱显示没有发生质子转移,证明了形成的是共晶而非成盐;通过核磁共振氢谱分析,计算出共晶分子中API 和CCF 的摩尔比是1:1。
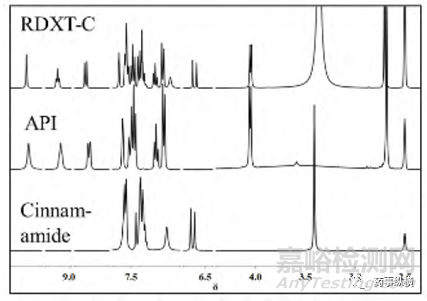
图11 罗沙司他-肉桂酰胺共晶的1H-NMR图谱
7、扫描电镜法
共晶的晶形(晶习)不同,会引起药物密度、机械加工性能、粒子流动性、聚合性和混合性等的差异,这些性质会影响制剂工艺的选择。
柚皮素(NAR)、烟酰胺(NCT)以及柚皮素-烟酰胺(NAR-NCT)共晶的扫描电镜(SEM) 图如下图所示。制得的NAR-NCT共晶的外观与NAR和NCT明显不同,在放大2000 倍下,NAR(A)为板状晶体,NCT(B)为棒状晶体,NAR-NCT (C)共晶为粒状的晶体,具有明显的形成共晶的特征。

图12 NAR( A) 、NCT( B) 和NAR-NCT共晶(C) 的SEM图(×2000)
五、结语
目前,共晶药物已经引起了广泛关注,除了本文中提到的共晶概念、理化性质和表征方法外,研究人员还需要继续研究共晶的设计、共晶的形成机理、共晶的构效关系、共晶的工业化生产等问题。
同时,也希望国内关于药物共晶研究的相关技术指导原则能够逐步完善,以推动共晶药物研究的快速发展。
六、参考文献
[1] EMA,Reflection paper on the use of cocrystals of active substances in medicinal products, 2015
[2] FDA, Regulatory Classification of Pharmaceutical Co-Crystals Guidance for Industry, 2018
[3] 张建军,钱帅,高缘.晶型药物研发理论与应用[M].北京:化学工业出版社,2019.1
[4] 徐巾超,陈勇,叶辉青等.罗沙司他共晶的合成、表征与理化性质研究[J].化工学报,2020
[5] 张亚晴,吕宝兴,牛景梅等.药物共晶的制备表征及体外释放的研究进展[J].中国药剂学杂志.2019,17(3):77-82
[6] 黄雨婷,徐嘉,迟宗良等.药物共晶筛选技术的研究进展[J]. 国际药学研究杂志,2016,43(4):682-687
[7] 朱玉苹,张燕,杨钊等.卡马西平与氢氯噻嗪共晶的表征与性质的研究[J].药物分析杂志,2018,38(10):1842-1849
[8] 张瀛,皮佳鑫,李雯等.黄芩素-茶碱共晶的溶剂体系筛选及体外溶出度评价[J].天津中医药,2020,37(1):93-98
[9] 张金彦,匡雯婕,吉绍长等.拉莫三嗪-邻苯二甲酰亚胺药物共晶在有机溶剂中溶解度及三元相图测定[J].化工学报,2019,70(11):4153-4161
[10]王冠宇,王炳全,谭晓晓等.一种卡马西平共晶的合成及表征[J].精细化工,2018,35(3):437-442
[11]庞丽丽,陈美玲,陆杰.来那度胺-烟酰胺共晶的制备与表征[J].应用化工,2015,44(2):203-205
[12]王琪琪,王亚国,金顺吉等.拉曼光谱和DFT分析吡嗪酰胺和2,5-双羟基苯甲酸共晶体[J].光谱学与光谱分析,2018(38)10:211-212
[13]许丹,李彤,张婷婷等.柚皮素烟酰胺共晶的制备及表征[J].中国药学杂志,2019,54(4):291-296

来源:Internet


