您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-03-13 01:12
[摘要]容器密封完整性( container-closure integrity,CCI) 是无菌制剂研究和评价的一项重点关注内容,是其在整个生命周期内保证产品质量并保持无菌的关键因素。本文介绍了无菌制剂容器密封完整性检测的法规背景及相关研究进展,分析了目前无菌制剂常见包装密封完整性检测技术的优缺点及选择依据,根据目前密封完整性检测技术存在的问题归纳了研究要点,最后对容器密封完整性的发展提出了展望,以期为无菌制剂在整个生命周期中的密封完整性保证以及国内制药行业在密封完整性检测技术方面的选择提供参考。
容器密封完整性也称包装系统密封性,被定义 包装防止产品损失、阻止微生物侵入以及限制有害气体或其他物质进入,确保产品符合所有必须的安全和质量标准[1]。没有绝对密封的包装容器,所有包装都存在某种程度的泄漏,但并不是所有的泄漏都会影响产品的质量。只要在产品生命周期( prod- uct life cycle,PLC) 内包装泄漏不超过产品包装最大允许泄漏限度值( maximum allowable leakage limit,MALL) ,能保证产品的质量要求,则认为该包装系统是处于密封完整的状态。容器密封完整性性能是容器密封系统( container-closure system,CCS) 的基本特征[2]。对于无菌制剂,在整个生命周期阶段保持其密封完整性至关重要,如果密封性指标没有达到标准的要求,轻则会导致产品的潮解霉变,降低药效或口感,重则导致安全事故的发生。鉴于无菌制剂容器密封完整性测试( container-closure integrity test,CCIT) 的重要性,需要对无菌药品进行密封完整性检测,从而使其密封性得到有效的保障。本文对无菌制剂包装系统密封性检测的法规背景及相关研究进展,检测技术的优缺点比较及选择依据,目前密封完整性研究存在的问题及研究要点等方面做简要综述。
一、法规要求及研究进展
1.1 法规要求
1998 年,美国注射剂协会( PDA) TR27 关于药物包装完整性的技术报告中介绍了在整个产品生命周期内评价包装完整性的关键因素信息,指出了包装密封性测试的不同方法[3]。2008 年,美国 FDA颁布了正式的包装系统密封完整性测试工业指南,明确指出在无菌药品稳定性考察阶段可以使用密封性测试方法代替无菌检测方法[4]。同年欧盟《药品生产质量管理规范》GMP 附录 1 的第 117 条和 118条也对无菌产品密封性检测提出了要求,明确在最终处理阶段应采用经验证的方法对产品进行密封[5]。2013 年,《美国药典》( USP) 〈1207〉章节第一次以药典法规形式明确要求 CCI 的检测,时至今日,该章节已发展为目前比较完善的密封性测试指导文件。2020 年,欧盟 GMP 附录征求意见稿中,在附录1 的无菌药品生产章节以及附录 15 的确认与验证章节对密封完整性提出了补充。我国对包装系统密封性测试方面的重视程度也在日益加强。2010 年,我国 GMP 指南无菌药品附录第 77 条指出无菌药品包装容器的密封性应当经过验证,其中熔封的产品( 如玻璃安瓿或塑料安瓿) 应当做 100% 的检漏实验[6]。国家药品监督管理局药品审评中心( CDE) 在 2020 年发布的《化学药品注射剂仿制药质量和疗效一致性评价技术要求》中提到注射剂在稳定性考察初期和末期进行无菌检查,其他时间点可采用容器密封性替代[7]。2020 年 7 月,CDE 起草了国内首部《化学药品注射剂包装系统密封性研究技术指南( 试行) 》[1],其中对注射剂密封性检查方法的选择和验证进行阐述,旨在规范包装系统密封性研究。
1.2 研究进展
从 1994 年美国 FDA 发布第一份提及包装系统密封性测试的指导文件开始[8],药品监管部门已逐渐开始重视无菌制剂的密封性检测,至今多个国家和组织都已在无菌制剂密封完整性测试方面制订了相关标准及法规。我国相对于欧美国家/地区来讲虽然起步较晚,但是 2020 年发布的《化学药品注射剂包装系统密封性研究技术指南》无疑表明了我国药品监管机构对于密封性检测的重视。但是国内外现有的法规标准很大程度上仅是提出了需要进行密封性测试的理念或者大体阐述密封性测试的策略,关于包装系统密封性检测方面,相关生产企业和监管部门还需要有更深入的研究。
二、容器密封完整性检测技术比较
国内外目前现有的密封完整性检测技术的比较见表 1。
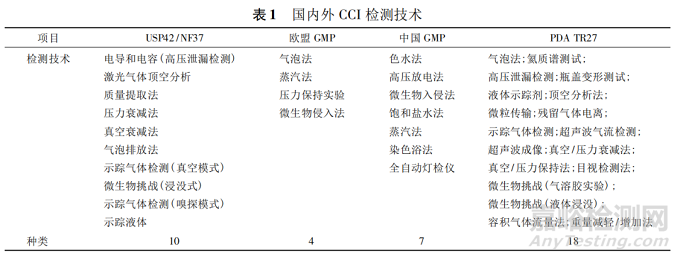
根据 USP〈1207. 2〉容器密封完整性测试,包装密封完整性检测方法依据测试技术主要可分为确定性泄漏检测技术以及传统的概率性泄漏检测技术。当下行业内大多数所用的传统包装密封性检测方法是色水法( 亚甲基蓝染色法) 和微生物挑战法,这 2种方法被 USP〈1207〉定义为概率性的测试方法。确定性泄漏检测技术主要是物理性的容器密封完整性测试方法( physical container-closure integrity test, pCCIT) ,包括真空衰减法、压力衰减法、高压放电法、质量提取法、氦质谱法、激光气体顶空分析法等。物理泄漏检测方法并不直接测量微生物侵入,而是测量可归因于微生物失效的泄漏的某些物理性质。鉴于不同的方法有不同的适用范围和灵敏度,在无菌制剂的整个生命周期中需要用 1 种以上的方法来评估 CCI。USP 以及 FDA 都建议在选择泄漏测试方法时,优先选择 pCCIT,该法可用于满足 PLC 所有阶段的测试要求。
不同检测技术之间的比较见表 2。



不同的密封完整性检测技术各有优缺点,在无菌制剂的整个生命周期中,并不存在容器完整性测试的一个黄金标准。需要对 CCI 进行全面的方法论证,以确保封闭系统的完整性,直至过期[9]。
三、容器密封完整性检测技术选择依据
泄漏测试是包装完整性保证过程的一部分,从产品包装设计开始,一直到产品的使用,在产品的整个生命周期里可以选择不同的测试方法[10]。无菌产品包装所关注的泄漏表现形式主要有 3 类: ① 微生物的侵入。② 包装容器内产品的流出,或者外部液体/固体物质进入包装内。③ 包装容器内气体顶空含量的变化[11]。对于包装的泄漏,容器密封性检测技术可以实现对泄漏位点的检测、泄漏途径判断以及测量泄漏率等。所有的泄漏测试技术首先都是为了检测泄漏途径是否存在,当然,测试技术不同,通常会得到更多的检测信息。
无菌制剂密封完整性检测技术有许多种,在面临一个品种的密封性测试时,如何去选择合适的方法也是一个难点。每种技术的特点不同导致其适用的检测对象存在差异,不能仅通过单一的泄漏测试方法来确保包装的完整性。目前还没有公认的检测技术来检测和评价无菌制剂的 CCI,各种测试技术各有优缺点。在选择不同的测试技术时,灵敏度是一个重要的考虑因素。一般来说,最小的泄漏只允许气体流动,而较大的泄漏也允许液体流动,甚至更大的泄漏也可能允许微生物进入,这也说明了不同的仪器因其测试原理不同所达到的检测精度不同。研究表明,在方法灵敏度上被认为是 pCCIT“金标准”的真空氦检法确实具有最高的检漏灵敏度,可检测到小于 0. 1 um 的漏孔; 激光顶空分析和真空衰减法也表现出较好的检测灵敏度; 而传统的检测技术很难对包装密封性做精密的判断。此外,更要考虑到测试产品本身的特性,比如真空衰减法在测定具有较低黏度的产品包装时,检测是有效、可靠和可重复的,但它不适用于蛋白质等生物制品的包装容器检测,高压放电法可与之形成互补。通常企业在选择测试方法时要结合产品本身的特性,结合既有的经验综合分析。
四、无菌制剂容器密封完整性检测存在问题及研究要点
目前,在无菌制剂容器密封完整性测试领域,存在的问题主要可归因于对于容器密封性测试方法的不了解,研究不深入。现在,单是传统的色水法和微生物挑战法已不能满足我国药品监管机构对于包装系统密封性测试的要求,通过在 pCCIT 和微生物挑战法之间建立关联性,并且使用阳性样品来验证灵敏度,方可更好地达到包装容器的密封性检测要求。
4.1 无菌制剂容器密封完整性检测存在问题
4.1.1 微生物挑战法和色水法占多数,物理方法不普及
对于无菌制剂的密封完整性测试,美 国Lighthouse、欧洲 Pharmaceutical Technology 协会曾对103 家药企进行调查,他们发现密封完整性测试技术使用率最高的是色水法和微生物挑战法。而我国密封完整性研究起步相对较晚,在检测技术方面还有所欠缺。目前国内企业在注册阶段多数采用的也是这 2 种传统的检测技术,有些产品发补阶段被要求增加物理测试方法,但物理方法在国内尚不普及。
4.1.2 阳性样品在容器密封完整性检测中的应用
所有的包装密封性技术以及所有的包装密封性研究均离不开阳性样品的支持,而目前有些企业在商业化生产中完整性检查时并没有用到阳性样品来进行验证。无论是传统的色水法和微生物挑战法还是pCCIT,测试过程中都需要用到阳性样品来确认方法的可行性,并且 pCCIT 与微生物挑战法建立关联的关键也在于阳性样品的使用。阳性样品的选择方式也不尽相同,不同的阳性样品对不同包装具有不同的适用性,不同阳性样品所能达到的灵敏度是不同的。
4.1.3 物理 CCIT 方法和概率性测试方法的关联
企业在进行密封完整性测试时,通常会选择一种方法,可能是物理测试方法,可能是概率性的色水法或者微生物挑战法。无论选择哪一种,通常都是不完整的,在提交资料时面临发补的概率比较大。在关于产品密封性测试众多的发补案例中,提到较多的就是要求申请人在提供密封性验证资料时,需要比较概率性的测试方法和物理 CCIT 方法的灵敏度。
4.2 无菌制剂容器密封完整性检测技术研究要点
4.2.1 关注各种检测技术的灵敏度
目前没有单一的方法可以被认为是在无菌制剂生命周期的特定阶段评估药品的 CCS 完整性的最佳方法。没有一种“黄金标准”方法总是优于其他方法,任何实验方法都应适合其预期用途。在选择测试方法时,尤其需要关注该方法能达到的灵敏度( 或检测限) ,并采用阳性样品来验证,不能仅是使用仪器自带的标准漏孔和微型流量计进行验证。Peláez 等[12]采用不同的测试方法对不同人工泄漏类型的样品进行测试分析,其中对于微孔型的阳性样品,氦泄漏测试能够100% 检出具有 2 μm 缺陷的样品,真空衰减法和激光气体顶空分析法能够 100% 检出具有 5 μm 缺陷的样品,而色水法的最小检出限为 10 μm。可见使用不同的检测技术,表现出来的灵敏度是有一定差别的。Patel 等[13]采用真空衰减法对注射用小瓶包装系统中冻干产品的密封完整性进行了验证,研究结果证明了真空衰减泄漏测试能够检测出激光打孔直径≥5 μm 公称直径的包装,即方法灵敏度可以达到 5 μm。
4.2.2 微生物挑战法与物理 CCIT 方法相关联
目前,概率性测试方法与物理 CCIT 方法相关联是密封性研究的难点,当然也是研究的热点。过 去,说无菌产品包装具有容器密封完整性通常意味着包装已通过或能够通过微生物挑战性实验,但 USP 〈1207〉更广泛地定义了容器密封完整性的概念,包括不存在危及产品质量的所有包装泄漏,这就意味着密封完整性测试不能仅通过概率性的微生物挑战法或者色水法进行,还须与物理 CCIT 方法相关联。Kirsch 等[14]建立了玻璃注射小瓶的微生物检测与氦质谱检测方法,并得到玻璃小瓶中微生物侵入概率和氦气泄漏率之间的相关性。Nastaran 等[15]通过比较含有不同大小泄漏样品的质量提取测试和微生物实验结果,建立了间接相关性,该系统能够可靠地检测直径 < 15 μm 的缺陷尺寸。
五、展望
尽管我国包装系统密封性研究起步晚,但是近年来相关监管机构已经越发重视此方面的研究, 《化学药品注射剂包装系统密封性研究技术指南( 试行) 》填补了国内 CCIT 指导方向的空白,但该指南尚未提供关于如何进行 CCIT 的细节。通常情况下,在无菌制剂生命周期中进行 CCI 检测一般是参照行业经验、类似产品或包装的经验以及已发表的文献等,目前各国也都尚未发布技术指南对测试方法的选择、方法验证项目及可接受标准等进行指导,这是制药行业面临的一大挑战[16]。未来将在包装密封完整性领域推进物理性检测技术的应用,通过更深层次的研究,解决不同类型药品包材密封性检测技术以及不同阳性样品的选择方式问题,尤其要关注微生物挑战法与物理 CCIT 方法之间的关联性,并且在制药行业内形成针对不同类型包装的检测标准或技术指南,从而更好地指导容器密封完整性测试。

来源:中国新药杂志


