您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-24 23:18
1 ASAP(AcceleratedStability Assessment Program)简介
在新药开发过程中,稳定性研究是一项耗时耗力耗样品的工作。因此,研发人员通常采取的办法是将产品在加速的条件下进行测试,以提高化学或物理降解的速率。根据Arrhenius方程,化学降解随着温度的增加而增加,因此应该可以从加速或强制降解条件下生成的数据预测低温下的降解速率。然而,这些实验的预测能力并不总是足够的。一方面,仍需要长期稳定性研究不可避免,而且长期稳定性研究结果与加速稳定性所获得的预测结果有较大偏差。另一方面,不可能无限制地提高温度以获得有意义的结果。
2 目前加速实验的局限性
那么,为什么加速稳定性研究产生的数据不能很容易地转移到真实的稳定性研究中呢?
一方面:对于固态的API而言,API所处的微环境不同,在其表面,可以以晶形或非晶形存在,也可以溶解在其他材料中,每一种状态都有自己的动力学这就形成了一个复杂的动力学系统。对于药物制剂,由于二次降解、异构体系(多元混合)反应动力学、反应抑制剂(如抗氧化剂)的参与,超过50%的药物制剂稳定性均呈现非线性降解动力学特征。即反应速率随条件的变化,在Arrhenius方程中仅考察温度这一个因素。但对于药品稳定性而言,尤其是固体药品,相对湿度也是一个重要的影响因素,在其它类型的药品中,氧含量也需要加入考量范围。
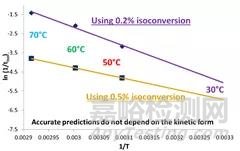
如下图所示,只考虑温度因素的情况下,将样品在30℃、60℃、70℃的加速条件下放置一个月并检测杂质含量(图1)。接下来,将反应速率(lnk)与温度(1/T)进行作图(图2),这时我们发现三个条件下测得的反应速率完全不在一条直线上,意味着传统的加速稳定性实验无法准确预测长期存储条件下的反应速率。
图1 传统加速实验下杂质增长速率(30℃、60℃、70℃)
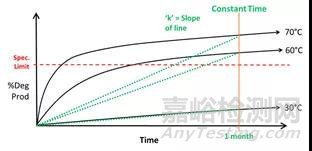
图2 传统加速实验下预测长期稳定性
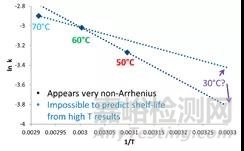
这两个方面都可能与溶液无关,因为溶液中所有的分子都在相同的微环境中具有相同的性质。然而,溶液状态样品高温数据的预测不准确的来源可能是由于随温度的变化的pH值会导致动力学的差异。
3 ASAP的设计理念
ASAP是基于等转换(isoconversion)和湿度校正的Arrhenius方程来完成实验和稳定性预测的。实验一般包括5-8种存储条件,温度范围为50℃~80℃,相对湿度范围为10%~75%,整体实验时间为几天或几周。
等转换可以用“失效边缘”时间来描述,是指某一降解产物、总降解物或其他需要达到所规定极限的时间。通常选择的是货架期。
图3传统的加速实验设计(基于相同实验时间)
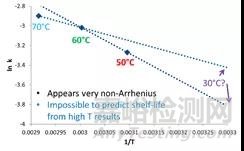
图4 ASAP的加速实验设计(基于相同实验时间降解程度)
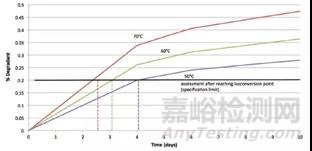
第二个概念是使用湿度校正的Arrhenius方程。
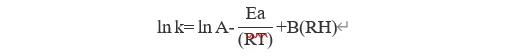
其中,K是等转化时间(降解速率%/天);
lnA为碰撞频率(特定常数,理论上的最高转化速率);
Ea为反应的活化能(反应对温度的敏感程度,一般取值在10~45 kcal/mol之间);
RT一般取1.986cal/deg(R是理想气体常数,T为反应温度);
B是水敏感因素项(反应对湿度敏感程度,取值为0或者0.10,0代表水分敏感性低,0.10代表水分敏感性高);
RH是物料所处环境的相对湿度。
图5 ASAP基于不同等转换量(0.2%和0.5%)预测稳定性时间
4 ASAP实验步骤
4.1 信息收集
首要任务是收集有关API的所有相关的物理化学资料。根据以往的ICH稳定性数据、强制降解研究数据和包装信息,可以更快的选择实验条件和时间点。这些信息有助于识别物理和化学稳定性的属性信息,例如:API中多晶的差异、关键辅料的相对湿度、熔点和等温线。APSP的一个重要假设是,在APSP研究中只有化学变化而没有物理变化,或者物理变化对药物化学稳定性的影响可以忽略不计。因此APSP研究应避免物理变化,第一ASAP对物理变化的预测能力尚未得到证明,第二物理变化会影响药物的化学稳定性。
4.2 确定等转化时间
降解产物等转换时间的评估是一种迭代方法,根据研究几个加速条件下的时间点样品降解的水平去推测达到某一特定降解水平的时间。因此第二部需要确定API或制剂的稳定性决定参数和参数的限度,例如效价或者是降解物的量,其中使用限度作为等转换点是确定货架寿命最为准确。
4.3 实验条件设计
每种产品的条件必须依据其自身性质单独确定。表1给出了一般情况下实验条件和时间点的示例。建议所有分析同时进行,以最大限度地减少分析偏差。在确定等转换点时,最好使用插值法而不是外推法。如果没有找到等转换点,则外推点越多数据就越不准确。
表1 基于DOE设计的ASAP实验设计表
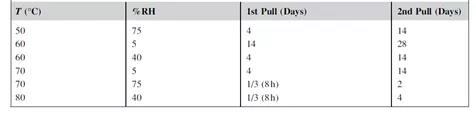
图6 基于DOE的ASAP实验条件示意图
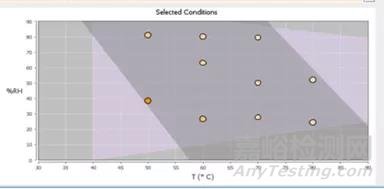
图7 典型的ASAP样品放置图

(样品开口放置,通过饱和盐水控制湿度,且温度、湿度在放置过程中使用温湿度传感器全程监控)
根据药品对水分的敏感性,ASAP研究可以选择对样品是否进行包装,在无包装研究中,样品被开口放置在稳定性试验箱中,这样可以直接接触湿气。对于包装好的样品来说,包装内的相对湿度是很重要的,这个相对湿度是时间和储存条件(T和RH)的函数,可以通过包装、产品和干燥剂(如果有)的吸湿等温线MVTR(湿气转移速率)和顶空体积计算出来。
在这值得一提的一点是,ASAP是作为固体药物稳定性评估的工具而被设计开发的,因此湿度在温度之外也被考虑进去。但如果样品是氧或光敏感的,那对应的这些因素也需要考虑并作出相应地实验调整。
4. 4 数据评估
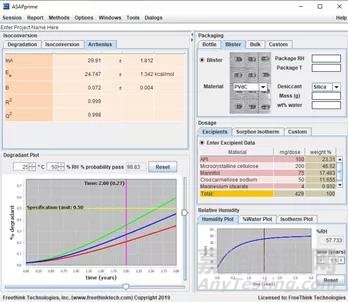
目前有可商用的软件ASAPprime。
图8 ASAPprimer工作界面
4.5 检查数据的拟合度
Garry Scrivens提出了两种不同的方法来验证ASAP预测的准确性,第一个是通过长期稳定性数据与ASAP的数据的比较,此方法不适用于研发阶段,但可用于审批后的变更。二是利用四种不同的ASAP条件对模型进行内部验证,这种方法更适合于开发过程。
图9 案例学习水解杂质A降解数据
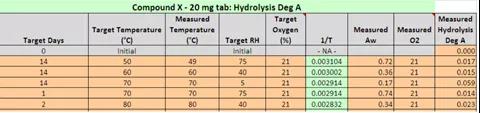
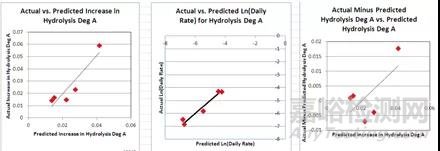
图10 软件预测数据和真实实验数据对比图
5 ASAP实验中的注意事项
5.1 熔点
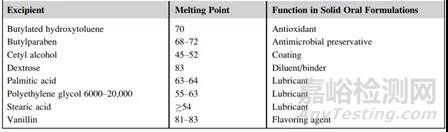
熔点是固体物质从固态变为液态或熔化时的温度。由于药物在固态和液态的化学降解机制或速率可能不同,在对固体原料药或制剂进行ASAP研究时,应通过收集原料药和辅料的熔点,并将ASAP研究温度设置在任何制剂成分的熔点以下。幸运的是,固体口服制剂的大多数原料药和辅料的熔点都远远高于ASAP测试的典型工作温度范围(50~80℃)。下表分别提供了一些可用于固体口服制剂的低熔点原料药和赋形剂的举例。
表2 低熔点API举例
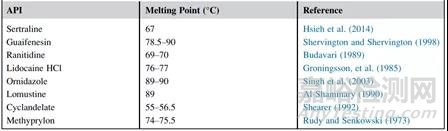
表3 低熔点赋性剂举例
5.2 潮解
潮解是吸湿性固体从环境中吸收水分,直至溶解或部分溶解于所吸收的水分而形成溶液的相变过程。潮解可导致固体药物的部分甚至全部溶解,其对固体药物化学稳定性的影响已被充分证明(Du and Hoag, 2001;Yoshioka et al., 1982; Yoshioka and Uchiyama, 1986; Hiatt et al., 2008)。因此,如果发生在APSP研究期间,潮解会对稳定性预测的准确性产生影响。易潮解的原料药通常是高水溶性结晶盐(如盐酸或钠盐)。如研究的样品可能存在潮解的情况,应提前通过吸湿/解吸等温线来确定临界相对湿度(CHR),在任何ASAP条件下的相对湿度应低于相应的CRH,以避免潜在的潮解。
表4 赋性剂潮解数据汇总

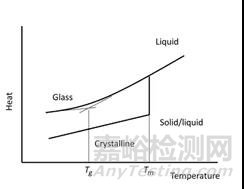
5. 非晶药物的玻璃化转变和结晶
对于非晶药物,玻璃化转变是一种可逆的非晶转变,物质由坚硬的玻璃状状态变为液体或橡胶状状态。液态比非晶固体的降解速率快得多。如果在ASAP研究中发生玻璃化转变,这种无定形药物的不稳定性可能被高估了。
图11 非晶药物的玻璃化转变和结晶示意图
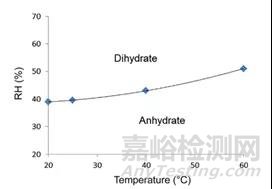
5.4 晶体药物的水和作用和脱水
水合脱水是结晶药物固体的常见物理现象。此现象于相对湿度和温度均相关(如图8所示)。因此应通过动态蒸汽吸附(DVS)来研究在等温、湿度递增的环境中进行吸附,脱附与再吸附、脱附。药物在水蒸气吸附脱附过程中经常会伴随着相变或者水合物的转变,根据DVS中的水分吸附等温曲线,确定ASAP储存条件的温度和相对湿度边界。
图12 药物在不同温度和湿度下水合情况示意图
6 ASAP局限性
首先,ASAP是为化学降解而设计的,而不是为硬度或崩解等物理变化而设计的,尽管有一个例子表明ASAP可以应用于预测溶解速率但一般物理性质变化并不适用于阿伦尼乌斯方程。
此外,ASAP不能应用于像蛋白质这样的大分子,因为这类分子结构的变化是存在可逆性,且结构变化也不是都影响其活性。
最后一点,目前稳定性预测可以通过软件完成,软件一般通过等转化点完成评估,该过程中会产生一些偏差。数据评估本身需要有多因素数据分析经验的专业稳定性专家。从监管的角度来看,ASAP目前只被认为是一种支持性工具。
7 总结
ASAP比传统的稳定性或包材筛选速度更快,准确率更高。能够将成本降低到传统稳定性研究的一小部分。它可以更快地让药物进入临床阶段,也可以减少的稳定性活动后批准的变更。与传统的加速研究相比,使用ASAP可以更直接地将开发项目的关键质量属性与长期稳定性影响联系起来。

来源:药事纵横


