您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-24 15:13
药代动力学(Drug metabolism and Pharmacokinetics)是定量研究药物在生物体内吸收、分布、排泄和代谢规律的一门学科,是新药设计和开发各个阶段的关键组成部分。本文主要介绍了在新药发现阶段DMPK高通量筛选方法,及分享各大制药企业的DMPK筛选评价策略。
新药研发失败分析
据Daniela Schuster和Christian Laggner统计(图1)[1],在1964-1985年期间,DMPK导致的失败接近40%。自20世纪80年代起,药代动力学研究受到跨国制药公司的高度重视,并越来越早的介入到药物设计、筛选和评价中。数据证明,这部分投资是值得的,在1992-2002年期间,临床Ⅰ、Ⅱ和Ⅲ期因DMPK导致终止的分别为14%、17%和4%(图2)[1]。Ismail Kola 和 John Landis的研究结果显示(图3)[2] 1991-2000年在新药开发阶段,因DMPK导致的失败率从近40%降低至10%左右。随着DMPK技术的发展和应用,在2008-2010年临床Ⅱ期因DMPK导致的失败率进一步降低至1%(图4)[3,4],而2011-2015年的数据显示临床Ⅱ期和Ⅲ期没有因DMPK导致的失败[5,6]。这些数据充分说明了DMPK在新药研发中的重要性,在早期进行DMPK研究可避免后期DMPK导致的失败,降低后期开发风险和费用。
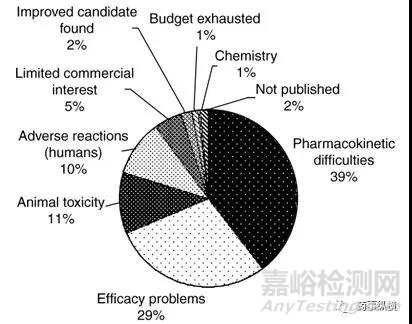
图1. 1964-1985年,新药研发失败的原因(n=198)
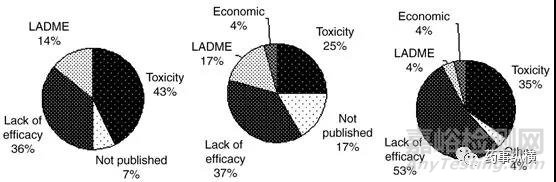
图2. 1992-2002年,药物在临床Ⅰ(左)、Ⅱ(中)、Ⅲ(右)终止开发的原因
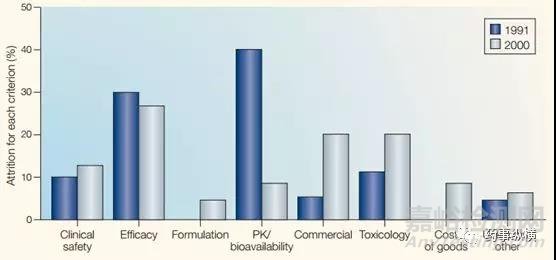
图3. 新药研发失败原因(1991–2000).
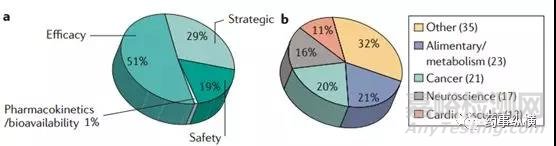
图4. 2008–2010临床II 期失败 (a) 失败原因(b)治疗领域
DMPK临床前研究目的
为了取得商业上的成功或者具有临床应用优势,一个理想的药物需有合适的给药剂量和给药方案,与其他药物合用不需要进行剂量调整。以口服药物为例,则是要求化合物高溶高渗,生物利用度高,有合适的半衰期,没有药物-药物相互作用。为了得到这样的候选化合物,在新药筛选和优化阶段就需要采用合适的DMPK筛选方法和评价策略,并达到两个目的:1)建立定量结构-性质相关性(QSPR),帮助化合物结构设计以优化DMPK性质。2)建立体内-体外相关性,以通过体外数据并结合药性和安全性预测临床情况。下面就重点介绍一下工业界常用的DMPK筛选和评价实验模型。
DMPK高通量筛选方法
体外代谢稳定性研究
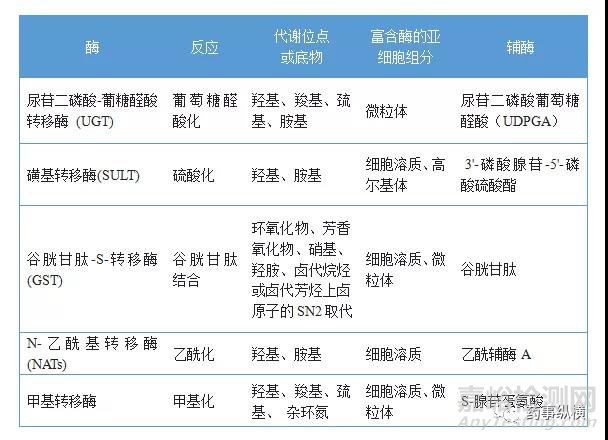
许多在体外显示高活性的化合物由于其不良的代谢特性,而在体内无效或由于反应性代谢物产生毒性而失去开发价值。因此,合理的药物设计应考虑到药物代谢途径及相关的药物代谢酶,发现先导化合物的代谢弱点,对其结构进行改造,以增加代谢稳定性或降低毒性。在新药发开阶段可以先用各种体外模型对化合物的代谢特性进行筛选,以确定其是否有继续开发的价值。常用的体外代谢研究模型主要有肝微粒体、S9、肝细胞、肝组织匀浆、各种重组酶、血浆、全血等。药物的代谢反应主要包括氧化、还原、水解及结合等,参与生物转化的主要代谢酶分别见表1和表2。在化合物筛选阶段,可根据化合物的结构特点及可能的代谢途径选择一种或两种代谢体系进行稳定性评价。由于CYP450酶参与了近70%药物的代谢,而CYP450主要分布于肝微粒体上,且肝微粒体相较于S9和肝细胞又比较经济并易于储存,故最常用肝微粒体+NADPH体系筛选化合物。当化合物结构式判断,所研究项目的化合物主要经非微粒体酶代谢时则需采用其他体外实验体系。譬如化合物含羧基,则化合物可能发生葡萄糖醛酸结合反应,而前期肝微粒体和肝细胞稳定性的结果表明该系列化合物确实主要发生葡萄糖醛酸化代谢,则可以选用肝微粒+ NADPH+UDPGA体系或肝细胞体系进行高通量筛选。又如筛选的化合物是前药,主要经酯酶代谢为原药,经确认化合物在PBS中稳定后,则需要考察化合物在血浆和肝微粒体中的稳定性,并测定原药的生成率。
化合物筛选阶段,进行代谢稳定性研究的目的就是1. 考察化合物代谢稳定性,将不稳定的化合物筛掉;2. 确定种属差异,药效模型种属(如大鼠)和人代谢均比较稳定的可考虑继续开发。如果化合物在人肝微粒体中稳定,在大鼠肝微粒体中很不稳定,那么该化合物的有效性可能因为在大鼠中暴露量不足而得不到验证,继续开发存在风险;如果化合物在大鼠肝微粒体中稳定,但在人肝微粒体中很不稳定,那么这种化合物很可能在大鼠疾病模型中展示较好的药效,继续开发在临床上可能因为人体暴露量不足而导致药效不足。3. 判断代谢软位点,对其进行结构改造;4. 建立体外清除率和体内清除率的相关性,确定相关性良好则可用体外代谢模型进行大量化合物的筛选,可加快筛选速度并可减少动物PK实验而节约费用。
表1. 药物的氧化、还原和水解酶
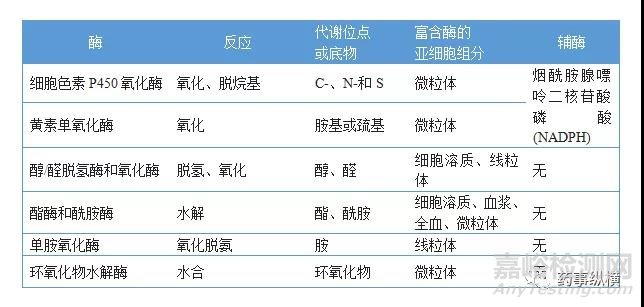
表2. 药物的结合代谢酶
小肠的吸收评价
目前常用于评价药物的渗透性和小肠吸收的有Caco-2细胞系和PAMPA人工膜。其中PAMPA是基于被动扩散方式的吸收评价模型,成本低、通量高。Caco-2细胞株是研究药物小肠吸收最常用的上皮细胞株,来源于人类结肠腺癌细胞,具有和小肠上皮相似的形态和功能,在标准培养条件下细胞能自动分化,紧密连接,表达多种刷状缘酶、一些P450同工酶及几种II相代谢酶,还表达多种转运体统,如糖类、氨基酸、二肽、胆酸及维生素B12等内源性因子的主动转运体。此外,Caco-2还表达小肠上存在的多种药物外排蛋白如P-糖蛋白、BCRP、MRP1等。Caco-2细胞株的分化程度极高,培养在支持物上,正常培养21天即可完成自动分化,分化后形成具有微绒毛以及紧密连接等类似于小肠上皮细胞刷状缘测的分化特征的单细胞层[8]。因此,Caco-2细胞株可用于研究药物结构-口服吸收分数的关系、预测化合物体内吸收程度、研究吸收的机制、P-糖蛋白底物的筛选等。尽管Caco-2细胞能较好地模拟药物的小肠吸收和转运,但也有一定的缺陷:⑴缺少肠壁的黏液层;⑵转运蛋白表达水平与正常小肠不一致;⑶代谢酶表达量与正常细胞有差别;⑷过紧的紧密连接。这些因素使得对于某些药物而言,采用Caco-2细胞所得到的数据与其口服后在体内吸收的相关性不理想。此外,由于不同实验室的Caco-2细胞来源和培养方法不同,以至于所得出结论可比度较低。即使是同一个实验室的细胞,也会因细胞传代次数、培养时间、培养介质的不同而变化。因此,实验采用在一定代数范围内的细胞及规范的细胞培养方法,对于获得数据的重现性是非常重要的,并且需要使用二三十种低、中、高不同渗透性的模型药物建立表观渗透系数Papp与吸收程度的相关性,然后才可用于测定未知化合物的渗透性。
CYP450酶抑制研究
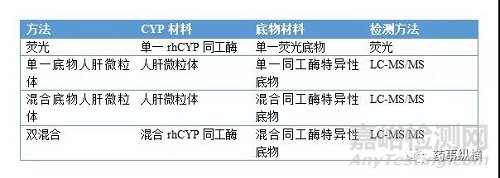
因药物-药物相互作用而导致的退市的例子有好几个(表3),主要是因为CYP450抑制而产生安全性问题。在临床开发中,如果药物可能存在相互作用的风险较大,也需要进一步开展临床试验评价药物的相互作用以确定临床应用是否需要进行剂量调整[9],这会增加临床成本,也可能导致药物上市后用药不便或使用受限。因此,在新药筛选和开发阶段评价药物相互作用的可能性是非常必要的,尤其是临床上很可能需合并用药的,如降糖药、降脂药、降压药等,更应尽可能避免产生药物相互作用。由于70%的代谢性相互作用是由酶抑制导致的,在化合物筛选阶段主要考察化合物对CYP450酶的抑制能力。其中CYP1A2、2C9、2C19、2D6和3A4/5参与了60%以上的药物代谢,故高通量筛选时主要评价化合物对CYP1A2、2C9、2C19、2D6和3A4/5的抑制作用。常用CYP抑制实验方法见表4。
表3. 药物相互作用导致退市的药物
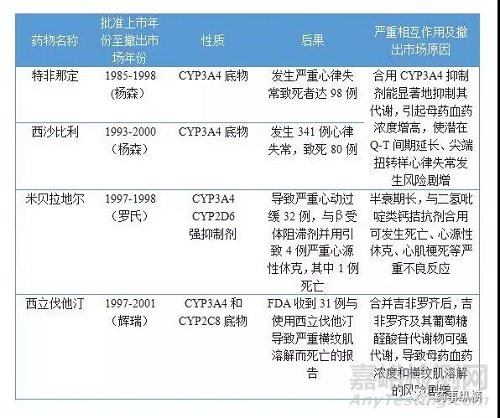
表4 CYP抑制试验方法
血浆蛋白结合率测定
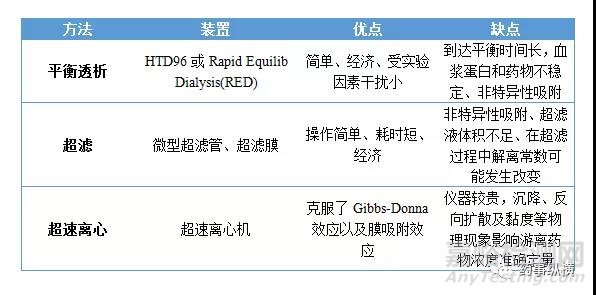
药物进入血液后,会与多种血液成分结合,如红细胞、白细胞、血小板以及血浆蛋白。只有游离型的药物才能透过生物膜进入到组织或靶器官,产生效应或进行代谢和排泄,而结合型的药物则起着类似储库的作用。由于药物在靶组织的游离浓度决定药效,且血浆蛋白结合对药物在体内的分布和清除都有影响,因此在化合物筛选阶段需要测定血浆蛋白结合率。广泛应用的体外血浆蛋白结合率测定方法有平衡透析法、超滤法和超速离心法,其中平衡透析法被认为是“金标准”。三种方法分别有各自的优缺点,详见表5。对于非特异性吸附较大的化合物,首选超速离心法;对于在血浆中不太稳定的化合物,首选超滤法;对于在血浆中不稳定而且还存在非特性吸附的化合物,目前没有特别有效的方法可以准确测定血浆蛋白结合率。
表5. 测定血浆蛋白结合率方法的比较
体内PK筛选方法
体外筛选模型具有速度快、成本低的特点,但是实验结果与体内真实情况存在相关性的问题,并且没有动物体内实验结果,在整个机体水平了解药物在体内的吸收、分布、代谢和排泄是不够的,因此开展体内PK研究也是十分必要的。与体外实验相比,体内药代动力学研究需要较长的时间和较大强度的工作量,其通量往往比较低。
目前,加快药物体内PK筛选速度主要从两个方面着手。首先是缩短当个生物样品定量分析的时间,提高分析通量;其次是针对现有动物实验方案进行合理简化,在能够得到有效信息的情况下,建立适用于筛选的动物实验模型,减少需要分析的生物样品数量。目前广泛使用的UPLC-MS/MS技术,通常分析一个生物样品的时间为2~4分钟,分析速度已经挺快了。为了进一步提高通量,目前常用盒式给药(Cassette dosing)方案,即将n个药物配置成混合的给药溶液再给予动物。这该方案的优势是:大大减少实验动物的用量和生物样品的数量,同时减轻了动物技术员和生物样品分析员的工作量,此外,在同一只动物身上得到不同化合物的PK性质,便于比较不同化合物的PK差异。这个方案的缺点是:需要找到合适的溶媒,保证这些化合物能够同时给药;其次是要建立多个化合物同时检测的分析方法,加大了分析方法开发和建立的难度;此外,药物-药物之间可能存在相互作用,从而影响实验结果的准确性,因此要降低每个化合物的给药剂量,并且引入已知PK性质的基准化合物作为阳性对照。在实际工作中,一般是将3~5个化合物低剂量混合给药,为了降低分析方法开发的难度,各个化合物之间平均分子量相差4 Da以上。
以上介绍的都是工业界在新药小分子筛选时广泛运用的一些实验方法,根据不同项目的特点,部分项目在前期筛选时还需进行转运体研究、酶诱导研究、代谢表型鉴定、脑渗透性评价等。篇幅所限,就不一一介绍了。
DMPK筛选策略
笔者认为在药代动力学研究中,难点不在于建立试验体系和开展、完成相应的实验工作,而在于根据不同的项目特点制定DMPK筛选策略,以及如何解释和应用数据。
SureshK等[9]报道了Millennium在先导化合物优化和候选化合物选择的体外体内ADME策略,见表6和图5。Gary W.等[10]报道了R.W.Johnson在新药发现早期和后期化合物优化的临床前研究范例。Peter Ballard等[11]报道了AstraZeneca在新药发现阶段整合的DMPK评价策略。Di Li等[12]阐述了Pfizer 在新药发现阶段CNS药物脑渗透性的评价及筛选策略。
通过研究这些DMPK评价策略可知,在新药发现阶段,最重要的就是建立体外-体内相关性,确定PK/PD关系,排除代谢物的安全性风险,推测人体PK、治疗剂量及安全窗。
表6. 不同阶段的ADME实验
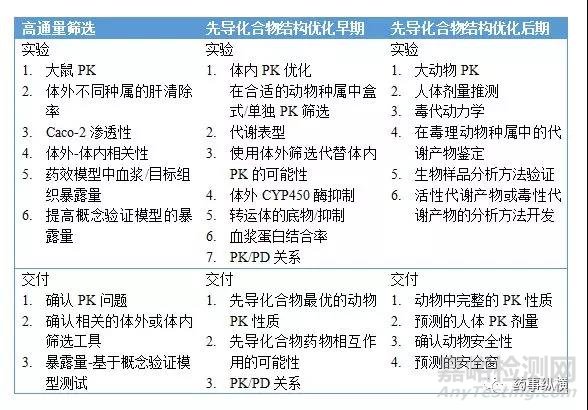
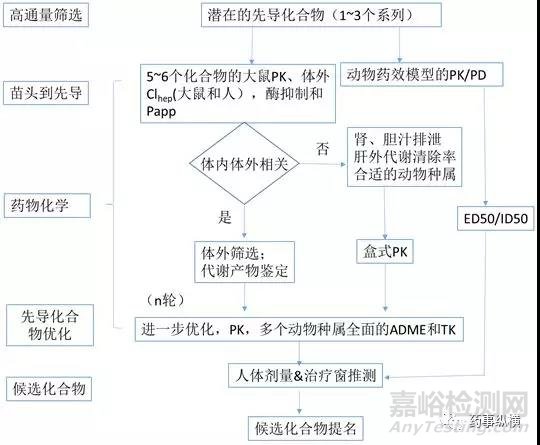
图5. 从苗头到先导及先导化合物优化的迭代途径

图6. 新药发现阶段的ADME筛选流程及主要实验
表7. 各轮DMPK测试的实验及预估化合物数量
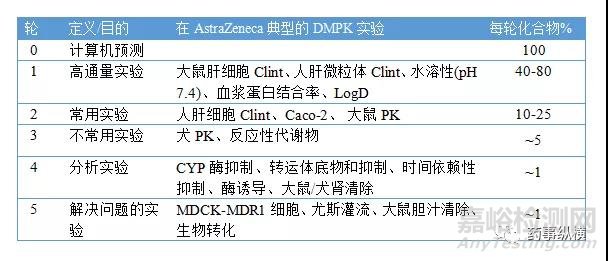
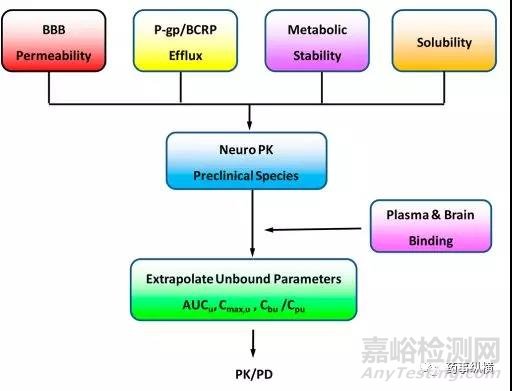
图7. CNS药物筛选流程
参考文献
[1]Daniela Schuster, Christian Laggner, Thierry Langer, Why drugsfail-a study on side effects in new chemical entities. Wiley‐VCH Verlag GmbH & Co. KGaA , 2008, 11 (27) :3545-59
[2] IsmailKola, John Landis,Can the pharmaceutical industry reduce attritionrates?Nature Reviews Drug Discovery, 2004, 3(8) :711-5.
[3] John Arrowsmith, Trial watch: Phase IIfailures: 2008–2010. Nature Reviews Drug Discovery 2011,10, 328–329.
[4] John Arrowsmith, Trial watch: phase III and submission failures: 2007-2010.Nature Reviews Drug Discovery2011 Feb; 10 (2):87.
[5] John Arrowsmith,Trial Watch: Phase II and Phase III attrition rates2011-2012. Nature Reviews DrugDiscovery, 2013, 12 (8):569.
[6] RK Harrison,Phase II and phase III failures: 2013-2015.Nature Reviews Drug Discovery, 2016, 15 (12):817.
[7] P Ballard,P Brassil,KH Bui etc.The rightcompound in the right assay at the right time: an integrated discovery DMPKstrategy.Drug Metabolism Reviews,15 Jun 2012, 44(3):224-252
[8] Edward H.Kerns, Li Di. Drug like Properties: Concepts, Structure Design and Methods fromADME to Toxicity Optimization
[9] Balani SK1, Miwa GT, Gan LS, etc. Strategy of utilizing in vitro and in vivo ADME tools for leadoptimization and drug candidate selection.Curr Top Med Chem. 2005;5(11):1033-8.
[10] CaldwellGW1, Ritchie DM, Masucci JA, etc. The new pre-preclinical paradigm: compoundoptimization in early and late phase drug discovery. Curr Top Med Chem. 2001Nov;1(5):353-66.
[11] Ballard P, Brassil P, Bui KH, etc. The right compound in the right assay at theright time: an integrated discovery DMPK strategy. Drug Metab Rev. 2012Aug;44(3):224-52.
[12] Di L, Rong H, Feng B. Demystifying Brain Penetration inCentral Nervous System Drug Discovery.J Med Chem. 2013 Jan10;56(1):2-12.

来源:Internet


