您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2021-11-23 15:00
前 言
原料药性质的多样化以及在新药开发过程中的渐进性,让制剂生产工艺的选择颇具挑战。笔者曾为读者介绍了生产分类系统(MCS),其期望根据不同原料药的理化性质科学合理地选择制剂的生产工艺。在其后续的工作中,制剂科学家们持续改善MCS,并基于MCS的相关概念对欧盟批准的上市药物进行了总结分析和数据挖掘。对制剂工艺关键影响因素——粒径和载药量等与工艺选择的关系进行了深入探讨。笔者特选取部分内容翻译,以飨读者。
本文选译自《Manufacturing classification system in the real world: factors influencing manufacturing process choices for filed commercial oral solid dosage formulations, case studies from industry and considerations for continuous processing》;
MCS介绍请参考药事纵横文章《基于原料药性质的口服固体制剂生产工艺路线选择》及其原文《A proposal for a drug product Manufacturing Classification System (MCS) for oral solid dosage forms》。
1. 数据收集方法
根据生产工艺分类系统(MCS)工作组的调查结果,影响口服固体制剂的可生产性的最重要的因素在于粒径,其次是载药量。为了在实践中将这些参数与商业化制剂的处方工艺开发相联系,作者收集整理了1996年至2017年之间发布的EPAR审评的报告(96份胶囊剂&339份片剂),试图找出这些基本的制剂参数(粒径及载药量)与工艺选择之间的联系。
为了便于分析,采用以下规则对药物分类:
l API被分为A类(小粒径的可能性更大)和B类(大粒径的可能性更大);
l BCS 1/3类药定义为A类,BCS2/4类定义为B类;
l 如果工艺中明确API需要微粉化,则无论BCS分类如何,API均定为B类;
l 规格范围被分为三个(载药量影响):低规格≤10mg;10mg<中等规格≤100mg;高规格>100mg;
l 对于多规格药物,以最大规格确定分类;
l 在审评报告中获取对工艺的判断
l 双层片被当成不同的处方
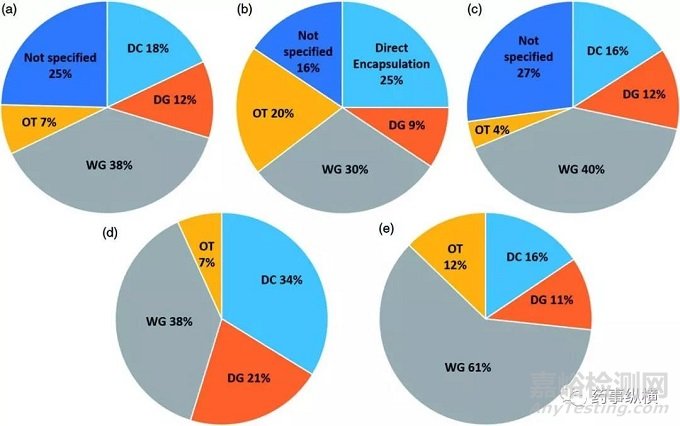
图1、工艺选择总结:(a)片剂和胶囊处方(n=435);(b)胶囊处方(n=96);(c)片剂处方(n=339);(d)片剂和胶囊处方(A类)(n=148);(e)胶囊和片剂处方(B类)(n=178)(DC:粉末直压;DG:干法制粒;WG:湿法制粒;OT其他;Not specified:未明确;Direct Encapsulation:粉末直接填充胶囊)
2. 结果和分析
从统计结果(图1)中可以看出,湿法制粒是最为常见的工艺,其次是粉末直压/粉末直接填充、干法制粒。从这些关键数据中可以得出如下结论:
l A类(n=148)和B类(n=178)API几乎各占一半;
l 对于胶囊剂而言,采用湿法制粒和粉末直接填充的工艺的处方几乎各占一半。与此同时,采用其他工艺的制剂数量也较大;
l 对于片剂而言,湿法制粒是最为流行的选择,比其他的工艺的总和还多。粉末直压工艺比干法制粒的工艺略多,采用其他工艺的片剂相对较少。
l 对于同一API,不同的公司通常采用同一生产工艺,但是确实存在例外,例如:
西地那非,DC(Teva),DG(Pfizer)和WG(其他一般公司)
阿立哌唑,通常采用湿法制粒,但是有一家公司采用粉末直压处方。
l 药物的BCS分类和最终工艺联系(如图1(d,e)):
对于A类化合物,更倾向于采用粉末直压/粉末直接填充和干法制粒;
对于B类化合物,更倾向于采用湿法制粒或者其他工艺。
l 给药剂量和最终工艺的联系(如图2):
对于高规格制剂(>100mg),A类化合物更倾向于选择粉末直压,而B类化合物更倾向于采用湿法制粒;
制剂规格越低,采用粉末直压工艺的制剂比例越高;
干法制粒更多用于A类化合物;
湿法制粒在所有的规范范围内均有采用,但是在高规格制剂中,采用湿法制粒的比例更高;中高规格的BCS 2/4类化合物更倾向于采用湿法制粒;若规格>100mg且为B类化合物,超过80%的制剂采用了湿法制粒。
在中高规格制剂中,B类化合物的数量大于A类化合物的数量,而在低规格制剂中,情况则相反。
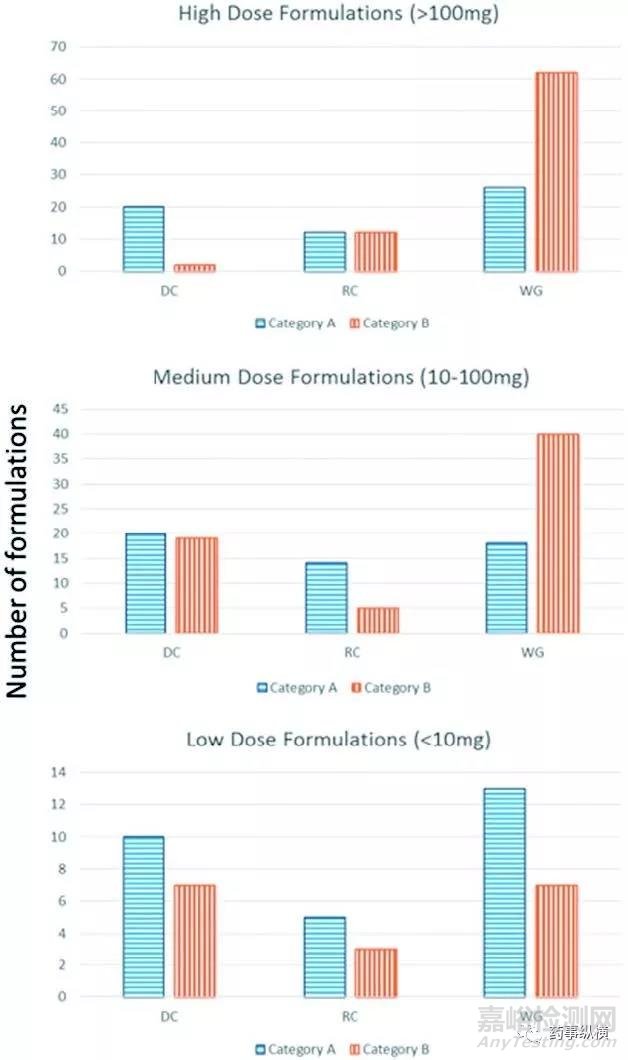
图2. 不同剂量高低的药物采用不同生产工艺(A是易溶性药物,B是难溶性药物)
3. 工艺选择的原因
在某些审评文件中,明确地提到了采用某种生产工艺的原因,总结如下:
采用粉末直接填充/粉末直压主要有两个原因:(1)工艺简单;(2)避免生产过程中的降解,更多地是为了避免水分;
采用干法制粒的原因也类似:(1)相对湿法制粒更为简单,节约时间和成本;(2)避免接触水分造成降解和晶型改变;(3)改善原料的流动性和可压性,进而改进含量均匀度。
选择湿法制粒的主要原因也是改善原料的不良性质:(1)改善粉体性质(流动性、堆密度、粘附性、静电和可压性差);(2)改善粒子性质(粒径、API变异性);(3)高剂量/高载药量经常被认为是选择湿法制粒的原因;(4)低载药量和保证含量均匀度也被认为是选择湿法制粒的依据。
选择以上3种工艺以外的其他工艺的原因比较多样化。采用液体悬浮液/溶液处方的胶囊制剂,是最为常见的采用其他生产工艺的制剂。在某些审评文件中,申请人给出了采用液体胶囊处方的原因。例如nintendanib,因为API与常规的辅料存在相容性问题,其处方采用了油性的填料混合物。Tafamidis采用液体悬浮液处方,这是因为API在常规处方中溶出时会凝胶化。在其他一些案例中,工艺的选择同时考虑了生物药剂学因素和生产问题。选择微丸技术的原因是这种技术可以调控药物在人体内的释放。而对于linaclotide,选择微丸的原因是API的相容性问题。dabigatran,在酸性水分中容易水解,因此工艺中应当避免水和酸性条件。对于aprepitant,选择了类似的处方以实现API在制剂中保持纳米尺寸,并在体内分散良好。挤出造粒技术可以认为是非压的湿法制粒,而不是真正的其他工艺。对于片剂,选择其他工艺的制剂并不常见。采用活性包衣的处方的原因可能各有不同:避免API在制剂中的降解;保证API在固体制剂中纳米尺度上的分散;改变药物的释放速率。两种分散片采用冻干技术。这并不是因为两种药物可能并非BCS 4类,其原因可能是采用这种新颖的技术可以实现期望的释放行为、或者服用的便利性(直接在嘴里溶解而非水中)。repaglinide和telmisartan采用了喷雾干燥制粒。但在审评文件中并未指出,采用这种工艺的原因是改善生产的便利性还是形成固体分散体以提高生物利用度。
4. 公司偏好
不同的公司有不同的工艺选择偏好。这反映出公司内部的已有的专业知识和文化。例如,
对于创新型公司,最为突出的是GlaxoSmithKline,它采用很多粉末直压制剂;Glead和Pfizer干法制粒的制剂数量最多,AztraZeneca和Roche也有很高比例的制剂采用了这种工艺;Boehringer Ingelheim,Bristol-Myers Squibb,Janssen和MSD采用湿法制粒的比例更大,而仿制药公司(KRKA, Teva,Actavis, Mylan)采用湿法制粒的比例也比较大。
5、公司案例分析
(1)GSK:渗滤阈值
API的粒径和载药量是工艺选择的关键参数。利用渗滤阈值的原理,可以更为精细地考虑原辅料粒径比的影响。直压处方对药物处方的载药量最为敏感。当载药量达到某个限度值(渗滤阈值),载药量的微小改变可能造成片剂关键性质的重大改变,例如硬度、崩解时间、溶出速率等。在药物控制释放模型中,材料的粒径影响得到了广泛研究,结果表明材料的粒径对渗滤阈值的影响最大。值得一提的是,并非是API的绝对平均粒径,而是API与辅料的粒径比对溶出速率的渗滤阈值影响最大。
许多制剂处方通过研究渗滤阈值确定其是否可以预测最大的载药量,从而确定更为稳健的工艺。这种方法是从GSK公司过去大约20年的处方报告中发掘出来的。在最初时,我们仅选择了粉末直压处方,因为制粒过程中有其他辅料加入,改变了API的粒径。有机的辅料和API的真实密度相似,都大约是1.5g/ml。采用体积粒径表示平均粒径。典型情况下,首要选择的处方是直压级别的微晶纤维素。处方中其他成分的占比非常小,通常小于3%,因此认为其不会对混合物的可压性有所贡献。通过测定压片失败(如顶裂或层裂)的最大载药量确定渗滤阈值。粒径比例的定义是API的平均粒径除以辅料的平均粒径。例如,API的粒径为250微米,辅料的粒径是100微米,那么粒径比是2.5。
研究了八个商业化制剂。其中一个处方没有渗滤阈值,这意味着即使载药量达到极高(95% w/w),可压性都没有变化。通过研究API本身的可压性数据可以得知API本身的可压性极好。因此,API的和辅料的成片性没有区别。这个特定的制剂的在研究的载药量范围内,压片性能没有变化,因此不存在渗滤阈值。
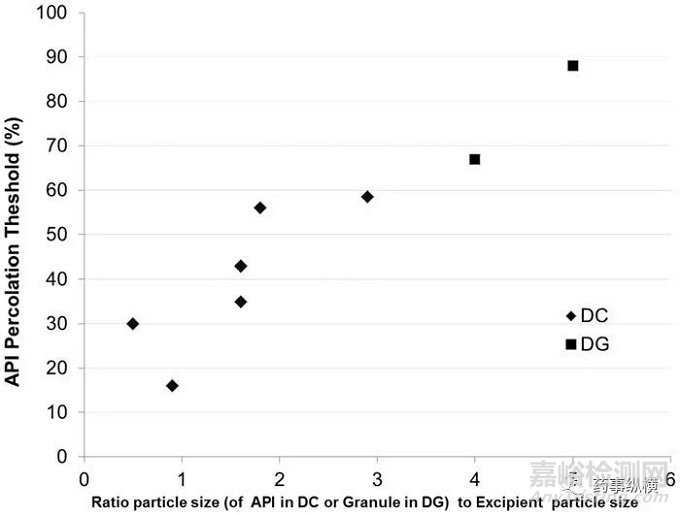
图3. 粒径比和载药量渗滤阈值的关系图
图3显示了在直压处方中粒径比与渗滤阈值的关系,渗滤阈值通过测定顶裂的方式获得。一般情况下,稳健的制剂处方中,载药量的限度是20%。但是图3显示直压处方的载药量限度可以高达59%。平均粒径比和渗滤阈值之间有清晰的联系,比例越大,载药量越高。其可能的解释与辅料中形成可压性的化学结构有关,例如微晶纤维素。当辅料的粒径一定时,API的粒径越大,辅料越容易在API的周围形成强的连接结构。粒径比例小的情况却正好相反,大量的粒径很小,可压性差的API粒子,可能会破坏辅料之间的连接。这个问题的关键点在于形成片剂估计并提供机械强度的材料。如果骨架是辅料,并且其比API有更好的机械性能,那么这种辅料形成骨架的片剂比API形成骨架的片剂机械性能更好。因此,当API的含量达到一定的水平后,辅料的量下降到不能再形成骨架,辅料粒子将被API隔开,进而由API形成骨架。如果API的可压性较差,这种API形成的骨架本身比辅料形成的骨架脆弱,进而导致了顶裂和层裂。
注意,当API和辅料的粒径接近时,默认的最低渗滤阈值大约是20%。因此,如果没有任何数据的分析而进行处方设计时,应当注意20%这一限度。
渗滤阈值的方法也被用来理解干法制粒产品中辅料外加和内加的机理。外加辅料通常用来提高可压性,例如微晶纤维素。通过数据挖掘,发现了两个产品。让人感兴趣的是,尽管通过API的辅料的粒径比推测最大的载药量大概在30% w/w,但通过干法制粒将API制粒增大粒径,最终片剂的载药量达到了大约70~90%。利用渗滤阈值的理论,这也是可以解释的。其关键在于形成片剂时干法制粒后的粒子和外加辅料的粒径比。
图3中展示了干法制粒的粒径比和渗滤阈值,其斜率与直压的产品几乎一致。这表明当这些处方的主要变化是平均粒径、粒径分布和表面性质时,平均粒径与渗滤阈值之间存在基本联系。这些处方已经进一步优化,用于商业化生产。根据这个结果,针状API在设计中可能存在问题。直压和干法制粒的处方的粒子形状应当是球形的,外加的辅料也应当是球形的,以形成连接结果。粒子的粒径越小,形成连接所需的粒子数目越小(形成连接结构的辅料的粒径应当越小)。这个概念的结果与对配位数和渗滤阈值的数学分析结果一致。
有人采用平台化湿法制粒技术生产湿法制粒产品,我们采用渗滤阈值技术对其进行了研究。所谓平台化湿法制粒技术,是指将API制粒形成粒子,再外加一定的辅料稀释获得特定API浓度,进一步压制成片。湿法制粒的粒子的载药量是40%,四个处方制剂的规格不同,但是尺寸一致,可以进一步用于临床编盲。
四个不同的处方用于研究同样的制粒API与不同的外加辅料的关系。外加辅料是最终混合物可压性的主要贡献者。经过对干法制粒的结果分析,我们已经清晰地认识到值得关注的是API制粒后所得粒子和辅料的粒径比。在这个例子中,制粒粒子和外加辅料的粒径比是1:1,根据图4的结果,渗滤阈值大约是30%。表1展示了外加辅料的比例与顶裂之间的关系,结果清晰地显示,当外加辅料的比例小于渗滤阈值时,出现了顶裂;外加辅料的比例大于渗滤阈值时,可以得到没有缺陷的片。
表1. 外加辅料量和顶裂的频率
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
在我们挖掘的这组数据中,不存在粒径比低于0.5情况。但是,当我们研究一种被同时被开发为干法和湿法制粒产品的无定型API时,发现当粒径比低于0.5时,可能存在潜在的相互作用,尤其是湿法制粒的情况。在湿法制粒处方中,API在制粒溶液中完全溶解,然后用于流化床制粒。在干法制粒的处方中,API与辅料的粒径比是0.5。根据图4的结果,理论推测渗滤阈值大约是20%。这两个案例中,API的载药量均是5%,低于预测的理论渗滤阈值之下。对两个处方的应力速率敏感性进行了研究(片的抗张强度随压片速率的增加的变化率)。结果表明直压处方对应力速率没有敏感性,但湿法制粒处方对应力速率的敏感性非常显著。可能是解释是,溶解后的API在粒子表面干燥成膜,API粒径接近于0,渗滤阈值则接近于0,因此在非常低的载药量时,也具有应力速率敏感性。
这次数据挖掘尽管获得化合物数量有限,但其结果显示,渗滤阈值确实是预测工艺路线敏感性的工具。除此之外,还有其他研究者提供了相关的证据。有研究表明,干法制粒的渗滤阈值为20%的结果只适用于API的粒径(D50)在50~165μm之间的强开。当API经过微粉化后(<10μm),渗滤阈值会小很多。以直压为例,微粉化的API的渗滤阈值大约是5%,并且需要高速剪切混合让API粘附在载体粒子(如微晶纤维素)的表面以实现定向混合。载药量大于5%,API之间的粘附力让其不太适用于干法制粒。
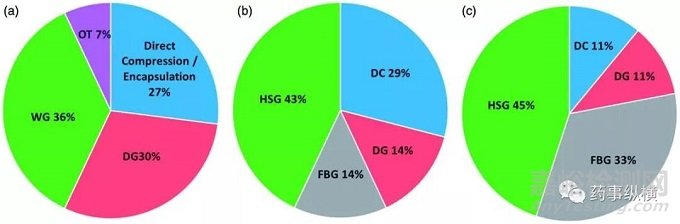
图4. 工艺路线的选择(a)BMS 的制剂(n=30),(b)Corden公司:早期处方开发(n=9);(c)Corden公司后期/商业化制剂开发;
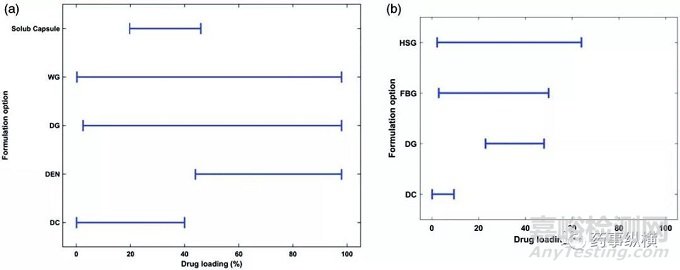
图5. 载药量与工艺选择(a)BMS和(b)Corden。(DEN:直接填充胶囊;HSG:高剪切湿法制粒;FBG:流化床湿法制粒)
(2)BMS
图4(a)中展示了BMS公司商业化的口服制剂的工艺选择。选择其他工艺和直压工艺的处方的比例与制药行业的整体水平基本相似。选择湿法制粒的比例略低于行业平均水平(37% vs. 49%),而干法制粒处方比例相对较高(30% vs. 17%)。在载药量方面,湿法制粒和干法制粒处方涵盖了所有载药量范围(图5(a));载药量高于40%的处方不用直压工艺;直接填充胶囊用于载药量较高的处方。
(3)Corden制药
Corden是一家CDMO。API的性质的测定以及工艺路线的选择通常是由客户确定的,并且通常不会分享给CDMO。另外,处理高活性化合物时,操作者的安全性、环境和病人是剂型和工艺选择时需要考虑的额外因素。尽管所有的生产工艺都是受控的,但是生产过程中容易扬尘的工艺或者容易导致扬尘风险的剂型对于高活性化合物来说都不好的选择。因此,薄膜包衣片相对于胶囊来说是更好的选择,因为其可以减小处理过程中破碎的风险。Corden公司在历史上,更喜欢采用湿法制粒,尤其是高剂量药物。这是因为采用制粒后的粒子压片可以减少压片和处理过程中暴露在高活性尘埃中的风险。湿法制粒过程中,粘合剂的加入,通常可以提高片强度,减小其碎脆度。
总体上而言,湿法制粒是最为常用的工艺,超过80%的早期开发阶段的化合物和超过半数的后期开发的化合物采用了这种工艺。湿法制粒的载药量范围可以从2%到64%。早期开发阶段选择湿法制粒工艺的原因主要是化合物的性质比较多变,这是早期开发中常见情况。而后期开发化合物选择湿法制粒的原因在于在所需的载药量下,API的理化性质选择直压工艺并不合适。当然,这里面可能还有对湿法制粒的历史性偏好,与载药量和API的性质无关,尤其是对于高活性化合物而言。
在湿法制粒工艺中,大部分制剂在开发的所有阶段都采用HSG。而FBG在处于早期开发的过程中的药物运用比较多,占湿法制粒的一半以上。这主要是该公司的历史原因,该公司早期仅有HSG设备。FBG可以生产多孔的颗粒,进而促进难溶性药物的释放。此外,低规格的制剂采用FBG更容易生产,因为API可以溶解在粘合剂溶液中,缓慢喷洒。这促进了药物在粒子中的均匀分布,进而提高了含量均匀度。
在药物的所有开发阶段,不采用湿法制粒的原因主要是稳定性。在这些不选择湿法制粒的药物中,低载药量的药物采用直压工艺,而中等载药量则采用干法制粒工艺。对于所有的直压工艺,载药量很低(<10%),符合上文中关于渗滤阈值的讨论。这些直压工艺通常采用几次混合和过筛步骤以实现处方中物料的定向混合,以此避免后续喂料和压片步骤中的离析。确定选择直压工艺通常是在后期开发的产品,此时API的性质一致性较好,因此生产问题的风险较小。此外,采用湿法制粒可以润湿难溶性药物,促进药物从制剂中溶出。
6. 结论
在过去,生产工艺选择的一般驱动因素是公司的传统偏好和可用的生产设备,而今期望采用一个更为系统的、以科学为驱动的产品开发方法,即根据溶解度、剂量、载药量以及化合物的开发阶段选择生产工艺。但是化合物的性质(粒径分布或其他)选择的合理性与化合物本身的需求和/或工艺的需求之间的联系并不是确定性的。当化合物的性质可以得到改进时,选择生产工艺在有的时候将更为复杂。目前,难溶性药物的比例越来越多,它们的临床剂量一般相当高,选择湿法制粒可以提供足够的溶解度和生物利用度。而采用一些赋能技术仅仅是针对极高剂量数(极为难溶)的药物所采取的手段。对于CDMO而言,工艺路线的选择是根据客户的需求,而并非基于科学合理的判断。但是,运用CDMO可以让制药公司获得更多选择不同生产工艺的机会,从而真正实现制造分类系统所描述的工艺多样化选择。

来源:Internet


