您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-15 11:26
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
鼻喷新冠疫苗国际Ⅲ期临床获批。万泰生物宣布其鼻喷流感病毒载体新冠疫苗的Ⅲ期临床试验已获得南非药监部门的批准。这是一项国际临床,将由泰格医药负责,计划在南非、印度尼西亚、菲律宾等11个国家评估针对18周岁及以上成人受试者的保护效力。在国内开展的I期、II期研究中,该疫苗已显示出可引发受试者的免疫应答,而且对新冠病毒原型株和突变株均具有很好的耐受性。
国内药讯
1.海创CD44v6抑制剂获批临床。海创药业1类新药HP558注射液(AM303)获国家药监局临床试验默示许可,拟开发用于治疗转移性食管鳞状细胞癌(ESCC)。AM303是德国amcure公司开发的一款“First-in-class”CD44v6抑制剂,海创拥有其在中国(含港澳台)开发和商业化权益。在I期临床中,HP558显示出良好的抗肿瘤活性、安全性和耐受性,在消化道肿瘤中具有潜在的治疗作用;并可与化疗或其他靶向药物联用,用于治疗多种晚期肿瘤。
2.渤健BDCA2单抗国内报IND。渤健BDCA2单抗BIIB059的临床试验申请获CDE受理。据悉,BIIB059是全球唯一一款进入临床阶段的BDCA2单抗,它通过抑制BDCA2,以减少I型干扰素等炎性细胞因子的产生,拟开发用于红斑狼疮的治疗。目前,BIIB059用于系统性红斑狼疮适应症已在美国进入III期临床,皮肤红斑狼疮适应症开发处于II期临床阶段。
3.GSK新型双靶点抗生素在华报IND。葛兰素史克新型抗生素Gepotidacin片的临床申请获CDE受理。Gepotidacin是一款具有新颖的“双靶向”作用机制的三氮杂苊烯类II型拓扑异构酶抑制剂,通过选择性地与两种关键的细菌酶——DNA回旋酶和拓扑异构酶IV (II型拓扑异构酶)相互作用而发挥疗效,而且对大多数现有抗生素(包括氟喹诺酮类抗生素)耐药的病原体具有活性。Gepotidacin目前正在临床中用于治疗非复杂性尿路感染。
4.人福医药终止RF-A089的临床试验。人福医药宣布将终止1类新药RF-A089胶囊的临床试验及后续研发。RF-A089是一款处于I期临床阶段的ALK抑制剂,拟用于治疗ALK阳性的局部晚期或转移性非小细胞肺癌。具统计,目前国内有五个同靶点药物已上市销售,全球有七个同靶点药物上市销售,同靶点药物2020年全球总销售额约为20亿美元。
5.贝达PD-L1抑制剂报IND。贝达药业1类新药BPI-371153的临床试验申请获CDE受理。BPI-371153是贝达自主研发并拥有全球权益的PD-L1小分子抑制剂。临床前研究显示,高剂量BPI-371153在体内抗肿瘤活性较PD-L1单抗更强,显著缩小了肿瘤体积。此次为该新药首次申报临床。除贝达之外,红日药业、再极医药、阿诺医药也已经申报了PD-L1小分子抑制剂,而复星医药则是申报了PD-L1/FGFR双靶点小分子抑制剂。
国际药讯
1.创新TCR疗法关键临床研究结果积极。Adaptimmune公司靶向MAGE-A4抗原的T细胞疗法afamitresgene autoleucel(afami-cel, ADP-A2M4),在治疗晚期滑膜肉瘤或黏液样/圆细胞脂肪肉瘤(MRCLS)的关键性Ⅱ期临床获积极结果。在47例可评估患者中,afami-cel达到34%的总缓解率,其中,滑膜肉瘤患者中的缓解率为36%,MRCLS患者中的缓解率为25%。疾病控制率为85%。中位缓解持续时间尚未达到,75%接受治疗的患者的缓解仍在持续中。
2.tau单抗治疗AD的Ⅱ期临床有戏。AC Immune和罗氏旗下基因泰克公司联合开发的tau单抗semorinemab治疗轻中度阿尔茨海默病(AD)的Ⅱ期临床最新结果积极。与安慰剂相比,semorinemab组患者经ADAS-Cog11评估的认知功能下降速度降低了42.2%(p=0.0008),而且semorinemab在所有亚组中对ADAS-Cog11的获益与总体队列一致。但试验的其他协同主要终点或次要终点上未观察到显著治疗效应。semorinemab总体耐受性良好,没有新的安全性信号出现。
3.恩格列净治疗心衰获优先审评资格。FDA授予礼来和勃林格殷格翰联合开发的SGLT2抑制剂恩格列净(empagliflozin)的补充新药申请(sNDA)优先审评资格,用于无需考虑心衰患者的左心室射血分数,以降低心血管死亡和住院风险。在一项Ⅲ期临床EMPEROR-Preserved中,empagliflozin使射血分数保留型心力衰竭(HFpEF)患者心血管死亡或因心力衰竭住院的相对风险降低21%,使患者首次和复发住院的相对风险降低27%,并显著减缓肾功能下降;而且总体安全性数据与既往结果一致。
4.Aβ抗体治疗AD的Ⅱ期临床有戏。卫材与渤健联合开发的Aβ抗体lecanemab治疗早期阿尔茨海默病(AD)的Ⅱ期临床扩展研究新数据积极。通过生物标志物、淀粉样蛋白PET、血浆Aβ 42/40 和p-tau181测量,lecanemab显示出改善疾病的潜力。其中PET测量数据显示出该药最快在三个月内降低大脑淀粉样蛋白水平;12-18个月内超过80%的患者发生淀粉样蛋白的显著清除。目前,两家公司向FDA滚动提交lecanemab的生物制品许可申请(BLA)。
5.莫格利珠单抗获英国NICE批准。英国国家卫生与临床优化研究所(NICE)批准协和麒麟莫格利珠单抗Poteligeo用于治疗接受过系统疗法的复发/难治性蕈样肉芽肿(MF)和塞扎里综合征(SS)成人患者。Poteligeo是首个获批上市的CCR4靶向生物制剂,已于2018年先后在美国和欧盟获批上市。在中国,Poteligeo的上市申请已于今年7月获得CDE受理。MF和SS是非霍奇金淋巴瘤(CTCL)的2种亚型。
6.首个口服PD-(L)1早期临床数据公布。Incyte公司在Journal for ImmunoTherapy of Cancer上报告其口服小分子PD-L1抑制剂INCB086550治疗晚期实体瘤经治患者的的I期临床试验(NCT03762447)最新数据。在68例可评估患者中ORR达到11.8%(95%CI,5.2%–21.9%;CR,1.5%;PR,10.3%),DCR为19.1%(95%CI,10.6%–30.5%);临床中,有46例(58.2%)患者出现与治疗相关的TEAE事件;10例(12.7%) 出现≥3级治疗相关TEAE。据悉,这是首个口服小分子PD-(L)1的人体试验数据。
医药热点
1.海南鼓励医师到基层开特色门诊。海南省卫健委、财政厅、人社厅、医保局四部门联合印发通知,鼓励支持全国二级、三级医院有专长的在职医师、退休医师、“候鸟医师”到海南基层医疗卫生机构(乡镇卫生院和社区卫生服务机构)开设特色门诊、科室。通知明确,允许特色门诊、科室财务独立核算;允许特色门诊、科室工作人员实行协议工资制。
2.灵北制药裁员300人。灵北首席财务官Anders Götzsche在周三第三季度财报电话会议上透露,灵北计划在美国市场解雇约100名员工,在日本市场解雇50名员工,总共裁员约300个职位,削减开支以推动其偏头痛新药CGRP抑制剂Vyepti的未来增长。目前,Vyepti已在美国获批;欧洲药品管理局预计在明年第一季度批准Vyepti上市。灵北计划在未来几年内为欧洲市场增聘约100至200名Vyepti销售代表。
3.美国前FDA局长再次出山。11月12日,美国总统拜登任命罗伯特·卡利夫(RobertCaliff)为新一届的FDA局长。拜登认为卡利夫是美国最有经验的临床专家,能帮助美国通过执掌FDA渡过新冠大流行的难关。卡利夫的任命同时也获得了美国两党的支持。当选后,卡利夫将需要面对新冠大流行、电子烟以及大麻泛滥等公共健康危机。在奥巴马时期,卡利夫曾担任过FDA局长。
评审动态
2. FDA新药获批情况(北美11月10日)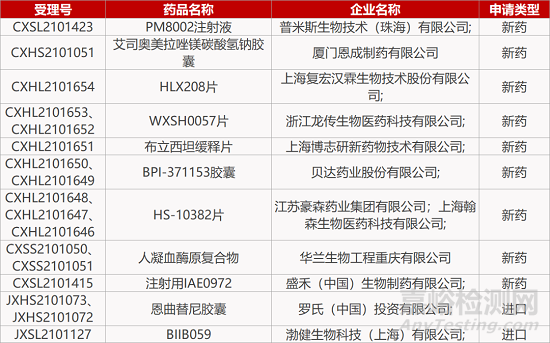
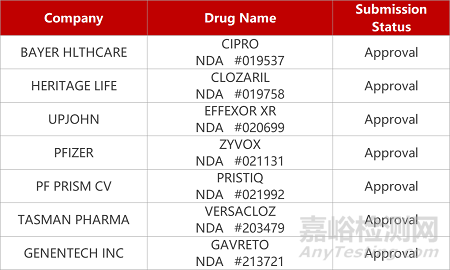

来源:药研发


