您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-09 22:00
三维( three-dimensional,3D) 打印,又称增材制造( addi- tive manufacturing,AM) ,是由打印机构按照预先设定的程序将耗材层层堆积、粘结成型,打印出特定形状结构的制造方式。3D 打印技术最初由 Sachs 等学者于 1992 年在麻省理工学院创立[1],逐渐应用于航空航天、汽车、工业机器、消费品、电子、军事、医疗及牙科等各行各业。随着 3D 打印技术的不断进步与发展,其应用也扩展到了医药行业[2],用于药品( 药物产品、植入物、药物递送系统等) 制造。相比于传统一刀切的给药方法,3D 打印技术在个性化药物产品的制造方面具有显著优势,更加符合精准医疗的概念模式。自美国食品药品监督管理局( Food and Drug Administration,FDA) 批准首个 3D打印速释制剂左乙拉西坦( SPRITAM ) 后,3D 打印技术在药物制剂领域的应用研究引起了研究者的广泛兴趣[3]。
ARAUTO 等[4]在 1996 年利用连续喷墨打印技术生产了第 1 批 3D 打印药物,开创了将 3D 打印技术用于药品制造的先河。多年来,许多不同类型的打印技术得到了发展[5-7],粉末粘结( powder bed) 、熔融沉积成型( fused deposition model-ling,FDM) 、微 量 调 节 注 射 ( pressure-assisted microsyringes, PAM) 、立体光刻( stereolithographic,SLA) 及选择性激光烧结( selective laser sintering,SLS) 等[8]打印技术已经用于药物制剂研发。在上述打印技术中,FDM 3D 打印技术显示出了低成本、可制备空心物体、可以使用一系列聚合物制备具有不同释药行为的药物制剂等优势,因此受到了研究者的格外关注。Azad 等[9]总结了近 5 年来关于 3D 打印技术在药物制剂领域的已发表文献,结果显示,应用于药物制剂领域的 3D打印技术主要为 FDM 3D 打印。FDM 3D 打印是利用热塑性长丝作为起始材料,在高于其熔融温度的连续层中挤出材料、层层粘结、创建 3D 对象,是目前 3D 打印技术中最常用的低成本技术[6]。因此,笔者以应用最为广泛的 FDM 3D 打印为核心,从工艺过程、所用聚合物及其在口服固体制剂领域应用研究、优势与挑战 4 个方面对该技术进行了综述。
1、 FDM 3D 打印的工艺过程
FDM 3D 打印的基本步骤( 图 1) 包括使用数字渲染软件( 如 AUTOCAD、3D MAX 等) 建模并转化为打印机可读的STL 文件、制备载药长丝、将长丝递入 FDM 3D 打印机进行目标制剂的打印,其中长丝制备和目标制剂的打印为 FDM 3D打印过程的关键步骤。
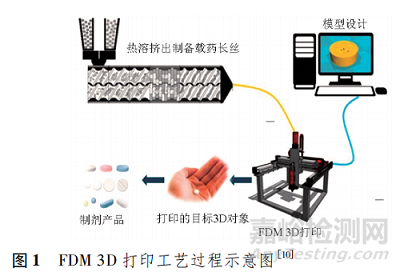
1. 1 载药长丝的制备
FDM 3D 打印所需的载药长丝的生产方式有两种: 一种是将市售空白长丝使用浸泡法载药后进行烘干等后处理工序[11],但是该方法受限于市售药用打印长丝的种类贫乏,且通过浸泡法制得的载药长丝载药量偏低; 另一种是联用热熔挤出( hot melt extrusion,HME) 技术,该方法扩大了药用材料的选择范围,且可通过改变投入挤出机中混合物的药物/辅料比例,调节载药长丝的含药量,因此,研究者多采用 HME技术制备载药长丝。
HME 技术产生于 1930 年,最早用于制造塑料和橡胶产品[10],在现代制药行业中,HME 已被应用于药物制剂和医疗植入产品的连续生产。HME 是一种连续地施加热量和压力来熔化或软化材料以生产形状、密度均匀的产品的过程,包括进料、加热、混合和成型等操作单元[12]。当物料在受控条件下被迫通过挤出机的模具时,挤出过程会改变其物理性质[13],从而得到理想状态的挤出物。因此,在 HME 机器的挤出口安装与 FDM 3D 打印机耗材直径相同的挤出模具,即可制备打印机适用的载药长丝,实现 HME 与 FDM 3D 打印的联用。
1. 2 目标制剂的打印
FDM 3D 打印设备价格低廉,易于操作,具有高打印精度和再现性[14],但目前还没有专用于制药的商业化 FDM 3D 打印机,药物制剂研究中使用的打印机均为工业级别,品牌包括 MakerBot( 美国) 、Multirap M420( 德国) 和 Prusa i3( 捷克) 等[4]。FDM 打印机的基本结构见图 2,其中,有些设备配有多个喷嘴,可同时加工 1 种以上的材料,从而制备出具有不同部分的、结构复杂的制剂产品。
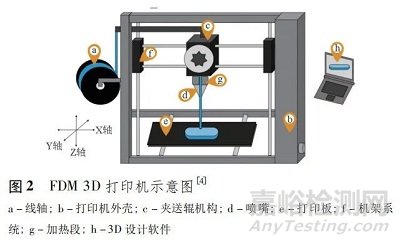
FDM 3D 打印具体过程如下: 夹送辊机构将装载于线轴中的载药长丝送至加热段,在高于其熔融温度的条件下熔化或软化,后方的固体长丝继续向前运动推动热塑性熔体通过喷嘴到达打印板或上一层打印对象表面,熔体沉积、冷却、固化的同时,机架系统按照 STL 文件中的指令将打印头沿着 X- Y 轴方向移动,打印好该层形状后,构建面或打印头在 Z 轴方向移动,继续打印下一层,直到程序结束,打印完成[15]。
2、 应用于 FDM 3D 打印的药用聚合物
使用 FDM 打印机制备药物产品时,选择合适的聚合物作为药物载体至关重要,不仅能避免长丝断裂、缠绕夹送辊机构及堵塞喷嘴等打印问题,还能达到控制剂型、尺寸和药物释放等目的。因此,FDM 3D 打印研究的首要任务是充分了解材料的可打印性能及其打印特性。目前已应用于 FDM 3D 打印的药用聚合物有 Eudragit 、乙基纤维素( EC) 、羟丙基纤维 素 ( HPC) 、羟 丙 甲 基 纤 维 素 ( HPMC) 、聚 己 内 酯( PCL) 、聚乳酸( PLA) 、聚乙烯醇( PVA) 、聚乙二醇( PEG) 及乙酸羟丙甲基纤维素琥珀酸酯( HPMCAS) 等。
2. 1 Eudragit
Eudragit 是德国赢创开发的一系列药用合成聚甲基丙烯酸甲酯中间产物,是不可生物降解、不可吸收、无毒的无定形聚合物。不同型号的 Eudragit 聚合物均具有热塑性、较低的玻璃化转变温度( glass transition temperature,Tg ) ( 9 ~ 150 ℃ ) 、较高的热稳定性以及与多种活性药物成分( active pharmaceutical ingredient,API) 和赋形剂的高混溶性。因此, Eudragit 系列聚合物适用于 FDM 3D 打印技术,不同型号的 Eudragit 因聚合物上官能团的差异而显示不同的药物释放特性。其中 E 系列具有 pH 依赖性,在胃液中( 低 pH 环 境) 可溶,已有多个研究将 Eudragit EPO 用于 FDM 3D 打印速释制剂的开发[16]。R 系列是非 pH 依赖性的不溶性聚合物,在胃肠道中膨胀释药,分为高渗透性的 RL 和低渗透性的 RS,可将二者按照一定比例混合使用,使制剂达到理想的释药速率[17]。
2. 2 EC
EC 是一种常见的水不溶性的热塑性药用聚合物,常被用作缓释载体,已有研究提出将其应用于 3D 打印药片[18]。由于 EC 熔点( 240 ~ 250 ℃ ) 较高,通常需要在处方中添加增塑剂或其他塑性高的聚合物来改善 HME 挤出长丝的可打印性能,才能用于 FDM 3D 打印[19]
2. 3 HPC
HPC 是一种由葡萄糖分子和多个羟丙基组成的水溶性聚合物,根据相对分子质量的不同分为不同的黏度等级,适用于不同的释药系统。由 于 HPC 具 有 很 低 的 Tg ( - 25 ~ 0 ℃ ) 、较高的热稳定性,因此在 HME 和 FDM 的高温熔融和挤出过程中能稳定存在。在 FDM 3D 打印中,低相对分子质量、低黏度的 HPC 可作为速释给药系统的载体[17],高相对分子质量、高黏度的 HPC 可作为缓控释给药系统的载体[20-21],另外,升高工艺温降低 HPC 的黏度,可以提高所载药物的释药速率。
2. 4 HPMC
HPMC 是可膨胀的水溶性聚合物,可 以 提 高 制 剂 中API 的缓释能力。但其具有较高的 Tg ( 170 ~ 198 ℃ ) ,在 HME 及 FDM 过 程 中,需使用较高的工艺温度。ZHANG 等[10]在处方中加入低 Tg的 HPC,制备了机械性能良好的载药长丝,成功打印了高缓释性能制剂。筛 选 相 容 性 良好的聚合物作为复合载体,可进一步扩大用于 FDM 3D 打印的聚合物范围。
2. 5 PCL
PCL 是一种半结晶聚酯,具有高有机溶剂溶解度、低水溶性、低生物降解性、较高的生物相容性,可用于制备长期植入装置系统[22]。PCL 通常与左旋聚乳酸、外消旋聚乳酸等混合或共聚合,改善聚合物的腐蚀,从而提高植入制剂的生物相容性[23]。PCL 熔点为 55 ~ 60 ℃,Tg为 - 54 ℃,具有较好的热力学打印性能,可用于热降解温度低的 API 的 FDM 3D 打印。
2. 6 PLA
PLA 是一种水不溶性的可生物降解的合成聚合物,因其具有高热塑性、高强度、无毒的显著优势,是目前最具有利用价值的生物可降解脂肪族聚酯。以 PLA 为载体的药物制剂中 API 释放主要受 API 的结晶度和材料的机械性能的影响。PLA 的断裂伸长率小于 10% ,为易碎材料[24],因此不适用于高应力水平下需要塑性形变的制剂。在不同型号的 PLA 中,左旋聚乳酸和外消旋聚乳酸以机械强度高、Tg 低的特征优势,具有广阔的 FDM 3D 打印应用前景。
2. 7 PVA
PVA 是一种生物相容的、可膨胀的水溶性合成热塑性聚合物,Tg为 85℃,熔点为 180 ~ 228 ℃ ( 部分水解-完全水解) ,黏度为 3. 4 ~ 52 MPa·s,被广泛应用于 FDM 3D 打印,PVA通常用于制备速释制剂[25-27],但通过结构设计也可用于制备缓释制剂,实现药物的缓控释[28]。
2. 8 PEG
PEG 是一种生物相容的两亲性聚合物,根据其相对分子质量的不同,小于 100 000 的聚合物通常称为 PEG,相对分子质量较大的聚合物则被称为聚氧乙烯( PEO) 。由于其机械强度 较 低,在 FDM 3D 打 印 中,通常与其他聚合物混合使用[29]。
2. 9 HPMCAS
HPMCAS 是 HPMC 的乙酸和琥珀酸混合酯,是近年来开发的一种肠溶包衣材料,也可用作微囊、微球等药物的缓释载体。Scoutaris 等[30]将 HPMCAS 和 PEG 600 混合均匀通过HME 制备载药长丝后,用 FDM 3D 打印机成功制备了吲哚美辛速释片,显示了 HPMCAS 在 FDM 3D 打印技术中的可应用性。
3、 FDM 3D 打印的个性化口服固体制剂
未来医疗方向可能是基于基因组学、蛋白质组学的个性化医疗,3D 打印技术的迅速发展为如何针对不同患者进行个体化给药提供了新思路[31]。迄今为止,FDM 3D 打印已经被利用开发了很多设计创新的、复杂的个性化口服固体递药系统,通过选用合适的聚合物载体、选择适宜的填充率,设计巧妙的几何结构,开发了速释制剂、控释制剂、迟释制剂、漂浮制剂和复方制剂等。
3. 1 速释制剂
由于 FDM 3D 打印技术工艺过程的高压缩和粘结性,所生产制剂的溶出速度通常远低于传统的粉末或颗粒片剂。因此,使用该技术制备能即时释药的速释制剂是有难度的,需要选用亲水性聚合物作为载体,必要时可通过加入增塑剂、降低填充率及在结构中引入空洞等加快药物释放。
3D 打印片所用的载体从根本上影响药物释放行为,通过选择高亲水性聚合物可以加快药物在胃液中的溶出,达到速释目的。Solanki 等[16]通过对比多种( 单元或复合) 聚合物与模型药物氟哌啶醇混合后制备的打印片的溶出结果,筛选出了 Kollidon VA64 和 AffinisolTM的 1∶ 1 混合物作为载体,打印了无定形速释片剂。FDM 3D 打印技术与 HME 技术的联用,可以将某些晶体药物无定形化,利于增强难溶性化合物( BCSⅡ类或Ⅳ类药物) 的溶出速率及程度,若能选择合适载体阻止无定形体系的老化,可制备稳定性良好的无定形固体分散体。
填充百分比是影响药物释放的另一个决定性因素。Kempin 等[32]筛选出以 PEG6000 和 PVP-K12 为载体组成的两种 10% 泮托拉唑钠( W/W) 速释片,可分别在 29 和 10 min内释药完全,通过降低 PVP 片的填充率到 50% ,增加片剂孔隙率,将药物总释放时间缩短到了 3 min 以内。且该研究使用的模型药物泮托拉唑钠为热敏性药物,所选聚合物在增塑剂的协助下能够于低于 100 ℃的工艺温度下制备打印片,开拓了低温 FDM 3D 打印热敏性药物制剂的应用。
此外,也可以改变制剂结构,进一步增加孔隙率,提高比表面积,促进药物释放。Gültekin 等[33]应用 FDM 3D 打印技术,以 Eudragit EPO 为载体,与 API 普拉克索混合后通过HME 挤出长丝,通入 FDM 打印机制备了具有空洞的速释片剂,使药物在 30 min 内释药超过 90% 。该研究通过引入空洞加快了药物释放,处方中未使用任何崩解剂。
3. 2 控释制剂
FDM 3D 打印中,通过打印复杂的形状,改变药片的可释药面的面积,从而控制剂量释放的强度以及时间,这有利于更加安全高效地管理药物释放行为。
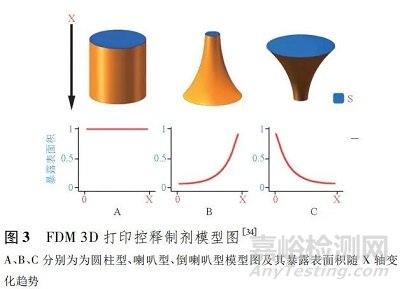
Xu 等[26]利用 FDM 3D 打印技术制备了 3 种结构( 圆筒型、喇叭型、倒喇叭型) 的 PVA 外壳,将载有模型药物对乙酰氨基酚的凝胶装入 PVA 壳中,制备出了 3 种控释制剂( 图 3) ,其中圆筒型片剂具有恒定的释药速度,喇叭型片剂的释药速度随时间延长而增大,倒喇叭型片剂释药速度随时间延长而减小。
Tagami 等[35]使用类似的方法制备了由含药和空白填料两部分组成的复合片剂( 图 4) ,其中以载有钙黄绿素的聚乙烯醇作为含药部分,分别以不含药的聚乙烯醇和聚乳酸 PLA作为水溶性和水不溶性空白填料部分,组成复合片。溶出结果显示,药物初始释放速率与药物组分的暴露表面积高度相关,释放曲线随含药组分的暴露表面积的变化而变化,从而设计制备了具有不同释药行为的复合片。这两项研究所开发的控释制剂在制备患者特异性的个性化制剂方面具有很好的应用潜力,为设计具有明确药物释放行为的个性化片剂提供了有价值的信息。

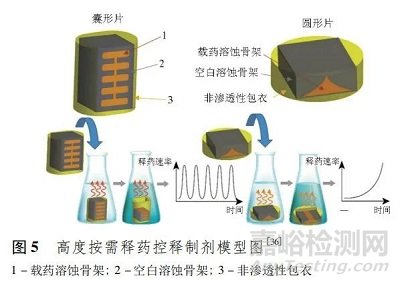
在此基础上,Tan 等[36]开发了一种通过 FDM 3D 打印技术制备高灵活性的控释药物递送系统的通用方法( 图 5) 。该系统包括 3 个组成部分: 载药溶蚀骨架、空白溶蚀骨架和非渗透性的可生物降解外壳。预计在溶出介质中,药物会随着载药溶蚀骨架暴露面积的改变而实现控制释放。并通过多种模型药物( 单药物、多药物) 验证了该系统溶出结果与预计情况高度一致,初步确证了使用 FDM 3D 打印制备患者定制的控释制剂的可操作性。
3. 3 迟释制剂
口服迟释制剂可以使得药物在胃肠道定位释放,避免其在胃肠生理环境下的失活,改善药物吸收,也可以用于治疗胃肠道局部疾病,提高疗效,降低毒副作用。传统口服迟释制剂分为时滞型、pH 依赖型、酶解型和压力控制型,存在处方复杂、工艺繁琐的劣势,而 FDM 3D 打印可以通过组合不溶性、可溶性材料,以及结构设计达到延迟药物释放的效果。
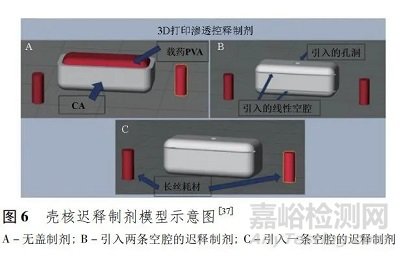
GIOUMOUXOUZIS 等[37]利用双头 FDM 3D 打印技术开发了包括渗透核心( 载有地尔硫 的 PVA) 和一层半透性醋酸纤维素( cellulose acetate,CA) 外壳的 3 种制剂( 图 6) ,第 1种制剂的外壳上部被完全去除,而在第 2 种和第 3 种制剂外壳分别引入了 2 个和 1 个线型空腔。为了便于水的渗透,在上下壳壁开孔,制剂进入体内可以吸水导致空腔处的核心膨胀、外壳破裂,从而达到地尔硫 从制剂中延迟释放的效果, 3 种制剂的迟释时间分别为 0、6 和 2 h。由于药物在胃肠道内运动时间受食物影响较大,采用单一的时滞原理进行定位释药可靠性较低。因此,同时考虑使用 pH 敏感材料或对肠道有黏附性的材料进行 FDM 打印可取得更稳定的定位释放效果。
3. 4 胃漂浮制剂
胃漂浮制剂是研究广泛的胃滞留制剂,能在不影响胃肠道正常生理活动的前提下,延长药物递送系统在胃中的滞留时间,增大在胃肠道上端吸收良好的药物的生物利用度。应 用 FDM 3D 打印技术可以设计利于漂浮的结构,制备出有良好漂浮能力的胃漂浮制剂。与传统的工艺方法相比,FDM 3D 打印技术制备控释胃漂浮制剂工艺简单、可适用于多种API。
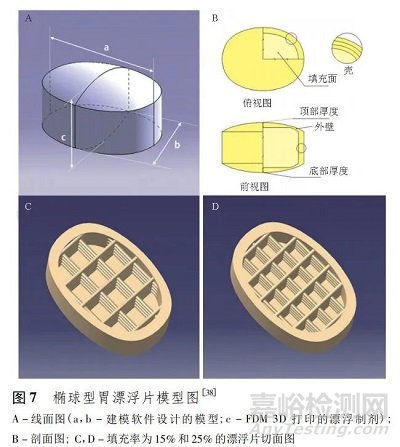
FDM 3D 打印制备漂浮片的方便之处在于,可直接降低内部材料填充率,便达到漂浮效果。Chen 等[38]以盐酸普萘洛尔为模型药物,以 PVA 为药物载体,通过 FDM 3D 打印技术制备出了填充率为 15% 和 25% 的椭球型胃漂浮片( 图 7) ,2 种填充率的漂浮片均能在人工胃液中漂浮、无迟滞时间并能持续释放,其中高填充率的漂浮片有片重差异小、片剂硬度高、释药时间长的优点。
Shin 等[39]应用 FDM 3D 打印技术制备了胃漂浮缓释系统( 图 8) ,且评价了该系统在比格犬体内的药动学特征。该系统由胃漂浮装置和传统的阿昔洛韦缓释片组成。漂浮装置是该研究的关键,是用不溶性的聚合物 PLA 打印的包括左右两端封闭的气室和中央空隙的释药窗的特殊结构,封闭气室使得整体密度降低得以在介质中漂浮,释药窗的尺寸调节可以改变释药速度。X 射线图像显示,所开发的胃漂浮制剂在比格犬胃内滞留时间超过 12 h,该研究所开发的胃漂浮装置可以应用于多种药物,在新型胃漂浮制剂的设计和开发中具有广阔的应用前景,但后续研究需要考虑不溶性漂浮装置在排出体外前是否累积或造成人体负担。

Lamichhane 等[40]以 HPMCAS、PEG 400 作为载体,以普瑞巴林为 API 制备了底部封闭顶部开放的漂浮结构( 图 9) ,溶出结果表明,该系统漂浮行为良好且可零级释药。

Kimura 等[21]也设计了类似的中空结构,以 HPC 和 PVP为聚合物,以水溶性差的弱碱性伊曲康唑为模型药物,制备了具有不同外壳厚度的片剂( 图 10) ,随着片剂外壳厚度的增加,药物释放时间延迟,漂浮时间延长,当上下壳厚度为0. 5 mm、侧壁厚度为 1. 5 mm 时,片剂漂浮时间延长至 10 h,在 12 h 内显示出接近零级的药物释放行为。

3. 5 复方制剂
由于 FDM 3D 打印能够进行精确灵活的空间分布,在复方制剂制备中也得到了广泛的研究。近年来通过 FDM 3D打印技术开发的复方口服固体药物递送系统,可以使所递送的多个 API 在体外共同稳定存在,在患者体内发挥协同作用,增效减毒,减少患者服药频次,改善患者依从性,特别适用于患有复杂疾病( 癌症、心血管疾病等) 、需每日服用多种药物的患者。
Gioumouxouzis 等[41]应用双头 FDM 3D 打印技术制备了包含二甲双胍和格列美脲 2 种抗糖尿病 API 的双层片剂( 图 11) 。研究中,他们将二甲双胍和 Eudragit RL 混合作为缓释系统,将格列美脲与 PVA 混合作为速释系统,制备了速缓释双层片。该研究制备的双层片同时含有 2 种 API,体现了应用 FDM 3D 打印技术制备具有不同释药模式的复方制剂的潜力。

Pereira 等[42]开发了用于治疗心血管疾病的复方制剂, 以 PVA 为载体制备了含有 4 种模型药物( 赖诺普利、吲达帕胺、瑞舒伐他汀钙和苯磺酸氨氯地平) 的 4 层 3D 打印片,每种药物的释放顺序取决于其在多层片中的位置。这种多层片的开发开辟了一条低成本多药输送系统的新道路,可广泛应用于片剂、支架、植入物等给药系统。
Genina 等[43]设计了用于治疗结核病的双室制剂,分别装载内在不兼容的异烟肼 ( isoniazide,ISO) 和 利 福 平( rifampicin,RIF) ( 图 12) ,在物理层面上隔离了 2 种 API,并延迟了 ISO 的释放,防止 2 者同时在胃部释放所导致的RIF 不稳定,使联合用药的药效最大化。该研究为存在负相互作用的 API 的联合用药制剂开发提供了思路。此 外,该研究中双室概念也可用于针对胃肠道不同区域的靶向给药。

3. 6 其他制剂
除了上述的个性化口服固体制剂外,周永恒等[44] 采用FDM 3D 打印技术制备了小儿常用规格( 0. 041、0. 070 mg) 的地高辛分剂量片。研究中其先测定打印材料的密度,后根据分散片的剂量和挤出长丝中含药量,推算出打印片体积,选择合适的片高度和半径建立模型,从而制备出对应理想规格的分剂量片。临床中对于治疗窗狭窄的药物,需要精确给药剂量以确保治疗效果和患者安全。由于 FDM 3D 打印的模型尺寸设计的高度灵活性,可通过调节药片体积制备一系列不同规格的分剂量片,适用于特殊患者尤其是儿童分剂量用药[45]。
国内外的众多研究展示了 3D 打印用于药物制剂领域的革命性潜力,但仍需进一步的研究( 如体内研究) 来推动该技术从学术概念转向临床应用。
4、 FDM 3D 打印的优势与挑战
近年来,FDM 3D 打印技术在口服固体制剂的开发取得了较多进展,其灵活性、多功能性及低成本等潜力都颠覆了传统制剂制造技术,但其显著优势的另一面,是该技术真正意义上应用于个性化医疗所必须面临的挑战。
4. 1 优势
与传统制剂技术相比,FDM 3D 打印技术在工艺过程、临床应用、打印规模方面具有如下显著优势: ①在工艺过程方面,FDM 3D 打印技术不仅可以避开传统工艺中混合、制粒、压片、包衣等冗杂过程,实现一步成型连续化生产,还能基于患者需要改变剂量、成分或释药行为,制备患者定制制剂,实现个体化给药; ②在临床应用方面,医生或药剂师可以使用计算机软件和网络进行远程控制,基于患者需求即时打印药物,使制剂的生产离患者更近,实现真正意义上的个性化医疗; ③在打印规模方面,FDM 3D 打印机为小型台式设备,可以根据医师处方制备特定少量药品,且所需生产空间较小,成本低,有利于精准医疗方案的推广和普及。
4. 2 挑战
尽管 FDM 3D 打印技术在个性化医疗方面有很大的发展前景,但该技术的广泛临床应用还需要克服一些技术和法规方面的障碍。
FDM 3D 打印技术依赖于高温熔融的载药耗材递送至喷嘴并随着喷嘴机构有序运动,熔融耗材存在着堵塞喷嘴的风险,影响打印的连续过程[3]。另外,高温可能导致产品的外观( 颜色、表面状态) 改变,甚至导致载体或 API 降解,不适用于热敏性药物。FDM 3D 打印技术需要联合 HME 技术,制备载药长丝,前处理过程较为复杂,且目前适用于 FDM 3D 打印的药用聚合物种类有限。
目前的监管机构和现行法律的框架不允许 FDM 3D 打印技术的推行,在 3D 打印药品开发和制造推广前,需要解决监管机构采取何种途径监管这种非传统制药设备的严肃问题,需要发布一系列的指导文件,甚至修改传统法律法规。尽管存在着监管障碍,但 2015 年 FDA 批准上市的 Spritam 为 3D 打印在制剂领域的技术落地迎来曙光。
5、 小结与展望
笔者以在药物制剂领域应用最广泛的 3D 打印技术———FDM 3D 打印为核心,系统地介绍了 FDM 3D 打印技术的工艺过程、可用的药用聚合物、近年来利用该技术开发的口服固体给药系统及其相对于传统制剂技术的优势和所面临的挑战,较为全面地介绍了 FDM 3D 打印技术在口服固体制剂领域的应用与研究进展。
虽然近年来 FDM 3D 打印技术发展日新月异,但该打印技术仍处于为实现智能医疗、个性化医疗积蓄力量的发展阶段。这一技术的成功落地,需要符合 GMP 标准的商用制药打印机的开发,为医疗点制剂的规模化打印作准备; 也需要法律框架的更新和监管机构的支持,避免非法分子利用 FDM 打印机的灵活性篡改、掺假剂量,欺骗患者。需要注意的是,虽然 3D 打印是一种通用技术,可以合并许多不同种类的药物活性成分,但药物和辅料的相容性必须建立在个案 基 础 上,以实现配方的安全性、有 效 性、稳 定 性。FDA 于 2016 年成立了一个由制药专家组成的新兴技术团队( emerging technology team,ETT) ,以支持和促进包括 3D打印在内的新兴制造技术的监管评估[46],助力开发复杂剂型和创新制造方法。随着 FDM 3D 打印技术的不断突破和质量监管方面的不断完善,相信在不久的将来,能够形成安全稳定、低成本、高效率的药物制剂打印平台,为开辟数字医疗新时代作贡献。

来源:中国药学杂志


