您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-10-22 21:18
本文是业界第一篇全面介绍药械组合产品及其技术审评和监管科学的综述文章。首先介绍了组合产品的起源、定义和界定。作为典型的跨学科产品,组合产品复杂多样,技术难度不断上升,监管部门面临着挑战和机遇。其次,以器械作用为主的组合产品为切入点,重点介绍了组合产品技术审评的关注点。最后,展望了对于组合产品监管科学研究中,可用来评价产品安全有效的新工具、新技术、新方法、新标准和新路径。
01、研究内容简介
1 药械组合产品
目前,已上市的常见药械组合产品包括药物洗脱支架、含抗生素骨水泥和含抗菌成分的伤口敷料等(图1)。此外,还有组织工程医疗产品、生物人工肝和含芯片智能药片等新型组合产品。这些基于技术创新的组合产品具有其治疗优势。
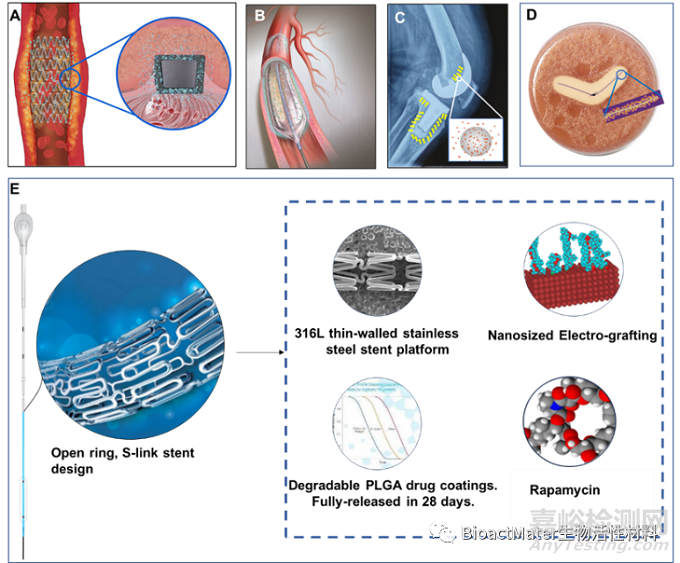
图1. 组合产品的代表图。A.药物洗脱支架。B.药物球囊导管。C.抗生素骨水泥。D.含有抗菌成分缝线及其抑菌圈。E.颅内药物洗脱支架系统。图片由厂商提供。
2 起源、定义和界定
组合产品的定义起源于20世纪70年代,这类组合产品具有独特的效果,但其使用也可能带来新增的风险。在医疗器械中添加药物或生物制品成分,可能宣称新的预期用途和/或产生不同于医疗器械的技术特性,引起新的安全性和有效性问题。为了对组合产品进行科学监管,应首先理解组合产品的定义和界定。组合产品的定义和监管方式在不同国家/地区存在差异。我国药械组合产品属性界定流程见图2。我国药械组合产品的定义是“指由药品与医疗器械共同组成,并作为一个单一实体生产的医疗产品” 。
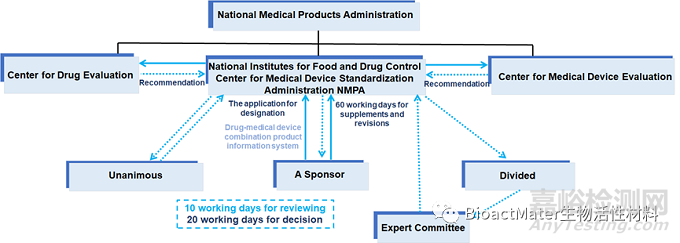
图2. 中国药械组合产品属性界定流程
3 技术审评
技术审评的核心问题是如何评价产品的安全性和有效性。本文以器械作用为主的药械组合产品(又称“药械组合医疗器械”)为例,介绍组合产品安全有效性的技术评价关注点。
3.1 一般考虑
组合产品审评的核心是新增风险的识别和终产品的整体风险受益评估。组合产品中的药品部分和/或器械部分若已分别单独获得批准,单独获批的组成部分,已经评价过的风险,可作为支持资料进一步佐证组合产品的安全性有效性。若相对于单独获得批准的组成部分来说,组合产品有了新的作用机理、适用范围、目标人群和使用方法等,则需要通过相应的科学证据进行评估。
3.2 立题依据和主要作用方式(PMOA)
对于组合产品,需要充分分析和论证采用药品和器械进行组合的合理性和必要性。组合产品的PMOA指预期能够为组合产品的总体预期治疗效果做出最大贡献的作用方式。对于组合产品,有必要研究其PMOA是以药物部分还是器械部分的作用为主。
3.3 临床前评估/评估
3.3.1 组合产品不同组成部分的相互作用
需首先考虑组合产品不同组成部分的相互作用。在器械中添加药物可能会改变原来的产品生产工艺、储存条件、适用范围、禁忌症、注意事项等。药物加载过程可能会影响终产品的机械性能、表面特性等。当器械作为药物载体时,其加工助剂、工艺或储存条件可能对药物活性、药物释放、终产品质量产生影响。
3.3.2 组合产品中药物的定性、定量和体外释放
需研究组合产品中的药物含量/剂量的确定依据。如果药物含量参考类似的组合产品,则需研究自身与同类组合产品设计差异可能带来的影响,结构设计、载体材料和载体材料配方可改变药物的释放率。对于通过将药物释放到预期部位(如采用缓释、控释或其他释放方式)而发挥效用的产品,如药物洗脱支架、药物球囊导管、含银敷料等,需进行药物释放研究。体外释放研究还可评估产品的稳定性、涂层牢固度等。
3.3.3 生物学评价
对于组合产品,终产品的生物学评价可以参考ISO 10993系列标准。药物可能会影响生物学试验的结果。需要结合药物的作用方式、临床获益论证药物引入的生物学风险是否可接受。
3.3.4 动物试验
根据组合产品的技术特点,设计合理的动物试验方案,动物试验研究主要包括体内药物释放动力学、体内药代动力学研究等。如药物洗脱支架的动物试验可研究产品的系统毒性、局部毒性、药物剂量筛选、配方和涂层等。
3.4 临床评估
在进行组合产品的临床评价前,需明确并充分考虑其作用机理、预期作用、潜在风险、可能出现的不良事件等。遵循《医疗器械临床试验质量管理规范》等相关要求,开展组合产品的临床评价。可结合组合产品的风险和受益,选择合理的临床评价路径,论证其临床应用的安全有效性。
对组合产品的监管目标是科学、全面地评价和确保组合产品的安全性和有效性。组合产品的审评是复杂、科学合理、系统化、多步骤、多层次的评估。因此,需要开展组合产品监管科学的深入研究。
4 组合产品的监管科学
4.1新工具和技术
医疗器械中使用的计算模型和仿真(CM&S)是将计算建模科学和仿真技术应用于医疗器械的评价。例如,CM&S 成功地用于三维模拟在冠状动脉中药物洗脱支架有重叠时的药物沉积(见图 3)
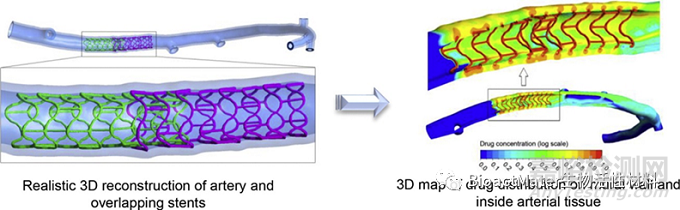
图3. CM&S 成功地用于研究在冠状动脉中药物洗脱支架有重叠时的药物沉积. Reprinted with the permission from 2016 Elsevier. (Journal of controlled release 238 (2016) 1-9)
人工智能(AI)是一种潜在的工具,从真实世界中大量使用的数据。AI/ML可参与产品研发的整个生命周期(如图4),如设计、药物筛查、物理化学性质/生物活性/毒性的预测、质量管理、临床评价等。
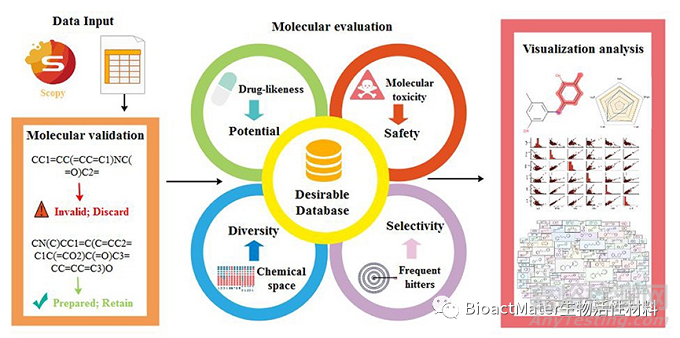
图4. AI为基础的药物预测软件平台。Reprinted with the permission from 2020, Oxford University Press. (Briefings in bioinformatics 22(3) (2021))
器官芯片是采用人细胞,用微芯片方法制造的微流体装置。器官芯片可以通过在微小的流体通道中繁殖血液和/气流来准确模拟人体的生理和机械环境。芯片上的器官可以模拟人体器官的多细胞结构、血管灌注、组织-组织界面和物理化学微环境(如图5)。
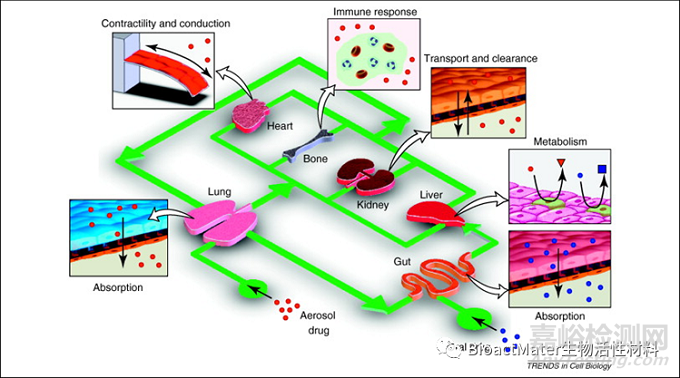
图5. 器官芯片可用于 ADMET 测试、PK/PD 建模、功效测试和药物发现。Reprinted with the permission from 2011, Elsevier. (Trends Cell Biol 21(12) (2011) 745-54.)
计算机模拟与仿真(CM&S)、人工智能(AI/ML)和器官芯片等是用于组合产品的研究开发以及安全有效性评估的新工具和新技术。新的工具和技术有其独特的优势,可促进新产品更安全、更快地进入市场。随着计算机科学、工程和生物研究的进步,这些新工具和新技术可能会逐渐发展成为医疗产品临床前测试和评估的新平台。
4.2新标准
现有的医疗器械相关标准在产品测试、性能特性开发、测试方法等方面,可能并不完全适用于组合产品。组合产品相关标准制定,可以进一步加快该类产品的开发,为各种科学方法的融合提供一个平台,以促进对组合产品的评价。
4.3新方法
通过对药械组合产品的循证研究,可对药械组合产品的效果和证据质量进行评价,可为确定终产品的药物选择、剂量确定等提供科学依据。已有报道将循证研究用于评估新材料及其医疗器械产品的安全、有效、质量及性能,最大程度获得产品安全性和有效性的支持证据,为产品后续研究(如组合产品的临床研究设计等)的开展提供建议和参考。
4.4新路径
世界各国都十分重视创新医疗产品,并出台了一系列鼓励创新产品研发的政策法规。例如,美国FDA推出Breakthrough Therapy/Device Designation,旨在加速开发和审查用于严重或危及生命的疾病的新药和医疗器械;在日本,修订后的《药品法》确立了再生医学产品的监管,2018 年成立监管科学中心,进一步加强了再生医学产品的审查和安全性。我国亦鼓励创新医疗产品的开发,发布了《创新医疗器械特别审查程序》《医疗器械优先审批程序》等多项政策,促进了组合产品的开发。截至2021年7月,NMPA已批准96家公司的115个创新医疗器械,其中9个是组合产品;此外,还通过优先审批程序批准了4个组合产品。
创新生物材料和技术进步促进了组合产品的研发和上市。各国组合产品的定义和监管方式存在差异。组合产品技术审评的关注点包括立题依据、PMOA、临床前评价和临床评价等,重点关注其新增风险-受益。未来的组合产品可能会更加复杂和创新,具有新的成分、技术和预期用途的组合产品可能带来新的受益和风险。创新组合产品的监管需要与时俱进的监管评价体系和上市后监督体系。组合产品评价的难度和复杂性,给监管部门带来了挑战和机遇,亟需监管科学的发展。2019年4月,国家药监局启动的中国药品监管科学行动计划将“药械组合产品技术评价研究”列为首批重点研究项目。组合产品监管科学的研究成果,将有利于组合产品的未来发展。
02、论文第一/通讯作者简介
第一作者/通讯作者:田佳鑫
国家药品监督管理局医疗器械技术审评中心副研究员,主要研究方向为药械组合产品安全有效性评价、医疗器械临床评价技术审评。
共同第一作者/通讯作者:宋旭
四川大学医疗器械监管科学研究院/国家药监局医疗器械监管科学研究基地/生物医学工程学院-国家生物医学材料工程技术研究中心副研究员,硕士生导师,张兴栋院士团队成员。主要研究方向为生物材料和组合产品研发和监管科学,新型靶向递药系统。
03、资助信息
本研究得到中国药品监管科学行动计划(药械组合产品技术评价)、国家自然科学基金(NSFC,No. 32001002)、国家重点研发计划(No. 2017YFE0102600)和四川大学博士后交叉学科创新启动基金的支持。
04、原文信息
Jiaxin Tian, Xu Song, Yongqing Wang, Maobo Cheng, Shuang Lu, Wei Xu, Guobiao Gao, Lei Sun, Zhonglan Tang, Minghui Wang, Xingdong Zhang,
Regulatory perspectives of combination products,
Bioactive Materials, 2021,
https://doi.org/10.1016/j.bioactmat.2021.09.002.

来源:BioactMater生物活性材料


