您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-10-18 10:50
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
康哲「替拉珠单抗」国内报NDA。康哲药业替拉珠单抗(tildrakizumab)的新药上市申请获CDE受理。替拉珠单抗是Sun Pharma开发的一款创新IL-23单抗,已在美国获批治疗适合接受全身治疗或光疗的中重度斑块型银屑病成人患者。康哲药业拥有替拉珠单抗在大中华地区(包括中国大陆、香港、澳门和台湾地区)开发、使用、销售、许诺销售及进口的许可权利。
国内药讯
1.甘李药业甘精胰岛素Ⅲ期临床成功。甘李药业生物仿制药甘精胰岛素注射液(GL-GLA)在美国和欧洲开展的糖尿病治疗III期临床结果积极。两项研究旨在评估甘李GL-GLA与对照药物来得时相比治疗1型(n=576)和2型(n=567)糖尿病的效果。26周的研究结果显示,两项研究均显示出同等的TI免疫原性。各组之间的疗效评估在预先规定的相似性边界内。GL-GLA和来得时之间的安全终点具有可比性。
2.BMS新型LPA1拮抗剂在华获批临床。百时美施贵宝1类新药BMS-986278-01片获国家药监局两项临床试验默示许可,将开展用于特发性肺纤维化治疗的临床研究。BMS-986278可能是百时美施贵宝开发的新型下一代LPA1拮抗剂。BMS-986278在Clinicaltrials.gov网站上登记了至少6项研究,其中2项在健康受试者中的试验已完成,另有1项针对特发性肺纤维化的单药和联合疗法的Ⅰ期临床研究也已完成。
3.加科思CD73单抗在美获批临床。加科思药业自主研发的CD73单抗JAB-BX102获FDA批准,即将在美国开展Ⅰ/Ⅱa期临床。JAB-BX102是加科思药业首个进入临床阶段的大分子项目。临床前数据表明,JAB-BX102具有剂量活性优势,有潜力使非小细胞肺癌、乳腺癌等多种实体瘤患者获益。全球范围内尚未有针对CD73靶点的药物获批。
4.礼新医药Claudin 18.2-ADC获批临床。礼新医药拥有自主知识产权和全球权益的I类新药LM-302获国家药监局临床试验默示许可。LM-302是一款靶向Claudin 18.2的抗体偶联药物,已在临床前研究中显示出良好的安全性及体内外活性,尤其在Claudin 18.2低表达的肿瘤模型中也显示出良好的药效。在美国,FDA已授予其孤⼉药资格认定,用于治疗胰腺癌,胃癌及胃⻝管交界部癌。
5.翰森再次布局siRNA疗法。翰森制药宣布与Silence Therapeuticsplc订立独家许可合作协议,利用后者的独家mRNAi GOLD™平台,合作开发针对三个靶点的siRNA疗法。翰森将获得前2个靶点药物Ⅰ期临床后在中国的独家选择权,和第3个靶点IND申报时的全国权利许可独家选择权。Silence将获得1600万美元的预付款,可能高达13亿美元的里程碑付款以及产品的销售分成。3天前,翰森刚与OliX Pharmaceuticals达成了超4.5亿美元的siRNA疗法的研发合作。
国际药讯
1.Tecentriq获批辅助治疗早期肺癌。FDA批准罗氏PD-L1抑制剂Tecentriq(atezolizumab)作为辅助疗法,用于II-IIIA期非小细胞肺癌患者(PD-L1≥1%)手术和含铂化疗后的治疗。Tecentriq是首个获批辅助治疗肺癌的癌症免疫疗法。一项Ⅲ期临床中期结果显示,这类患者经Tecentriq辅助治疗后,疾病复发或死亡风险降低34%(HR=0.66,95% CI:0.50-0.88)。详细结果已在《新英格兰医学杂志》上发表。
2.吉利德CD19-CAR-T新适应症获FDA批准。FDA批准吉利德旗下Kite公司CD19靶向CAR-T疗法Tecartus(brexucabtagene autoleucel,KTE-X19)的第4个适应症,用于治疗复发或难治性B细胞前体急性淋巴细胞白血病(B-ALL)成人患者。这也是全球首个ALL CAR-T细胞疗法。一项Ⅰ/Ⅱ期临床ZUMA-3结果显示,随访时间为12.3个月时,Tecartus在可评估患者(n=54)中有65%达到完全缓解(CR)或血液学不完全恢复的完全缓解(CRi),大多数患者CR持续时间超过12个月。
3.艾伯维IL-23抑制剂即将获批新适应症。欧洲药品管理局(EMA)人用药品委员会(CHMP)建议批准艾伯维(AbbVie)IL-23抑制剂risankizumab(Skyrizi)的第二项适应症,单药或联合甲氨蝶呤(MTX),用于治疗对抗风湿药(DMARDs)应答不足或不耐受的成人活动性银屑病关节炎。在两项关键性Ⅲ期临床中,与安慰剂相比,risankizumab在第24周达到了ACR20应答(关节肿胀和压痛症状改善20%)的主要终点。
4.辉瑞JAK1抑制剂获欧盟CHMP推荐。欧洲药品管理局人用药品委员会(CHMP)推荐批准辉瑞口服JAK1抑制剂abrocitinib上市,用于治疗适合全身治疗的中/重度特应性皮炎(AD)患者。在一项Ⅲ期临床JADE MONO-1中,与安慰剂相比,abrocitinib治疗组12周后皮肤症状达到或接近完全消失(IGA评分0/1)的患者比例更高(43.8%和23.7%,VS7.9%);湿疹面积和严重程度指数比基线改善至少75%的患者比例也更高(62.7%和39.7%,VS11.8%)。
5.再生元新冠鸡尾酒获FDA优先审评。FDA授予再生元中和抗体REGEN-COV生物制品许可申请(BLA)优先审评资格,用于治疗COVID-19非住院患者和某些患者的暴露后预防,PDUFA日期为明年4月。REGEN-COV是casirivimab和imdevimab的混合物,这两种中和抗体能够非竞争性与新冠病毒棘突蛋白受体结合区域非重叠位点结合,降低突变病毒逃逸风险。据悉,REGEN-COV对Delta、Gamma、Beta和Mu变体均有效力。
6.双重免疫组合疗法治疗肝癌Ⅲ期临床成功。阿斯利康PD-L1抗体Imfinzi联合CTLA-4抗体tremelimumab一线治疗无法切除肝细胞癌(HCC)的Ⅲ期临床达主要终点。与活性对照相比,Imfinzi显著延长患者的总生存期;而且联合治疗安全性良好,没有增加严重肝脏毒性。此外,Imfinzi单药治疗与活性对照组相比也达到非劣效性标准。FDA已批准Imfinzi用于治疗非小细胞肺癌和晚期膀胱癌。
7.罗氏拟开发治疗癫痫的基因疗法。罗氏旗下Spark公司与CombiGene就后者拟用于治疗耐药性局灶性癫痫的AAV基因疗法CG01达成独家合作和许可协议。根据协议,Spark将获得CG01在全球范围内的开发、生产和商业化权益。CombiGene将获得850万美元的前期付款和5000万美元的临床前和临床期里程碑付款。此项交易,将为CombiGene公司带来可能高达3.285亿美元的里程碑付款。
医药热点
1.卫健委通报16起医疗机构学术不端行为。10月15日,国家卫健委科技教育司通报了16起医疗机构医学科研诚信案件调查处理结果。共涉及14家医疗机构,相关人员主要涉及买卖、篡改数据、编造研究过程、不当署名、买卖论文等行为,分别被处以罚款、撤稿、诫勉谈话、五年内不得晋升职称、撤销博士学位等不同程度处罚。
2.Robert Califf获提名为FDA局长。据外媒报道,拜登政府正在审查目前在谷歌Verily任职的Robert Califf作为下一任FDA局长提名候选人的资格。Robert Califf曾在奥巴马时期担任过FDA局长一职。在2017年卸任FDA局长后,Robert Califf于同年5月加入谷歌旗下生命科学公司Verily。此外,他还为默沙东、阿斯利康、礼来和赛诺菲等多家大药厂做过咨询工作,并在制药公司Cytokinetics的董事会任职。
3.美国:接种疫苗的旅客不受入境限制。当地时间10月15日,美国白宫官员发布公告称,美国将于11月8日开始取消对已接种新冠疫苗的外国旅客的入境限制。据悉,美国将取消对来自包括中国、印度、巴西和欧洲大部分地区在内的33个国家和地区的航空旅行限制,已接种新冠疫苗的外国旅客也可从美国与加拿大或墨西哥的陆路边境进入美国。
评审动态
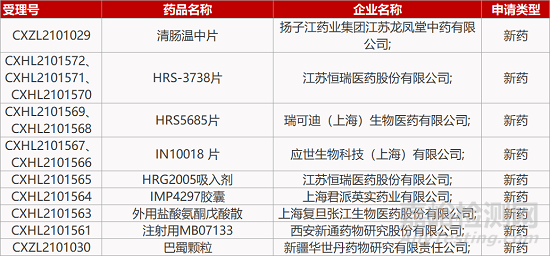
申请临床:
扬子江药业的清肠温中片、江苏恒瑞的HRS-3738片(3个规格)和HRG2005吸入剂、瑞可迪(上海)的HRS5685片(2个规格)、应世生物的IN10018 片(2个规格)、上海君派英实药业的IMP4297胶囊、上海复旦张江生物的外用盐酸氨酮戊酸散、西安新通药物公司的注射用MB07133、新疆华世丹药物公司的巴蜀颗粒
申请生产:
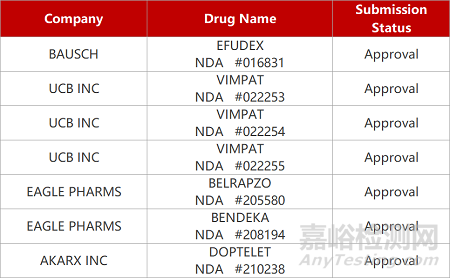
2. FDA新药获批情况(北美10月14日)

来源:药研发


