您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-08-09 17:06
MDR于今年5月26日已经正式实施,对于MDR条款33中要求建立的UDAMED数据库,想必关于欧盟新法规的人都不算陌生。UDAMED数据库中的经济运营商注册模块已向公众开放,不少制造商已经申请了SRN号。
UDAMED数据库的六大模块的建立主要是促进 1)MDR 下有关相关经济运营商注册(参与者注册);2)设备和系统和程序包 (UDI);3)公告机构和证书;4)符合性评定;5)临床调查;6)警戒和市场监督以及上市后的监督。
UDAMED数据库全部功能预期2022年5月与IVDR正式实施时同步开放,但是MDR已经与2021年5月26日正式实施,在这个过渡期内,相关方同样需要考量UDAMED数据库。具体如何执行,MDCG发布了指南文件MDCG-2021-1。针对这份指南,我们将用两篇文章进行完整的解读。这篇文章主要解读这个指南文件对过渡期的整体要求,下一篇文章则解读每个模块的具体要求,欢迎持续关注微珂咨询。
MDR条款规定的与UDAMED数据库相关的活动主要如下



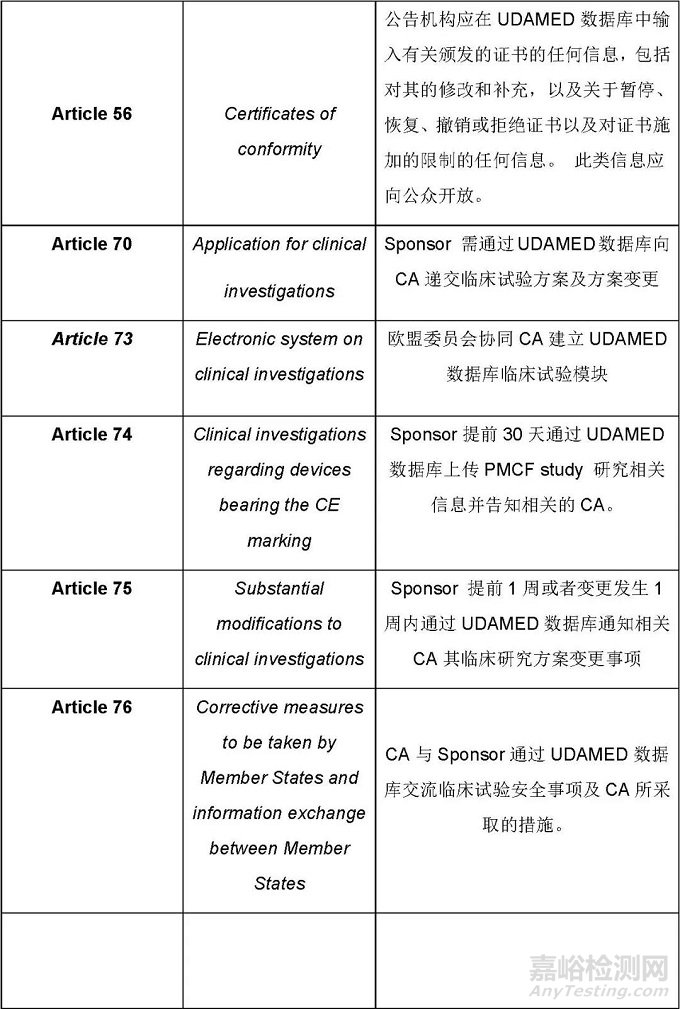
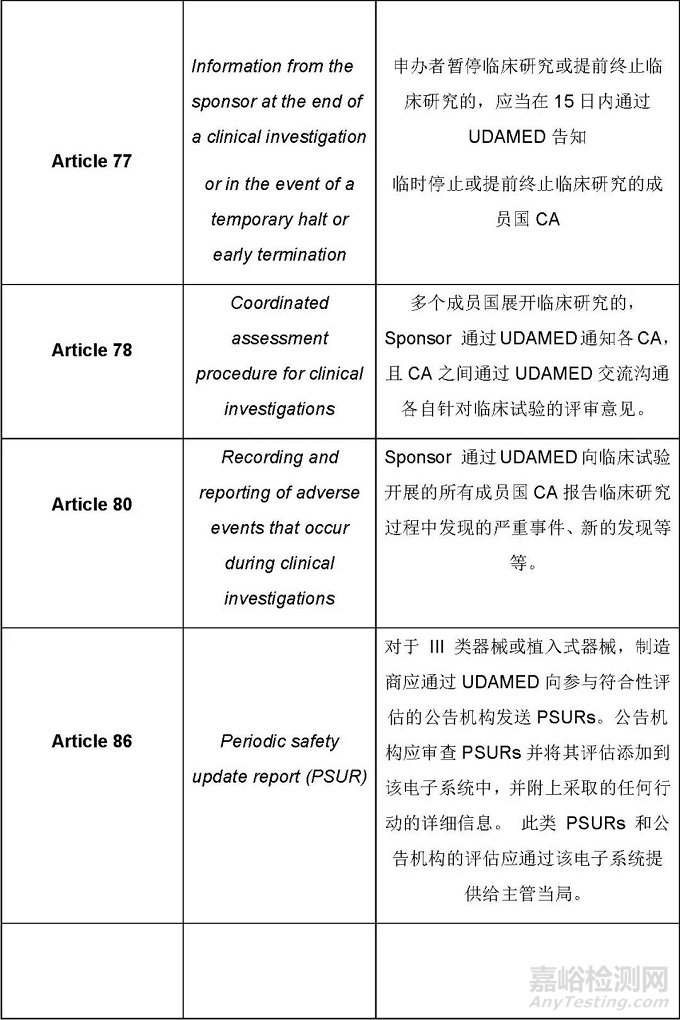

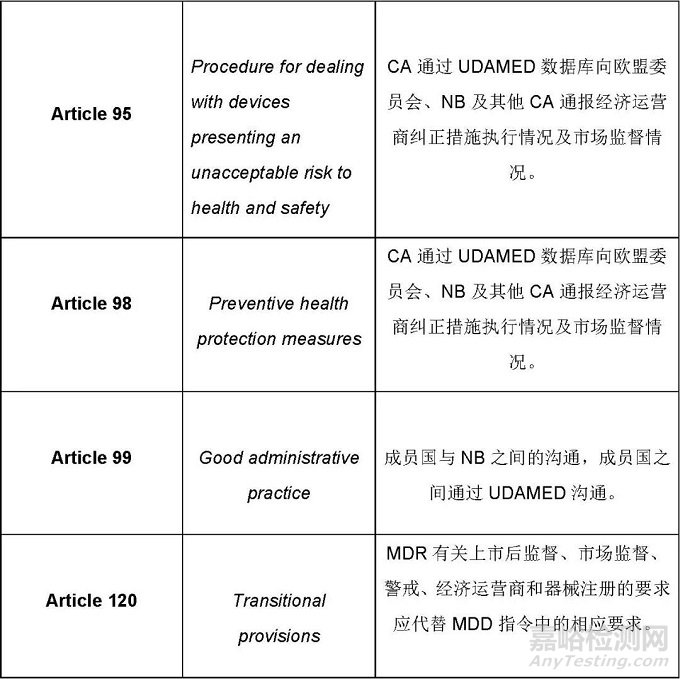
这篇文章仅罗列出来了与UDAMED数据库有关的条款及总体要求。基于这些要求,制造商需要思考的是哪些是直接与制造商相关的,哪些是间接相关的,制造商应该怎样配合相关方执行与UDAMED相关的过程。识别出来所有相关的过程后,应通过建立程序文件、SOP等把这些过程纳入质量管理体系,相关的人员依据质量管理体系的要求执行相关的活动,这样才能确保法规的要求不会遗漏。

来源:微珂器械服务


