您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-16 09:28
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
大冢儿科品种拟纳入优先审评。大冢制药阿立哌唑口服溶液,以符合儿童生理特征的儿童用药新品种、剂型和规格,被CDE拟纳入优先审评,拟定适应症为:6~17岁儿童和青少年的孤独症易激惹症状;6~17岁儿童和青少年的抽动秽语综合征。阿立哌唑是全球首个上市的多巴胺(DA)-5羟色胺(5-HT)系统稳定剂,由大冢和灵北制药联合开发,用于精神分裂症的治疗。目前国内已有多款仿制药获批,涵盖普通片剂、口崩片、胶囊剂、口服溶液等多种剂型。
国内药讯
1.可瑞达国内获批一线治疗结直肠癌。默沙东PD-1帕博利珠单抗(可瑞达,Keytruda)获NMPA批准,单药用于KRAS、NRAS和BRAF基因均为野生型、不可切除或转移性高微卫星不稳定性(MSI-H)或错配修复基因缺陷型(dMMR)结直肠癌(CRC)患者的一线治疗。这是Keytruda在国内获批的第7项适应症。在关键性国际Ⅲ期临床KEYNOTE-177中,Keytruda将疾病进展或死亡风险降低40%,中位无进展生存期提高两倍多(16.5个月vs8.2个月)。
2.翰思生物启动CD47/PD-1双抗Ⅱ期临床。翰思生物宣布启动CD47/PD-1双特异性抗体HX009注射液用于治疗晚期实体瘤的Ⅱ期临床。在澳大利亚开展的Ⅰ期临床数据显示,在20例可评估患者中,3例患者(15%)达到部分缓解(PR),客观缓解率(ORR)为15%;有7例患者(35%)达到疾病稳定(SD),疾病控制率(DCR)为50%。临床中暂未观察到剂量限值性毒性及最大耐受剂量,HX009的安全性和耐受性总体良好。
3.百济神州CD70单抗国内获批临床。百济神州CD70单抗SEA-CD70 获国家药监局临床试验默示许可,拟开发用于复发/难治性骨髓增生异常综合征和急性髓系白血病的治疗。SEA-CD70是百济神州合作伙伴Seagen开发的的一款1类新药,去年已在美国启动一项I期临床。国内,尚未有针对CD70的单抗或ADC进入临床阶段。据悉,浙江医药也布局了该靶点,其子公司新码生物拥有Ambrx 公司CD70 ADC产品ARX305的中国权益。
4.信达VEGF靶点眼疾品种获批临床。信达生物1类新药IBI302获CDE临床试验默示许可,拟用于治疗糖尿病性黄斑水肿(DME)。IBI302是一款“first-in-class”VEGF/补体双靶点融合蛋白,此前已在国内获批开展针对湿性年龄相关性黄斑变性(wAMD)、新生血管性年龄相关性黄斑变性(nAMD)的临床研究。一项用于治疗nAMD的Ⅰ期临床数据显示,BI302可以提高最佳矫正视力、改善视网膜厚度和新生血管的渗漏与总面积;其安全性特征与现有单靶点VEGF药物类似。
5.宜明昂科CD47靶向抑制剂报IND。宜明昂科CD47融合蛋白注射用IMM01的临床试验申请获CDE受理。IMM01可特异性激活巨噬细胞,使其将肿瘤细胞的抗原传递给下游的T细胞,从而起到显著的肿瘤免疫治疗效果。同时,由于IMM01不与人红细胞结合,在安全性上具有明显优势。此外,IMM01具有特殊的糖基化修饰,在降低药物的免疫原性的同时,还能显著提高其生物利用度。此前,IMM01已在国内启动针对淋巴瘤的相关临床试验。
国际药讯
1.罗氏眼科双抗品种在日本报产。罗氏旗下中外制药株式会社在日本递交VEGF-A/Ang-2双抗Faricimab的新药申请,用于治疗糖尿病黄斑水肿(DME)和新生血管性年龄相关性黄斑变性(nAMD)。此次申请是基于在DME患者中开展的YOSEMITE和RHINE研究,以及在nAMD患者中开展的TENAYA和LUCERNE研究的积极结果。其中,在TENAYA和LUCERNE研究中。每隔16周注射一次faricimab的患者的视敏度结果非劣效于每8周注射阿柏西普的效果。
2.Novavax重组蛋白新冠疫苗Ⅲ期临床积极。Novavax公司重组蛋白纳米颗粒新冠疫苗NVX-CoV2373在关键性Ⅲ期临床PREVENT-19中达到主要终点。试验数据显示,该疫苗的总体保护效力达到90.4%(95% CI:82.9,94.6)。此外,它针对中重度COVID-19的防护效力为100%(95% CI:87,100),在高风险人群中有效性为91%(95% CI:83.6,95.0)。而且,NVX-CoV2373对主要关注突变株(VoC)/待观察突变株(VoI)也表现出良好的保护效力。
3.CD37靶向ADC组合Ⅱ期临床结果积极。Debiopharm公司CD37靶向抗体偶联药物(ADC)naratuximab emtansine联合利妥昔单抗在治疗复发/难治性(R/R)弥漫性大B细胞淋巴瘤(DLBCL)的Ⅱ期临床中获积极结果。公布于EHA2021年会上的最新结果显示,这一组合在可评估患者(N=76)中的客观缓解率(ORR)为44.7%,CRR为31.6%。中位缓解持续时间(DoR)尚未达到,66%的缓解者DoR大于12个月。而且这一组合的安全性可控。
4.tau蛋白疫苗AD治疗Ⅱ期临床有戏。Axon Neuroscience公司用于治疗阿尔茨海默病(AD)的tau蛋白疫苗AADvac1的Ⅱ期临床详细结果在《自然》子刊Nature Aging发表。试验结果表明,AADvac1具有良好的安全性和耐受性。在通过疾病生物标志物确认的AD患者中,与安慰剂相比,AADvac1将通过CDR-SB检测的临床衰退速度延缓27%(p=0.048),将通过ADCS-MCI-ADL检测的功能衰退延缓30%(p=0.039);而且该治疗组患者血液中的NfL水平与安慰剂组相比降低62%(p=0.010)。
5.Vertex罕见病新药将停止后期开发。Vertex公司候选产品VX-864在PiZZ基因型α-1抗胰蛋白酶缺乏症(AATD)患者中开展的II期概念验证研究达到主要终点。与安慰剂相比,VX-864组28天后血浆功能性α-1抗胰蛋白酶(fAAT)水平较基线变化值均显著提高,VX-864组fAAT水平增加2.2~2.3微摩尔,而安慰剂组下降0.1微摩尔。但是研究中观察到的治疗效果不太可能转化为实质性的临床效益,该公司宣布将停止VX-864后期开发,进一步推出提高临床疗效的新型小分子校正剂。
6.GSK联手iTeos开发抗TIGIT抗体免疫疗法。葛兰素史克(GSK)和iTeos Therapeutics公司达成合作协议,将共同开发和推广iTeos处于早期临床的TIGIT抗体EOS-448。根据协议,iTeos将获得6.25亿美元的前期付款,以及额外14.5亿美元的里程碑付款;两家公司将共同分担EOS-448的开发成本。此外,这项合作让GSK将拥有与CD226免疫检查点通路相关的三个不同靶点(TIGIT、CD96和PVRIG)的在研抗体疗法。它们可能具有协同作用的潜力。
医药热点
1.南非要求数百万剂强生新冠疫苗换货。南非卫生产品监管局13日发表一份声明,该机构评估FDA提供的数据后,决定不发放强生公司交付的可能存在原料污染问题的200万剂新冠疫苗。目前“问题疫苗”储存在南非最大药企爱施健公司的实验室内。南非政府正与美国强生公司商量退换这批疫苗。
2.FDA神经系统药物咨询委员会3名专家辞职。FDA日前批准了渤健的阿尔兹海默症新药Aducanumab(商品名Aduhelm)上市,在业界引起争议,并引起了FDA专家委员会的强烈不满。此前他们以10票反对,1票弃权,0票同意的压倒性票数反对该药物上市。目前外周和中枢神经系统药物专家小组成员梅奥医学中心的神经病学家David Knopman博士、华盛顿大学神经病学家 Joel Perlmutter博士和哈佛大学教授Aaron Kesselheim 已宣布辞任。
3.儿童重疾救治管理措施收效显著。国家卫健委召开新闻发布会,介绍儿童血液病、恶性肿瘤救治管理工作进展。据介绍,国家卫健委目前正从3个方面积极、有序地推进儿童重疾救治管理工作。截至2020年年底,国家卫健委已将11.5万名儿童血液病、恶性肿瘤患儿纳入监测管理体系,血液病、恶性肿瘤患儿平均住院总费用较2019年上述政策实施前下降5.69%,其中自付费用下降10.89%。
审评动向
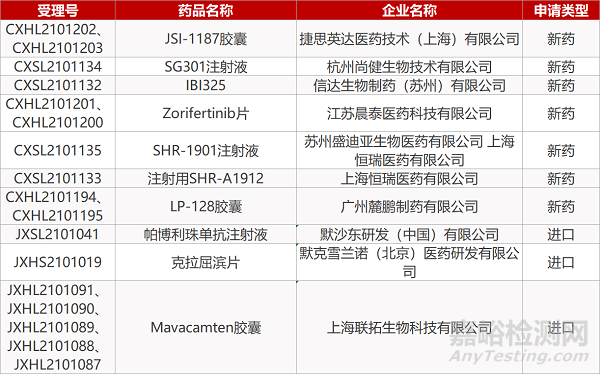
1. CDE新药受理情况(06月15日)
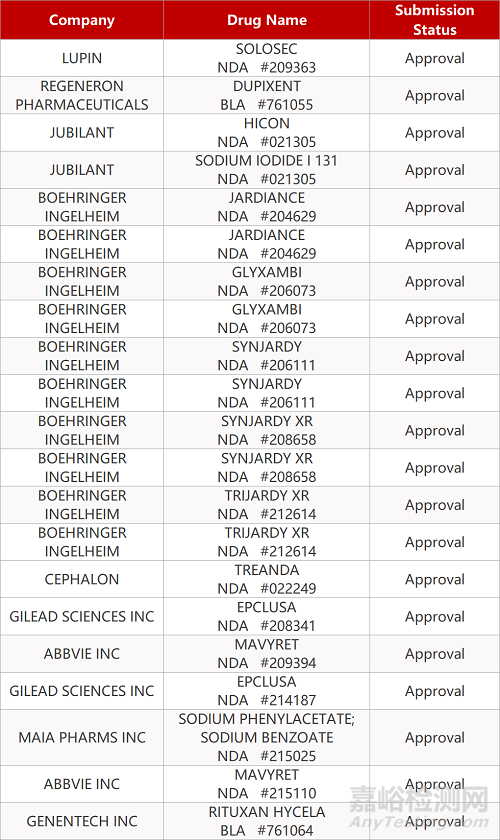
2. FDA新药获批情况(北美06月14日)

来源:药研发


